恩替卡韦联合微生态制剂治疗乙型肝炎肝硬化患者的临床效果分析
陈小琴
福建省三明市永安总医院感染科,福建三明 366000
慢性乙型肝炎是由乙肝病毒感染导致弥漫性肝损害,其中全世界乙型肝炎病毒感染20 亿人次,其中有17%患者转变为慢性感染[1]。 慢性乙型肝炎患者体内病毒持续复制,不断进展下会形成肝硬化。 待患者进入肝硬化后会出现一系列严重并发症,如感染、上消化道出血、肝性脑病等并发症,甚至会诱发肝癌。 因此临床治疗乙型肝炎肝硬化时,需有效抑制病毒的复制,调节机体免疫功能、抗氧化、抗纤维化等对症治疗。 但部分患者规范抗病毒治疗后,仍出现肝纤维化进展情况,说明仍有其他因素促使肝纤维化进展。 有研究[2]发现,慢性乙型病毒感染后患者常伴有内分泌紊乱, 体内内毒素不断吸收进而加重病情。 因此调节体内微生态对肝硬化的优势受到临床重点关注。 方便选取2017 年1 月—2019 年6 月期间该院科室收治的85 例乙型肝炎肝硬化患者作为研究对象, 现该研究就对乙型肝炎肝硬化患者采用恩替卡韦联合微生态制剂治疗进行探讨,旨为临床治疗提供依据,现报道如下。
1 资料与方法
1.1 一般资料
方便选取该院科室收治的85 例乙型肝炎肝硬化患者,按不同治疗方法分为两组,即对照组42 例,男28例,女14 例;年龄28~70 岁,平均年龄(49.17±6.25)岁;病程1~14 年,平均(6.91±2.48)年。 观察组43 例,男27例,女16 例;年龄28~72 岁,平均年龄(50.49±6.32)岁;病程1~15 年,平均(7.18±2.45)年;两组患者基线资料比较差异无统计学意义(P>0.05),具有可比性。 该次研究经伦理委员会批准,并签订患者及家属知情同意书。
1.2 纳入与排除标准
纳入标准:①所有患者有慢性乙型肝炎病史,肝功能减退及门静脉高压;B 超、CT 等检查存在肝硬化表现;符合《慢性乙型肝炎防治指南(2015 年版)》[3]中慢性乙型肝炎标准;符合肝硬化[4]标准;②认知清晰,依从性良好;③自愿参加研究;④治疗前未接受抗生素、微生态活菌制剂等治疗。
排除标准:①伴丙肝、甲肝等其他病毒感染;②因药物、酒精等其他因素导致的肝硬化;③合并肝癌、凝血机制异常等疾病;④合并肝癌者;⑤妊娠期或哺乳期女性;⑥研究期间主动退出者。
1.3 方法
两组患者常规进行保肝、营养支持等对症治疗。 对照组服用恩替卡韦分散片(国药准字H20100019),服用0.5 mg/次,1 次/d;观察组服用恩替卡韦分散片时,加服双歧杆菌三联活菌胶囊(国药准字S10950032),630 mg/次,2 次/d;两组连续治疗6 个月。
1.4 观察指标
两组于治疗6 个月后评价其治疗效果, ①比较两组肝功能指标,即于治疗前、治疗后各采集空腹静脉血3 mL,全自动生化分析仪测定白蛋白(ALB)、谷丙转氨酶(ALT)、总胆红素(TBIL)及谷草转氨酶(AST);②比较两组肝纤维化变化,Hotgen UPT-3A 上光发光分析仪检测层黏连蛋白(LN)、透明质酸(HA)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(CⅣ);③比较两组患者HBV-DNA 转阴率,采用PCR 法测定;④比较两组患者治疗期间的累计不良反应,有恶心呕吐、腹胀、腹痛、过敏等。
1.5 统计方法
采用SPSS 23.0 统计学软件进行数据分析。 计量资料以()表示,采取t 检验;计数资料以百分比率(%)表示,采取χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 肝功能指标
两组患者治疗前的ALB、ALT、AST、TBIL 水平比较差异无统计学意义(P>0.05),治疗后的ALT、AST、TBIL水平下降,ALB 升高,且观察组改变更明显,差异有统计学意义(P<0.05),见表1。
2.2 肝纤维化变化
治疗前两组患者的LN、HA、PCⅢ、CⅣ水平比较,差异无统计学意义(P>0.05),治疗后患者的LN、HA、PCⅢ、CⅣ水平下降,其中观察组下降更明显,差异有统计学意义(P<0.05),见表2。
2.3 HBV-DNA 转阴率
观察组治疗3 个月、6 个月HBV-DNA 转阴率高于对照组,差异有统计学意义(P<0.05),见表3。
表1 两组患者肝功能指标比较()

表1 两组患者肝功能指标比较()
组别观察组(n=43)对照组(n=42)t 值P 值ALB(g/L)治疗前 治疗后26.2±4.8 25.9±5.2 0.276>0.05 37.2±2.5 32.2±3.1 8.195<0.05 ALT(U/L)治疗前 治疗后TBIL (μmol/L)治疗前 治疗后139±26 142±25 0.542>0.05 36±10 56±15 7.249<0.05 68.1±6.1 67.8±6.5 0.220>0.05 16.6±1.8 24.7±2.7 16.310<0.05 AST(U/L)治疗前 治疗后141±15 139±18 0.557>0.05 35±5 46±7 8.352<0.05
表2 两组患者肝纤维化变化比较[(),μg/L]
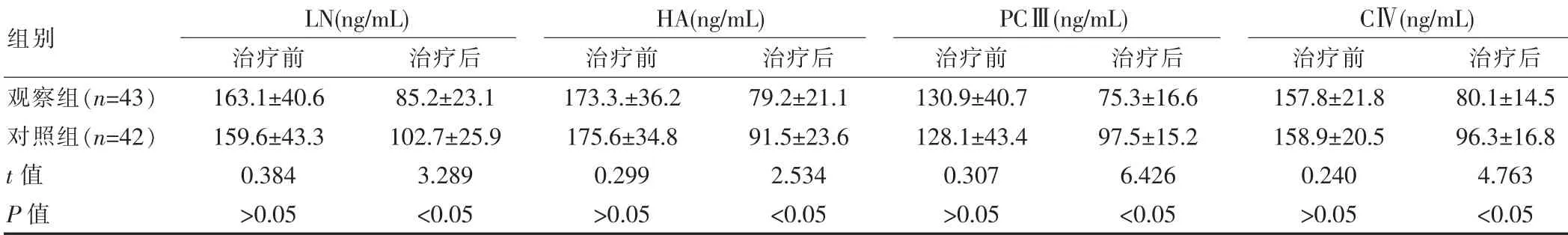
表2 两组患者肝纤维化变化比较[(),μg/L]
组别观察组(n=43)对照组(n=42)t 值P 值LN(ng/mL)治疗前 治疗后163.1±40.6 159.6±43.3 0.384>0.05 85.2±23.1 102.7±25.9 3.289<0.05 HA(ng/mL)治疗前 治疗后PCⅢ(ng/mL)治疗前 治疗后173.3.±36.2 175.6±34.8 0.299>0.05 79.2±21.1 91.5±23.6 2.534<0.05 130.9±40.7 128.1±43.4 0.307>0.05 75.3±16.6 97.5±15.2 6.426<0.05 CⅣ(ng/mL)治疗前 治疗后157.8±21.8 158.9±20.5 0.240>0.05 80.1±14.5 96.3±16.8 4.763<0.05
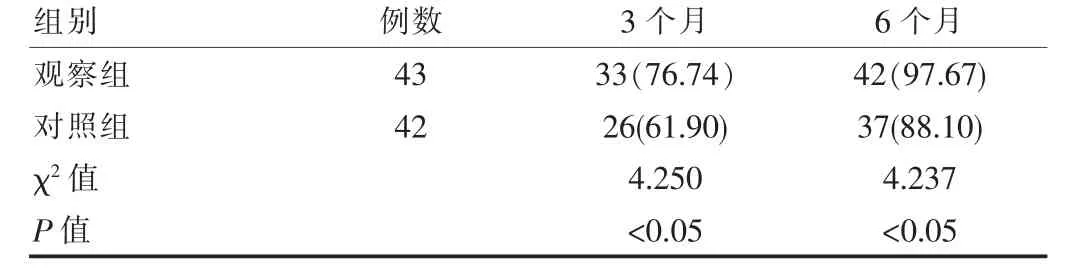
表3 两组患者HBV-DNA 转阴率比较[n(%)]
2.4 治疗期间患者累计不良反应
对照组患者出现恶心呕吐2 例,1 例腹痛, 发生率7.14%;观察组出现恶心呕吐1 例,1 例腹痛,1 例腹胀,发生率6.98%;差异无统计学意义(χ2=0.000,P>0.05)。
3 讨论
肝硬化是一种因各种因素导致的慢性肝损害,属于不可逆性疾病,若进入晚期甚至会诱发腹水、肝性脑病等并发症,导致患者死亡[5]。 乙型肝炎后肝硬化患者是因乙型肝炎病毒的持续复制, 造成机体内免疫功能紊乱,病毒难以清除,进而加重肝脏炎症反应,造成肝细胞纤维化。 因此临床治疗合并症时,需有效、长久抑制乙型肝炎病毒,以核苷类药物抗病毒治疗。 恩替卡韦是治疗乙型肝炎肝硬化的主要抗病毒药物, 属于一种鸟嘌呤核苷类似物,进入体内磷酸化后,形成一种恩替卡韦三磷酸盐,具有一定活性,能竞争性结合HBV 多聚酶的底物三磷酸脱氢鸟瞟岭核昔,进而阻断HBV 多聚酶的启动途径, 抑制病毒mRNA 的逆转、 复制,使HBV DNA 正链的结合、释放途径受到干扰,以此阻断病毒的复制, 发挥显著的抗病毒作用, 且高于拉米夫定、阿德福韦酯等抗病毒药物。 但单独抗病毒治疗,仍有部分患者肝纤维化持续进展, 肝硬化进展未得到控制, 进而选择一种更为合理有效的药物成为临床研究热点[6]。
肝脏与肠道有着密切关系, 因肝门静脉与肠系膜淋巴系统相互联系。 其中肝脏80%的血供来源于肝门静脉,经肠道血液汇至肝脏,同时会吸收肠道内的病原菌,如内毒素脂多糖、肠源性细菌、肠道菌群产物等,影响着肝脏的代谢功能; 同时肠道淋巴细胞及细胞因子通过肝门静脉进入肝脏,肝脏有胆汁分泌、促进肠肝循环的功能,进而作用肠道吸收功能,调节肠道的免疫细胞及细胞因子功能。 乙型肝炎肝硬化患者胆汁分泌减少,会破坏肠道平衡状况,促使肠道致病菌生成;肝硬化患者长期营养不良会损害肠道壁微绒毛, 减少白蛋白含量,造成肠道水肿、蠕动减慢,导致肠道瘀血、缺血及缺氧;此外抗生素的滥用,制酸剂不合理应用,均会引起二重感染造成肠道微生态紊乱。 双歧杆菌三联活菌胶囊是一种肠道益生菌, 能够为肠道提供必须的生理物质,清除肠道内的致病菌,维持肠道菌群微生态的平衡[7]。
该组研究中, 观察组治疗后ALT、AST、TBIL 水平低于对照组,ALB 高于对照组,LN、HA、PCⅢ、CⅣ水平低于对照组, 治疗3 个月、6 个月HBV-DNA 转阴率76.74%、97.67%高于 对 照 组 的61.90%、88.10%(P <0.05)。 其结果与侯慧等[8]研究相一致,其数据显示观察组HBV-DNA 转阴率95.13%高于对照组的80.49%(P<0.05)。多研究表明,恩替卡韦联合双歧杆菌三联活菌胶囊,能促使患者肝功能尽快恢复,抑制病毒,改善肝纤维化,延缓病情进展。 该研究中在药物不良反应方面,观察组不良反应发生率6.98%, 对照组发生率7.14%(P>0.05)。 说明恩替卡韦联合微生态制剂的应用,并不会增加药物不良反应,安全性高。
综上所述,恩替卡韦联合微生态制剂治疗乙型肝炎肝硬化患者有显著效果,抗病毒作用明确,有助于肝功能的改善,减轻肝纤维化,不良反应少。

