不同物种龙葵对镉胁迫的生理响应研究
花 莉, 马 倩, 常江峰, 杨春燕
(陕西科技大学 环境科学与工程学院, 陕西 西安 710021)
0 引言
土壤作为环境介质之一,是人类不可或缺的重要资源.然而随着经济的快速发展,频繁的人类活动引发了严重的土壤环境污染问题.而重金属污染由于其毒性大,难降解性和隐蔽性等特点,使得现阶段我国土壤重金属污染较为严重.镉是环境中毒性最强的重金属之一,具有很强的从土壤向植物迁移的能力,且极易被植物吸收积累[1].当土壤中的镉含量超过一定值时则会引起植物的毒害作用,可表现为植株的生长缓慢、矮小和褪绿等,其细胞的膜透性、光合代谢、呼吸代谢、酶代谢和遗传效应等也会发生一些改变,从而导致生物量的下降[2,3].镉一旦通过食物链进入人体亦会造成严重而不可逆伤害,修复治理镉污染的土壤刻不容缓.与传统的物理、化学和工程等修复手段相比,植物修复方法简单易操作,能耗较低,且成本低廉,有利于保持土壤生态环境系统.因此,选择植物修复镉污染土壤具有一定研究意义.
龙葵(Solanumnigrum)作为一种镉的超富集植物[4],具有耐Cd毒害和富集Cd的能力,因其繁殖能力强、生长迅速、生物量大等优势[5],成为潜在的镉污染修复优势植物[6].有研究表明,对于Cd敏感的植物来说,短时间Cd污染或Cd处理明显干扰其正常生长发育,表现为生长受抑、叶绿素含量降低等[7-9].郭智等[10]发现在Cd的胁迫下龙葵叶片的光合作用会受到抑制,但其光合生理响应以及主要的光合限速因子还有待研究.本研究通过考察Cd对不同物种龙葵的生长及生理响应的影响,旨在为龙葵的耐镉机理研究提供一定的理论依据.
1 实验部分
1.1 供试材料
供试龙葵种子分别选自吉林长春德惠市、汉中宁强县、广东九龙山,编号分别为JL,HZ,GD.JL是红果龙葵(SolanumalatumMoench),HZ是黄果龙葵(Solanumdiphyllum),GD是少花龙葵(SolallumnigrumL.verPauciflorumLiou).
1.2 实验设计
挑选饱满圆润、大小均一的种子用去离子水浸泡后均匀播种于穴盘,置于人工培养间,每隔两天浇一次水.培养条件为:昼夜温度26 ℃/20 ℃,昼夜时间16 h /8 h,相对湿度60% 左右.待大部分幼苗长出3片真叶后转至蓝色周转箱,用1/2 Hoagland培养液培养四周,根据幼苗长势,3~5天更换一次培养液.幼苗生长4周后株高约18~20 cm.挑选长势良好且一致的龙葵转移至黑色水培罐中进行Cd胁迫处理.其中Cd以CdCl2·2.5H2O形式加入1/2 Hoagland培养液中,设置Cd2+浓度梯度分别为0(CK)、5、10、15、20、25、50、100 mg·L-1,每个处理设置3个平行.
1.3 测定方法
各项生理指标:将龙葵的根、茎和叶用清水冲洗,再用去离子水洗净,于105 ℃下杀青30 min,然后在 80 ℃下烘至恒重,测定干重.叶绿素采用丙酮乙醇混合液提取法测定[4],丙二醛(MDA)含量用硫代巴比妥(TBA)酸法测定[10],超氧化物歧化酶(SOD)活性用氮蓝四唑(NBT)光化还原法测定[11],过氧化物酶(POD)活性用愈创木酚法测定[11],过氧化氢酶(CAT)活性用过氧化氢法测定[12].
2 结果与讨论
2.1 Cd胁迫对龙葵生物量的影响
由表1可知,在Cd处理7 d后,除GD的根和叶的生物量呈逐渐下降的趋势外,其余两种龙葵的根、茎、叶和GD的茎的生物量均呈先升高后降低的趋势.当Cd处理浓度为5 mg·L-1时,JL的根、茎、叶的生物量都分别达到最大值0.103 5 g,0.193 8 g,0.439 6 g,分别是对照的1.01倍、1.19倍和1.35倍.当Cd处理浓度≥10 mg·L-1时,JL的根生物量低于对照7.02%~71.47%,当Cd处理浓度≥20 mg·L-1时,JL的茎生物量低于对照11.52%~42.83%,叶的生物量显著低于对照17.04%~48.46%.当Cd处理浓度为5 mg·L-1时,HZ的根、茎、叶的生物量都分别达到最大值0.112 5 g、0.174 9 g和0.438 2 g,分别是对照的1.74倍、1.07倍和1.33倍.当Cd处理浓度≥20 mg·L-1时,HZ的根生物量显著低于对照14.57%~61.55%(P<0.05),当Cd处理浓度≥10 mg·L-1时,HZ的茎生物量显著低于对照19.94%~74.54%(P<0.05),叶的生物量显著低于对照1.6%~41.93%(P<0.05).GD只有茎的生物量呈现先增高后降低的趋势,根和叶的生物量随着Cd处理浓度的增加而减少.当Cd处理浓度为5 mg·L-1时,GD茎的生物量最大,是对照的1.16倍.当Cd处理浓度≥15 mg·L-1时,GD的根生物量显著低于对照18.09%~51.33%(P<0.05),当Cd处理浓度≥20 mg·L-1时,茎生物量显著低于对照26.58%~34.98%(P<0.05).

表1 不同浓度 Cd 胁迫7d后龙葵的根、茎、叶的生物量
植物对重金属的耐性可以根据植物地上部以及根系生物量的变化作为指标[13],土壤Cd含量过高会对植物产生一定的毒害作用,表现为植物体叶绿素结构破坏,植物叶、茎黄化甚至脱落,根系的生长由于水分以及营养物质的减少遭受一定阻碍,导致植物的生物量降低[14].植物在受到恶劣环境的影响时,生长的变化是可以最先观察到的指标响应,尤其是在受到污染的土壤上生长的植物,其根部需要直接从土壤里汲取营养,会快速地表现出毒害特征[15].而低浓度会刺激植物生长,高浓度会抑制植物的生长,即“低促高抑”现象[16].王涛等[17]通过水培试验研究镉对龙葵幼苗生长的影响,结果表明,低浓度Cd处理(<25μmol·L-1)对龙葵幼苗干物质量的影响不明显,甚至对某些参数有一定的促进作用,高浓度Cd处理(>50μmol·L-1)对龙葵幼苗的生理指标有抑制作用.本研究中,低浓度Cd处理对GD的根和叶同样造成了抑制作用,而对另外两种龙葵还有一定的促增长作用.
2.2 Cd胁迫对龙葵叶绿素含量的影响
在Cd胁迫下,3种龙葵的叶片的叶绿素含量随Cd处理浓度的增加均有所降低(如图1所示),与CK相比,JL、HZ、GD的叶绿素a、叶绿素b、类胡萝卜素均显著降低(P<0.05).JL、HZ、GD(按此顺序,下同)的叶绿素a分别降低4.12%~50%,6.4%~59%,9%~41%,叶绿素b分别降低0.47%~51.16%,10.2%~46.94%,4.65%~39.53%,类胡萝卜素分别降低6.06%~41.82%,16.67%~22.22%,17.65%~41.18%;在Cd胁迫下,HZ的叶绿素a含量最大降低了59%,JL的叶绿素b含量最大降低了46.94%,JL和GD的类胡萝卜素含量下降幅度相近,而HZ的类胡萝卜素含量下降幅度较小.

(a)JL叶绿素含量
3种龙葵的叶片的叶绿素含量随Cd处理浓度的增加而降低,而HZ的叶片的叶绿素含量受到的抑制作用最小.大量的研究结果表明逆境胁迫会降低植物叶片的叶绿素含量,而较高的叶绿素含量是维持植物正常光合作用的基础,另外,还有一些研究发现,Cd 胁迫还会直接影响叶绿体数量并使其减少或破坏叶绿体的结构[18].孙瑞莲[19]研究龙葵和茄子对Cd胁迫的耐性特征,在低Cd水平下(T1和T2),龙葵的叶绿素含量与对照相比无显著差异(P>0.05),但随着Cd浓度的升高,叶绿素含量显著降低(P<0.05),而Cd处理显著影响茄子的叶绿素含量.王涛等[17]也研究发现10μmol·L-1Cd处理下,龙葵幼苗叶片中的色素含量较对照显著降低,随着Cd处理浓度的增加,叶片色素遭到更大的破坏,具有一定的浓度效应.
2.3 Cd胁迫对龙葵丙二醛(MDA)含量的影响
在Cd胁迫下,3种龙葵的根和叶的MDA含量都随着Cd浓度均不同程度呈先增加后下降趋势(如图2所示).JL的根和叶的MDA含量均在Cd处理浓度为10 mg·L-1时达到最大值,随后根的MDA含量一直下降,在Cd处理浓度≥50 mg·L-1,MDA含量显著低于CK(P<0.05),叶的含量虽一直下降,却始终高于CK;HZ、GD的根和叶的MDA含量分别在Cd处理浓度为25 mg·L-1、20 mg·L-1时达到最大值,随后根和叶的MDA含量都开始下降,但仍显著高于CK(P<0.05).
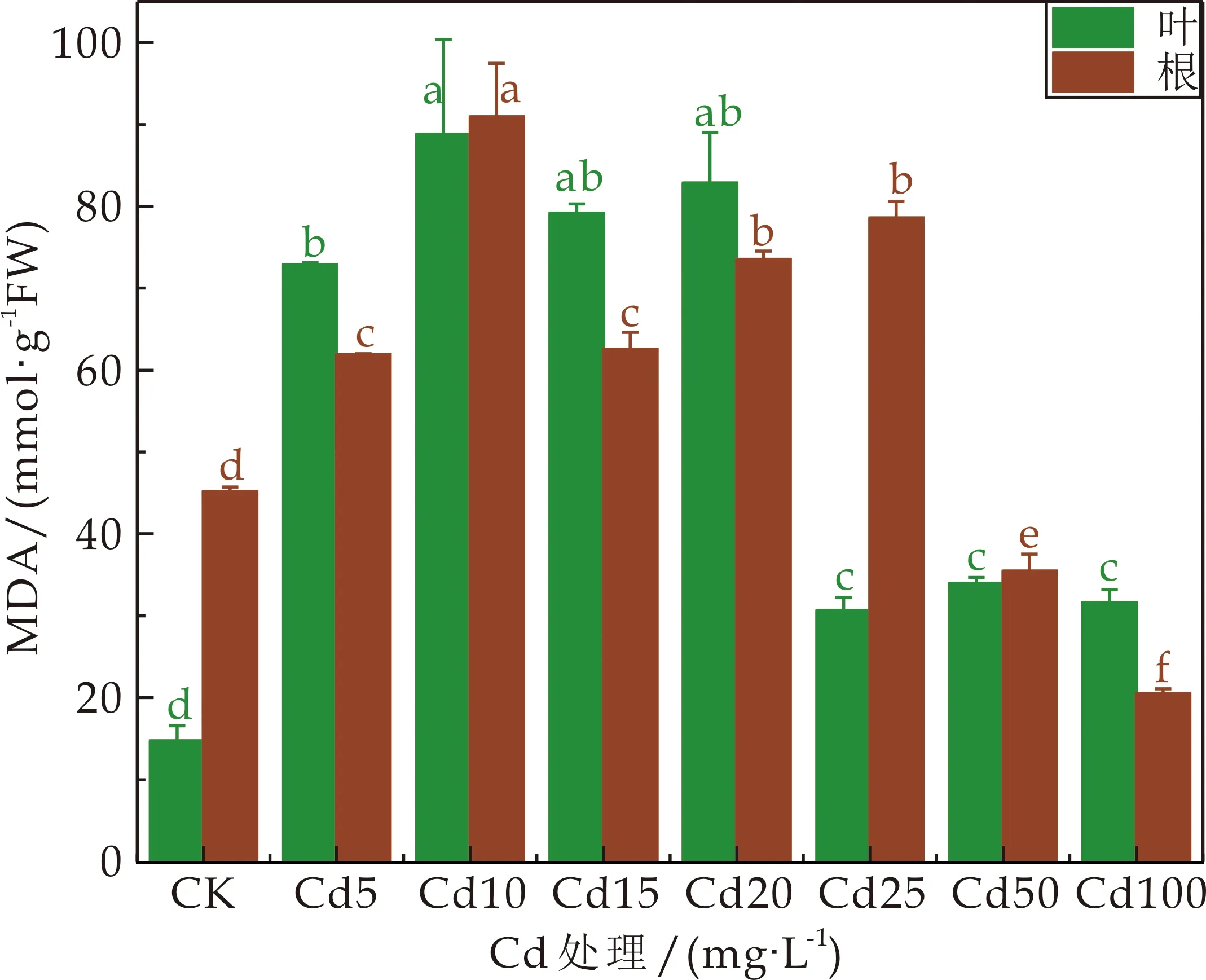
(a)JL丙二醛(MDA)含量
衰老或逆境环境下的植物会产生过量自由基,这些自由基会引发植物体内膜脂过氧化作用,其毒性产物丙二醛(MDA)是植物在环境胁迫下膜脂过氧化而产生的一种具有细胞毒性的物质,其含量常作为反映逆境条件下植物受伤害程度的指标之一[20],MDA 的积累说明植物细胞膜脂过氧化加重,植物细胞中MDA含量越多,植物受损伤越严重[21].本研究中Cd胁迫下,3种龙葵的根和叶的MDA含量都随着Cd浓度先增加后降低,但高浓度处理时的龙葵的MDA含量都依旧高于对照(JL的根部MDA含量在高浓度处理时低于对照).而唐秀梅等[22]利用采自金华北山的龙葵种子在水培试验下研究龙葵的耐性,发现在处理34 d时,Cd处理100 mg·L-1时MDA含量比对照增加了289.5%.曾秀存等[23]研究Cd胁迫对红果龙葵生理特性的影响,发现在25μmol·L-1和50μmol·L-1处理6 d时,丙二醛含量是对照的117.00%和154.50%.本研究中丙二醛含量在高浓度Cd处理时含量反而下降,可能是因为在中浓度Cd胁迫时龙葵的承受力已达到阈值,当Cd处理浓度继续升高时,植物的保护酶系统严重受损,且同时严重影响了龙葵对Cd胁迫的敏感性,出现反应迟缓.重金属胁迫下植物体内都会产生ROS[24].ROS积累得不到及时清除就会引发膜脂过氧化作用,从而造成MDA的大量生成,这也是本研究中龙葵体内MDA含量随着Cd处理浓度的增加而增加的原因.
2.4 Cd胁迫对龙葵超氧化物歧化酶(SOD)的影响
本研究中,3种龙葵根和叶的SOD活性变化趋势有所差异(如图3所示),大部分Cd处理浓度下,HZ的根和叶的SOD活性远大于JL和GD.在各Cd胁迫下,JL的根的SOD活性先增加后降低,在Cd处理浓度为50 mg·L-1时达到最大值,JL的叶的SOD活性随着Cd处理浓度的增加而增加,当Cd处理浓度≥15 mg·L-1时,叶的SOD活性显著高于CK(P<0.05);HZ、GD的根和叶的SOD活性都随Cd处理浓度的增加而先增加后降低,在Cd处理浓度为25 mg·L-1时根的SOD活性均达到最大值,随后活性显著下降(P<0.05),Cd处理浓度为15 mg·L-1时HZ叶的SOD活性达到最大值,Cd处理浓度为20 mg·L-1时,GD叶的SOD活性达到最大值,Cd处理浓度≥10 mg·L-1时,GD根的SOD活性显著高于CK(P<0.05).
植物细胞中的活性氧在正常情况下其产生和清除达到平衡,逆境条件下则更利于活性氧的产生,其增加的活性氧会诱导SOD、POD、CAT等保护酶活性的升高,也会直接破坏生物大分子,使酶活性丧失[25].本研究中在各Cd胁迫下,HZ和GD的根和叶的SOD活性都随Cd处理浓度的增加而先增加后降低,JL的根的SOD活性先增加后降低,但始终高于对照值,JL的叶的SOD活性随着Cd处理浓度的增加而增加.

(a)JL超氧化物歧化酶(SOD)活性
2.5 Cd胁迫对龙葵过氧化物酶(POD)的影响
JL的叶中的POD活性随着Cd处理浓度的增加先增加后降低,当Cd处理浓度为25 mg·L-1时,POD活性达到最大值,是对照值的17倍(如图4所示),当Cd处理浓度≥15 mg·L-1时,叶中的POD活性显著高于对照6~17倍(P<0.05); HZ的叶中的POD活性随着Cd处理浓度的增加而增加,当Cd处理浓度≥5 mg·L-1时,HZ的叶中的POD活性显著高于对照5.4~16倍(P<0.05);GD的叶中的POD活性随着Cd处理浓度的增加而增加,当Cd处理浓度≥20 mg·L-1时,GD的叶中的POD活性显著高于对照6.7~38倍(P<0.05).
3种龙葵的根中的POD活性都随着Cd处理浓度的增加先增加后降低,但活性大小有明显的差异,其中HZ的POD活性远大于其他两种龙葵(如图5所示).当Cd处理浓度为25 mg·L-1时,JL的根中的POD活性最大,是对照值的4倍,当Cd处理浓度在10~50 mg·L-1时,根中的POD活性显著高于对照1.4~4倍(P<0.05);当Cd处理浓度为15 mg·L-1时,HZ的根中的POD活性最大,是对照值的2.42倍,当Cd处理浓度在5~25 mg·L-1时,根中的POD活性显著高于对照1.83~2.42倍(P<0.05);当Cd处理浓度为20 mg·L-1时,GD的根中的POD活性最大,是对照值的3.09倍,当Cd处理浓度在10~50 mg·L-1时,根中的POD活性显著高于对照1.42~3.09倍(P<0.05).
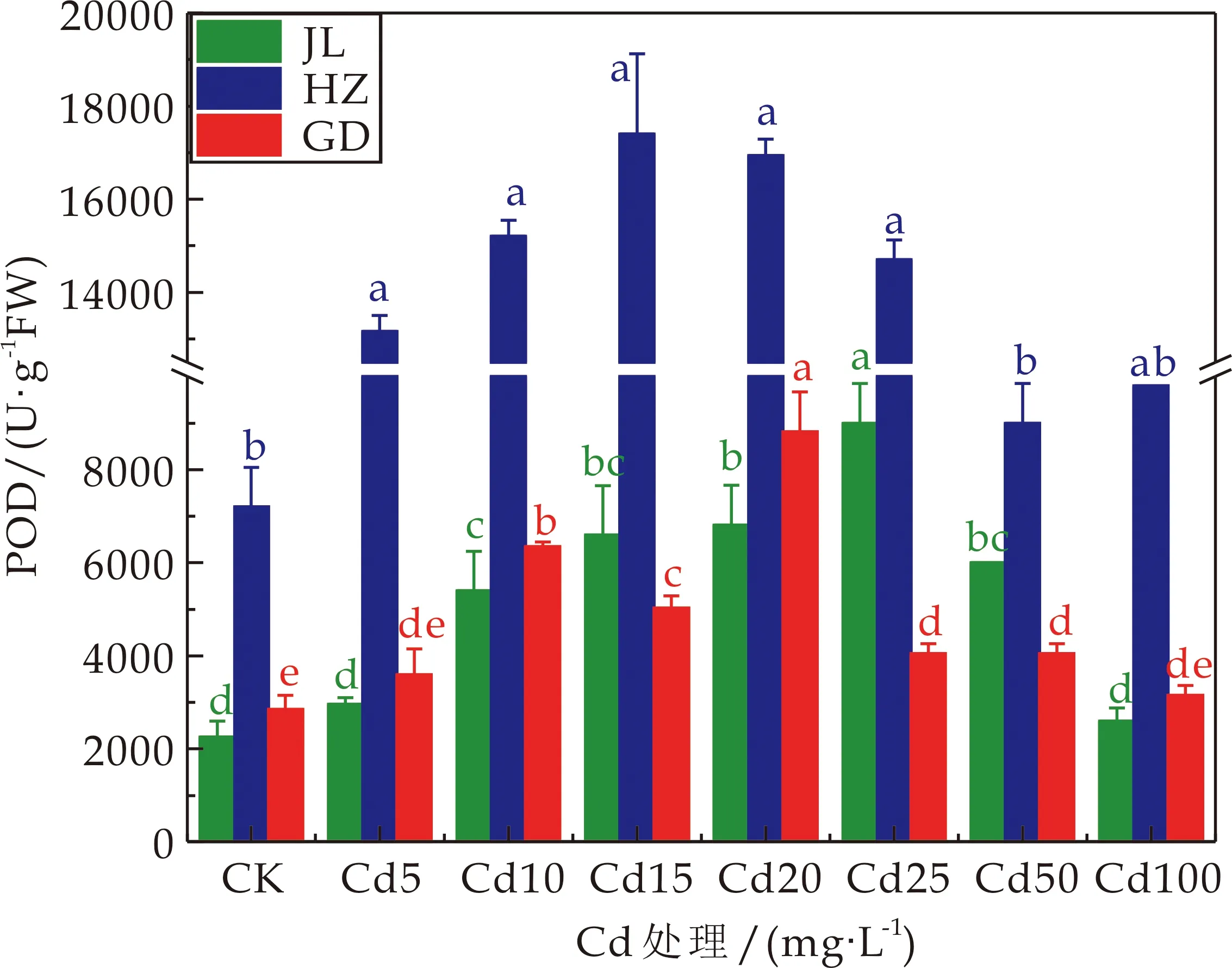
图5 不同Cd浓度处理下龙葵根系中POD活性
2.6 Cd胁迫对龙葵过氧化氢酶(CAT)的影响
3种龙葵根和叶的CAT活性基本呈现先增加后降低的趋势(如图6所示),3种龙葵的根中的CAT活性在Cd处理浓度为25 mg·L-1时均呈现最大值,当Cd处理浓度为15 mg·L-1时,JL叶中的CAT活性达到最大值,是对照值的13.45倍,当Cd处理浓度在10~50 mg·L-1时,叶中的CAT活性显著高于对照3.03~13.45倍(P<0.05);当Cd处理浓度为50 mg·L-1时,HZ的叶中的CAT活性最大,是对照值的6.32倍,当Cd处理浓度≥5 mg·L-1时,HZ的叶中的CAT活性显著高于对照2.25~6.32倍(P<0.05);当Cd处理浓度为20 mg·L-1时,GD的叶中的CAT活性最大,是对照值的3.64倍.

(a)JL过氧化氢酶(CAT)活性
超氧化物岐化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)作为抗氧化保护系统中的关键酶,在抑制植物体内ROS的产生及清除ROS发挥着关键的作用[26,27].SOD通过歧化反应将多余的活性氧自由基转化为H2O2,POD和CAT都可以分解H2O2,不同的是POD除了分解H2O2的作用,还会参与植物体内其他的生长代谢作用,而CAT则是生物抗氧化过程的终端,这三种抗氧化酶的互相配合则可以更好地清除植物体内产生的ROS,从而减轻对植物细胞的伤害.而三种酶在高浓度Cd处理时的活性反而下降,则也可能是植物在高污染状况下超负荷运转或者整体代谢系统达到临界点进而紊乱,也可能是过量的重金属抑制了这些酶的生物合成[28].唐秀梅等[22]研究龙葵抗氧化酶活性和抗坏血酸含量的变化表明3个酶的活性呈现随着Cd浓度升高而变化的规律,三者都表现出先升高后降低再升高的趋势.张玉秀等[29]通过研究镉对镉超积累植物龙葵的抗氧化酶活性及基因表达的影响发现Cd可增强或稳定多种抗氧化酶基因的转录水平或转录后水平的调节从而提高酶活性.可见,植物的抗氧化保护系统是一个多方调控的比较复杂的系统,在不同的植物中表现出不同的抗氧化规律,即使同一类型植物也随着植物生理的不同状态而表现出不同的抗氧化能力.
3 结论
(1)实验结果表明,Cd胁迫(>50 mg·L-1)能显著抑制三个品种龙葵的生长,Cd对龙葵HZ生长的抑制作用较其他两个品种要低,从生物量指标来看,HZ较耐镉.
(2)随着Cd胁迫浓度的增加,3种龙葵叶绿素含量、MDA含量、SOD活性、CAT活性以及根的POD活性均呈现先上升后下降趋势,且HZ的抗氧化酶活性大于其他两种龙葵.综合生物量指标、叶绿素含量、MDA含量和抗氧化酶活性指标整体来看,HZ有较强的Cd耐性.

