经导管动脉化疗栓塞术联合经皮穿刺瘤内注射碘油化疗药物乳剂治疗无法切除外生型肝癌的临床观察
林培超,李红兵,曾庆乐,郑泽海,黄得校,陈 勇
(1.汕头大学医学院第二附属医院医学影像中心,广东 汕头 515041;2.深圳市宝安区福永人民医院放射科,广东 深圳 518103;3.南方医科大学南方医院介入治疗科,广东 广州 510515)
外生型肝癌是临床上少见的肝癌类型,首次报道于1897年[1],是一种向肝外生长、低肝脏侵犯风险的肝癌[2]。由于其独特的生长方式和较低的血管侵犯风险,临床上以外科手术治疗为主[3-4]。然而,高达39.4%的外生型肝癌患者无法手术治疗[5]。近10年来,姑息治疗在无法切除外生型肝癌的治疗中发挥了重要作用,包括经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)、经导管动脉灌注(transcatheter arterial infusion,TAI)和口服索拉非尼等[6]。其中,TACE是无法外科治疗的中晚期肝癌最广泛使用的治疗方法之一[7-8]。然而单纯采用TACE的疗效是有限的。因此,TACE联合局部消融常被用于改善无法切除肝癌的治疗效果[9]。本研究25例无法切除外生型肝癌患者采用TACE联合经皮瘤内注射碘油化疗药物乳剂(chemotherapeutic agents lipiodol emulsion,CALE)治疗,取得较好的临床疗效,报道如下。
1 资料和方法
1.1 临床资料
选取2003—2014年南方医科大学南方医院和汕头大学医学院第二附属医院25例经影像学或病理学证实且无手术切除指征的外生型肝癌患者,均接受TACE联合经皮瘤内注射CALE治疗,有完整的随访记录。其中男性23例,女性2例,年龄19~70岁,平均(50.3±12.3)岁。本研究经汕头大学医学院第二附属医院伦理委员会审查批准,所有患者接受治疗前均签署知情同意书。
1.2 TACE流程
所有患者均先行TACE治疗,尽可能使碘油完全填充病灶。将由30~50 mg表柔比星,50~150 mg奥沙利铂,5~20 mg丝裂霉素,6~20 mL碘油以及适当剂量的造影剂(V造影剂∶V碘油=1∶1)混合制成的碘油化疗乳剂注射入肿瘤供血动脉,随后用颗粒栓塞剂栓塞供血动脉至血流停滞[7]。TACE术后1、3、6、12个月及以后每6个月复查CT或MRI,如果在检查过程中发现残留、复发或者肝内新发病变。则行第2次TACE。若TACE术中血管造影可见明确肿瘤供血动脉且能够超选择性插管进入供血动脉,则仍予动脉途径注射CALE治疗;若血管造影提示病灶血供复杂,无法通过动脉途径注射CALE[10],则行经皮穿刺瘤内注射CALE。
1.3 经皮穿刺瘤内注射CALE流程
经皮穿刺瘤内注射治疗的穿刺途径由术前CT或MRI确定。局部麻醉(2%利多卡因5 mL)后,在C型臂透视或CT引导下将21G酒精针插入靶区(即肿瘤内碘油缺损区),确认针尖位于靶区后注入CALE。每次CALE量控制在40 mL以内,以避免出现肝功能衰竭。CALE在同步透视下缓慢手动注射,直到引流静脉出现或间断CT扫描确定碘油在肿瘤靶区沉积情况。若CALE弥散欠佳,则将针向后缩1~2 cm或调整针的方向,确认针尖留在靶区后,继续注射乳剂至肿瘤病灶内布满碘油乳剂[10]。如靶区范围太大无法在1次治疗中完全填充,5~7 d后,在肝功能Child-Pugh分级为A级或B级的情况下,可再行经皮穿刺瘤内注射治疗。
1.4 术后处理
术后48 h内密切监测患者皮肤穿刺点是否有股动脉出血和血肿形成。术后5~7 d,观察患者是否出现药物不良反应和栓塞后综合征,若出现以上症状且情况较重,则予对症治疗。
1.5 统计学分析
应用SPSS 25.0软件进行统计分析。采用Kaplan-Meier法分析生存率并用Log-rank检验进行比较。采用Cox比例风险回归模型进行生存率影响因素分析,选择单因素分析有统计意义的变量进行多因素Cox回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
23例患者原发病灶最大直径>5 cm。TNM分期:Ⅱ期14例,Ⅲ期11例。肝功能Child-Pugh分级:A级21例,B级4例。治疗前所有患者均未出现远处转移。见表1。
2.2 治疗情况与疗效
25例患者均行TACE联合经皮穿刺瘤内注射CALE治疗(图1)。TACE治疗中位次数4(2~9)次,经皮瘤内注射治疗中位次数为2(1~3)次。本组病例1、2、3和5年生存率分别为78.9%、52.6%、42.1%和12.0%(图2)。中位生存期为27个月(95%CI:22.6~43.2)。

表1 外生型肝癌患者临床资料(n=25)
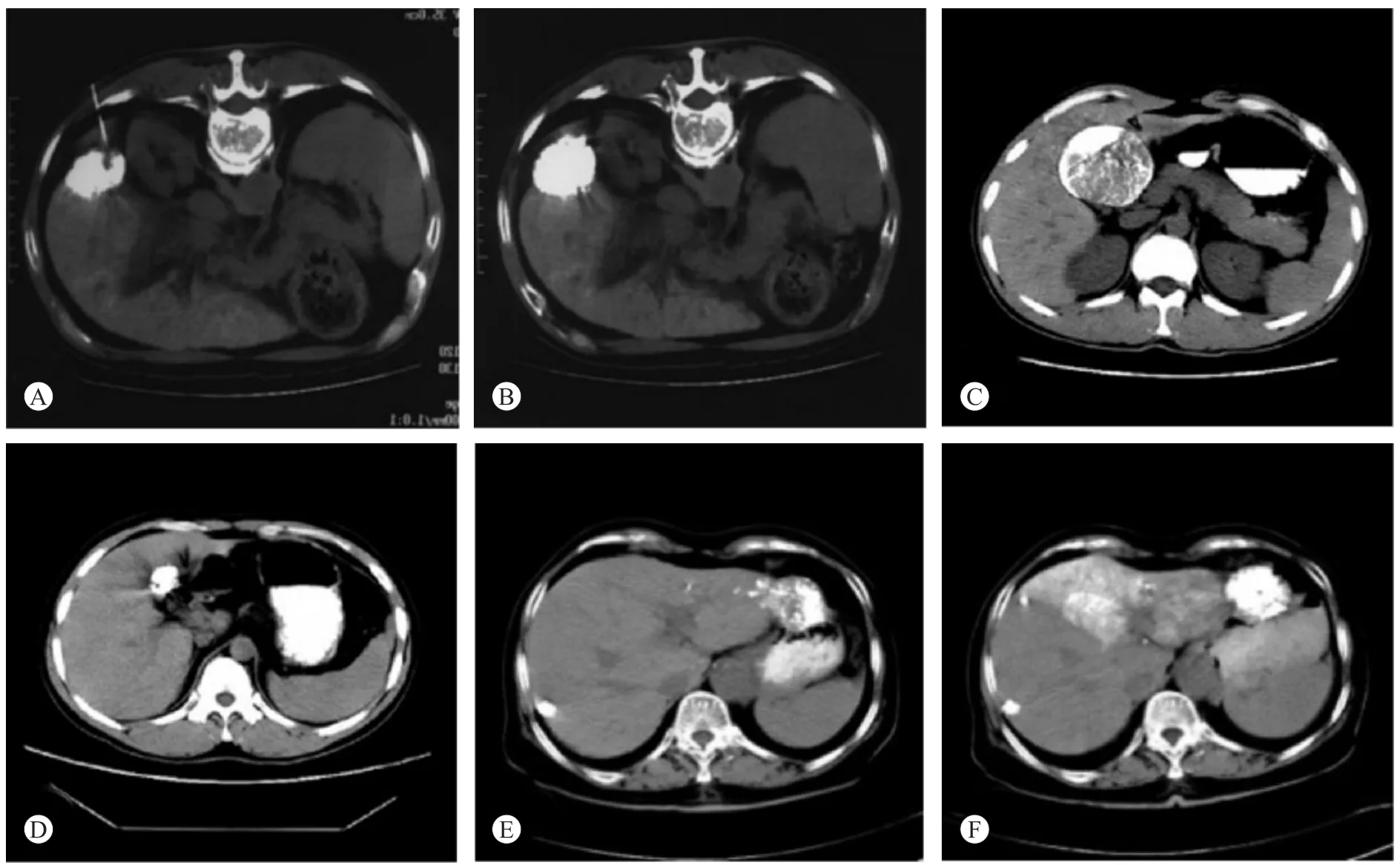
图1 无法切除外生型肝癌患者行TACE联合经皮穿刺瘤内注射CALE治疗
2.3 无法切除外生型肝癌患者生存率的影响因素分析
生存率单因素分析结果显示血管侵犯、局部淋巴结转移、肝内转移以及周围组织侵犯是导致无法切除外生型肝癌患者生存率较低的影响因素(均P<0.05,表2)。将单因素分析有统计学意义的4个因素纳入Cox回归模型进行多因素分析,结果显示血管侵犯和局部淋巴结转移是无法切除外生型肝癌患者总体生存率的不良预后因素,见表3。
2.4 术后不良反应、并发症及肿瘤进展处理
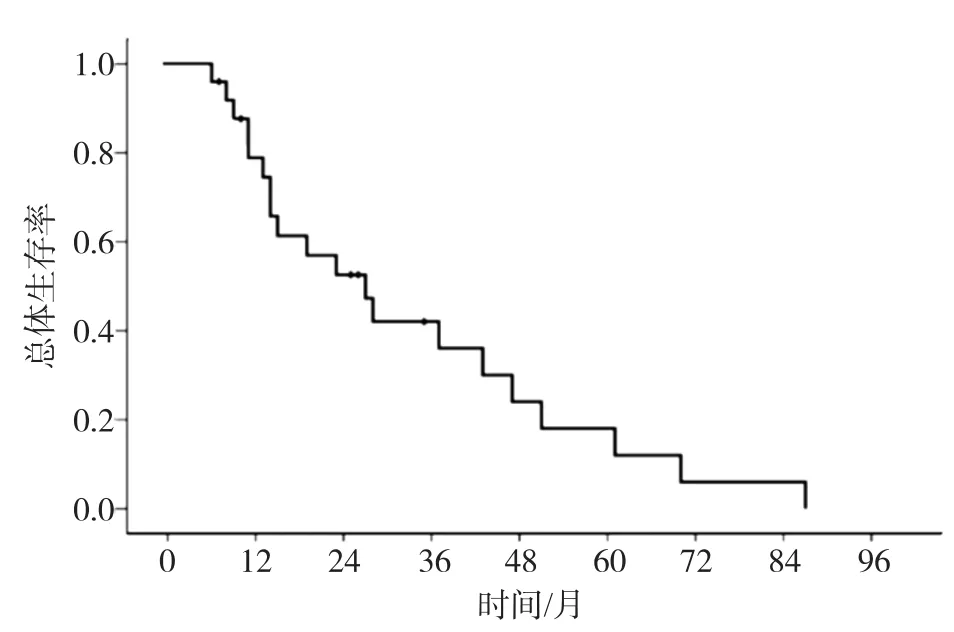
图2 25例外生型肝癌患者行TACE联合经皮穿刺瘤内注射CALE治疗总体生存率曲线

表2 无法切除外生型肝癌患者生存率的影响因素分析(n=25)
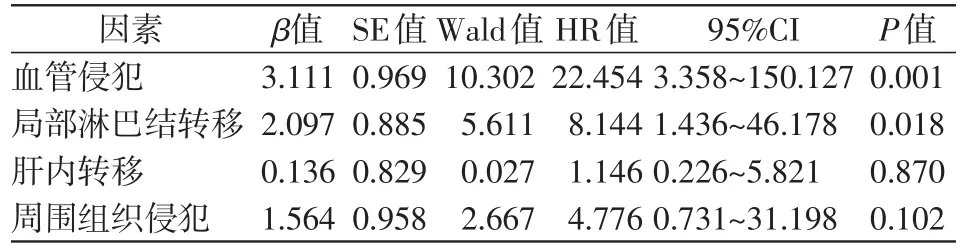
表3 无法切除外生型肝癌患者生存率影响因素的多因素Cox回归分析(n=25)
术后常见不良反应为发热、恶心呕吐、肝区疼痛等,均在对症治疗后缓解。25例患者经TACE联合经皮穿刺瘤内注射CALE治疗后均未出现感染、肝脓肿及肝功能衰竭等严重并发症。9例患者在治疗过程中有远处转移,主要是肺、肾上腺和骨转移。所有患者均及时接受相应治疗,如全身化疗、TAI、TACE、放射治疗等。
3 讨论
早期外生型肝癌通常无症状且肿瘤生长快速,一旦出现临床症状,常伴有肝内及邻近器官的转移[11]。因此大部分患者无法外科切除,只能接受姑息治疗。同时外生型肝癌有丰富的血液供应[12]。故此,TACE应作为无法切除外生型肝癌患者的主要治疗手段。然而,TACE在肿瘤控制方面有明显的局限性[13]。一方面,外生型肝癌的血供复杂,除了肝动脉供血之外,肝外血管也参与供血[12]。肝外血管的解剖特征使得超选择插管并栓塞每条供血动脉难以实现[13]。另一方面,肿瘤供血动脉可能同时供应邻近正常组织器官,这也限制了TACE的应用。这些局限性使得单用TACE治疗难以实现肝癌的完全灭活,需结合后续局部消融进一步治疗[9,13]。临床上,局部消融治疗是在影像学引导下进行经皮注射无水乙醇或热消融。无水乙醇注射可使小肿瘤完全坏死,但对大于5 cm的肿瘤并不适用,因为较大的肿瘤间质中的纤维结构分隔限制了无水乙醇的扩散[14]。热消融治疗难以对处于肝顶、外生或被大血管包围的肿块进行治疗[15],因此热消融通常不适用于外生型肝癌的治疗。
高浓度化疗药物的局部消融可能对肿瘤组织有潜在的细胞毒性。然而,直接注射化疗药物在过去并不实用,因为药物在注射后迅速散布到周围组织和体循环中[16]。在本研究中,经皮瘤内注射CALE用于TACE术后的补充治疗。既往报道肿瘤内碘油沉积部分被认为是坏死区域,这与CT上评估肿瘤坏死率有很好的相关性,TACE术后碘油沉积程度与患者的生存率有关[17-18]。因此,完全的碘油沉积被认为是一个相关的治疗目标。我们之前的研究发现,当TACE无法完全灭活肿瘤时,联合经皮穿刺瘤内注射CALE治疗骶骨脊索瘤是可行且有效的[10]。此外,CALE在肿瘤内的弥散范围能被X线检测出来,可用于图像引导。对无法进行热消融的处于肝顶及外生的肿块,经皮瘤内注射CALE是可行的。在本研究中,如果造影显示CALE无法通过动脉注射,且影像学证实肿瘤内CALE沉积不良,则采用经皮穿刺瘤内注射CALE。
尽管本组病例数较少,但研究结果表明,经皮穿刺瘤内注射CALE可以作为TACE术后的补充治疗,能提高无法切除外生型肝癌患者的生存期。本研究中25例无法切除外生型肝癌患者的1、2年生存率分别为78.9%和52.6%,与Horie等[3]报道的21例接受单纯TACE或TAI治疗的外生型肝癌患者的1、2年生存率分别为55.0%和19.0%相比明显提高。随访期间无严重并发症发生。因此,TACE联合经皮穿刺瘤内注射CALE治疗无法切除外生型肝癌比单纯TACE或TAI有更长的生存期,并且是安全的。

