2020 心肌梗死后心力衰竭防治专家共识
心力衰竭(心衰)是心血管疾病的严重和终末阶段,致残率和致死率高。随着人口老龄化的加重,心衰的患病率也在上升,正日益成为全球的重要公共卫生问题[1]。心肌梗死(心梗)是当前全球心衰最常见、最重要的病因之一。流行病学资料显示,中国心梗后心衰有着较高的发病率。虽然随着药物和非药物治疗手段的发展,心梗后心衰患者的结局得到一定改善,但其全因死亡率、心血管事件发生率和再住院率仍然较高[2-3],这与该类患者疾病的严重性有关,也与治疗手段是否及时、恰当以及心脏科医师的疾病预防和治疗观念有关。
近年来,中国分别发布了心梗和心衰的诊疗指南[4-6],但对于心梗后心衰的诊断与治疗尚缺乏统一的指导与规范。为使心梗后心衰的临床诊疗与防控策略更加合理、规范,进一步优化心梗后心衰的全程管理,中国医师协会心血管内科医师分会、中国心血管健康联盟组织相关专家,结合国内外有关循证医学证据,并参考最新指南[4-12],编写了本共识。
本共识包括心梗后心衰的定义及分类、流行病学及预后、发病机制、诊断与评估、针对不同发病机制和危险因素的预防措施、心梗后急性心衰与慢性心衰的治疗、患者管理七大板块。
推荐类别和研究证据分级
本共识对推荐类别和证据来源的表述沿用国际通用的方式:
(1)推荐类别
Ⅰ类:指已证实和(或)一致公认有益、有用和有效的操作或治疗。
Ⅱ类:指有用和(或)有效的证据尚有矛盾或存在不同观点的操作或治疗。
Ⅱa 类:有关证据或观点倾向于有用和(或)有效,应用这些操作或治疗是合理的。
Ⅱb 类:有关证据或观点尚不能被充分证明有用和(或)有效,可考虑应用。
Ⅲ类:指已证实和(或)一致公认无用和(或)无效、并对一些病例可能有害的操作或治疗,不推荐使用。
(2)证据分级
证据水平A:资料来源于多项随机临床试验或荟萃分析。
证据水平B:资料来源于单项随机临床试验或多项非随机对照研究。
证据水平C:仅为专家共识意见和(或)小型临床试验、回顾性研究或注册登记研究。
1 心肌梗死后心力衰竭的定义及分类
要点1:心梗后心衰的定义及分类
(1) 心梗后心衰为急性心梗[ 包括ST 段抬高型心梗(STEMI)和非ST 段抬高型心梗(NSTEMI)]后、在住院期间或出院后出现的心衰。
(2)心梗后心衰根据不同分类方法,可分为:早发心梗后心衰和晚发心梗后心衰;心梗后急性心衰和心梗后慢性心衰;射血分数降低的心衰(heart failure with reduced ejection fraction,HFrEF)、射血分数中间值的心衰(heart failure with mid-range ejection fraction,HFmrEF) 和射血分数保留的心衰(heart failure with preserved ejection fraction,HFpEF)。
1.1 心肌梗死后心力衰竭的定义
心衰是心脏结构和(或)功能异常导致静息或负荷时心输出量减少和(或)心腔内压力增高,从而引起组织器官灌注不足的一组临床综合征。心梗后心衰为急性心梗(包括STEMI 和NSTEMI)后、在住院期间或出院后出现的心衰。
1.2 心肌梗死后心力衰竭的分类
根据心衰发生的时间,可分为早发心梗后心衰(心梗入院时即存在或住院期间出现的心衰)和晚发心梗后心衰(出院后出现的心衰)。按照起病缓急,可分为心梗后急性心衰和心梗后慢性心衰。根据梗死的部位和范围的不同,急性心衰又可分为急性左心衰、急性右心衰、急性全心衰。多数心梗后急性心衰患者经住院治疗后症状可以缓解而转为慢性心衰;心梗后慢性心衰又可因各种诱因发生失代偿,出现急性加重而需住院治疗。心梗的类型、部位、面积大小以及治疗是否及时、有效都是心衰发生与否及严重程度的决定因素。
根据左心室射血分数(LVEF),心梗后心衰可分为HFrEF(LVEF < 40%)、HFmrEF(LVEF 40%~49%)以及HFpEF(LVEF ≥ 50%),见表1。

表1 心肌梗死后心力衰竭按照左心室射血分数的分类和诊断标准
2 心肌梗死后心力衰竭的流行病学及预后
要点2:心梗后心衰的流行病学及预后
(1)国内外数据均显示,心梗后心衰的发生率呈上升趋势,2001 年7 月至2004 年7 月中国CREATE 研究发现,STEMI 患者心梗后7 d 内心衰的发生率为19.3%。
(2)心梗后心衰的发生显著增加患者短期及长期不良事件风险。日本急性心梗登记研究发现,在接受经皮冠状动脉(冠脉)介入治疗(PCI)的STEMI 患者中,出院后第一年内发生心衰者的5 年累积全因死亡(36.3% vs.10.1%)、心衰住院(40.4% vs.4.3%)、心血管死亡(19.1% vs.3.3%)风险均高于第一年内未发生心衰的患者。
2.1 心肌梗死后心力衰竭的发病率及预后
欧美地区数据显示,心梗后30 d 至6.7 年内心衰的发生率为13.1%~37.5%[13-16]。弗雷明汉心脏研究显示,在1970~1979 年和1990~1999 年两个时间段,心梗后30 d 心衰的发生率由10.0%上升至23.1%,死亡率由12.2%下降至4.1%,心梗后5年心衰的发生率由27.6%上升至31.9%,死亡率由41.1%下降至17.3%[13],可见虽然心梗死亡率呈下降趋势,但心梗后心衰的发生率仍在上升。
心梗后心衰的发生显著增加患者短期及长期死亡风险。法国FAST-MI 注册研究发现,发生心衰的心梗患者院内死亡(12.2% vs.3.0%)和出院后1 年死亡(26.6 % vs.5.2%)的风险均明显高于未发生心衰的患者[16]。加拿大的一项注册研究也显示,发生心衰的NSTEMI 患者的院内死亡率(3.6% vs.1.1%)和出院后1 年死亡率(14.6% vs.4.4%)均高于未发生心衰的患者[17]。挪威一项于2001~2009 年纳入86 771例首次发病的急性心梗患者的研究(随访至2009 年底)显示,在男性心梗患者中,伴和不伴心衰者的死亡率分别为61.4%和28.3%;在女性患者中,上述两类患者的死亡率分别为70.0%和39.2%[18]。
中国心梗后心衰流行病学资料相对较少。2001~2004 年CREATE 研究发现,STEMI 患者心梗发作后7 d 内心衰的发生率为19.3%[19]。BRIGHT研究发现,接受急诊PCI 的急性心梗患者(88%为STEMI 患者)入院时心衰的发生率为14.3%[3]。China PEACE 十年研究数据表明,2001~2011 年,STEMI患者早发(院内)心梗后心衰(LVEF ≤40%)的发生率呈下降趋势(2001 年 vs.2006 年vs.2011 年:17.4%vs.17.9% vs.12.7%)[2]。
预后方面,日本急性心梗登记研究发现,在接受PCI 的STEMI 患者中,术后第一年再入院率为4.4%,出院后第一年内发生心衰者的5 年累积全因死亡(36.3% vs.10.1%)、心衰住院(40.4% vs.4.3%)、心血管死亡(19.1% vs.3.3%)风险均高于第一年内未发生心衰的患者[20]。
2.2 心肌梗死后心力衰竭发生的危险因素
心梗后心衰的发生与多种因素有关。一项基于心梗数据采集系统(MIDAS)的研究发现,高血压、糖尿病、肾脏病史以及肺病史是心梗后心衰的危险因素,而血运重建术包括PCI 和冠脉旁路移植术(CABG)的实施与心衰患者再入院率降低相关[21]。另有研究发现,0~1、2、3 支冠脉病变患者心梗后30 d 心衰的发生率分别为10.7%、14.6%和23.0%,心梗后5 年心衰的发生率分别为14.7%、20.6%和29.8%[14],说明心梗患者病变冠脉的数量越多,未来发生心衰的可能性越大。此外,前壁心梗、合并慢性完全闭塞病变以及瓣膜反流的患者也是心梗后心衰的高危人群。
3 心肌梗死后心力衰竭的发病机制
要点3:心梗后心衰的发病机制(图1)
(1)心肌细胞丢失是心梗后心脏重构和心衰发生的重要原因。
(2)心脏重构是心梗后心衰发生的基本病理过程。
(3)心梗后凋亡及坏死的心肌细胞引起免疫损伤,触发严重的炎症反应,加重组织功能受损;同时,心梗后心排出量的降低引起神经内分泌系统激活,如反射性激活交感神经系统、肾素-血管紧张素-醛固酮系统(RAAS)等;此外,心脏压力和(或)容量负荷增加,机械应力改变,也会直接导致一系列病理生理改变,加重心脏重构,最终导致心衰。
3.1 心肌细胞丢失
心肌细胞丢失是心梗后心脏重构和心衰发生的重要原因。心肌细胞丢失主要包括细胞坏死和细胞凋亡。冠脉急性闭塞后,心肌细胞暴露于急性缺血、缺氧环境而发生缺血性坏死,坏死细胞释放肌钙蛋白、肌酸激酶、乳酸脱氢酶等损伤因子,加重心肌细胞的损毁[22-23]。缺血区和非缺血区的心肌细胞也可在神经内分泌系统激活、氧化应激、钙超载、炎症反应等损伤因素作用下,激活凋亡信号通路,进而介导心肌细胞凋亡[24]。
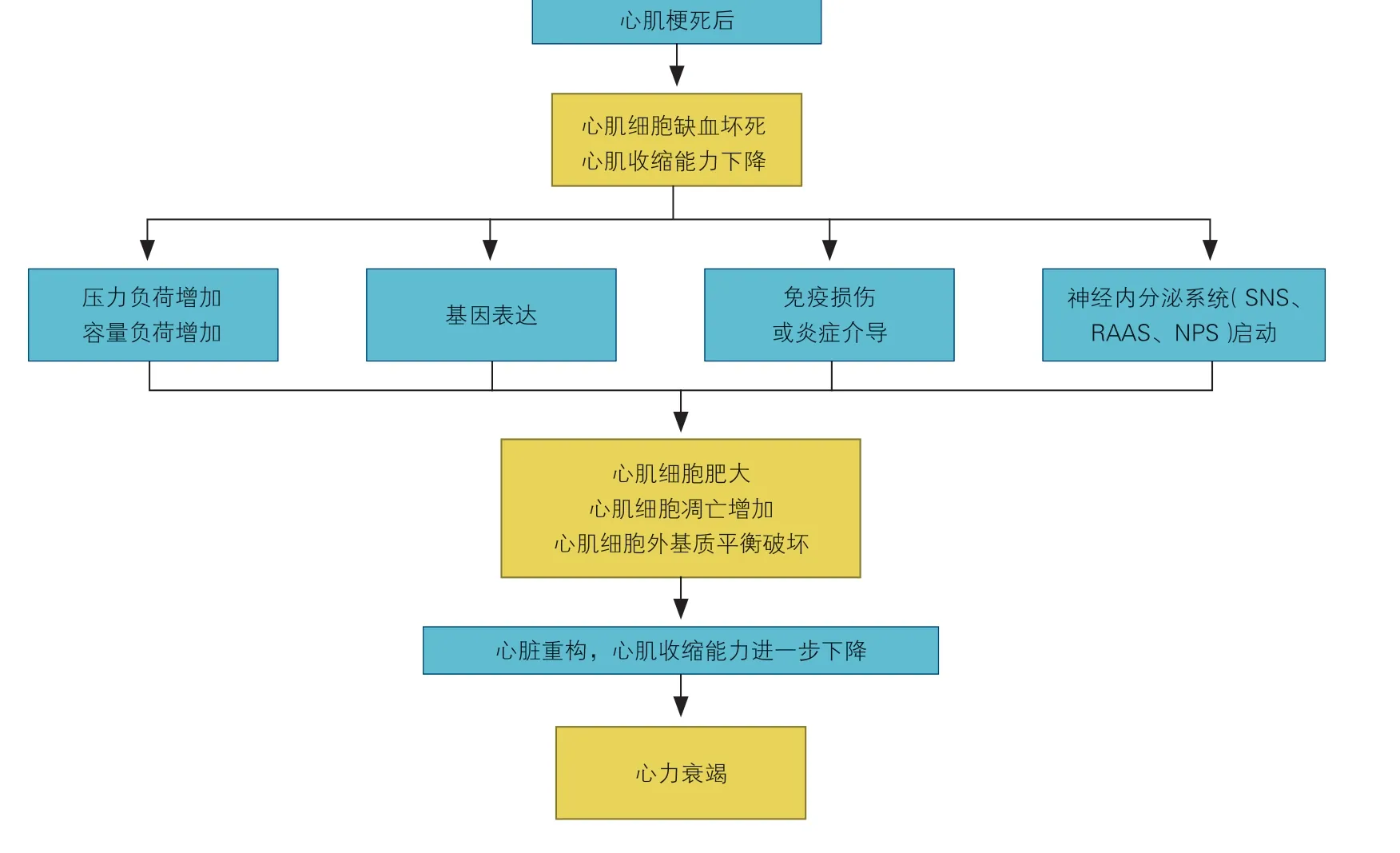
图1 心肌梗死后心力衰竭的发生机制
3.2 心脏重构
心脏重构是心梗后心衰发生的基本病理过程,指心肌细胞、非心肌细胞和细胞外基质(extracellular matrix,ECM)发生适应不良性改变,进而心室几何形态发生病理性改变,导致心脏僵硬度增加,收缩力下降[25]。心脏重构主要机制包括:(1)心肌细胞的肥大和丢失;(2)存活心肌细胞因容量负荷或压力负荷增加而发生拉伸或代偿性肥大,并伴随细胞的凋亡;(3)心肌细胞表型改变,心室肌球蛋白和肌钙蛋白基因表达的胚胎化改变造成心肌细胞收缩能力降低[26];(4)非心肌细胞的改变和ECM 的变化,大量ECM 的产生增加室壁僵硬程度,影响心脏的舒张功能和冠脉储备能力,导致心肌细胞缺血、缺氧[27]。
3.3 免疫损伤和炎症介导
心梗后凋亡及坏死的心肌细胞释放损伤相关分子模式蛋白(damage associated molecular patterns,DAMPS),激活先天免疫系统,触发严重的炎症反应。长期过度活跃的炎症反应可导致损伤范围的扩大,加重组织功能受损,最终导致心衰[28]。
3.4 神经内分泌系统激活
心梗后心排出量的降低反射性激活交感神经系统,去甲肾上腺素、肾上腺素等分泌增加,使心肌收缩力增强、心率增快、心肌耗氧增加[29]。长期高浓度的儿茶酚胺对心肌细胞的毒性作用(心肌细胞线粒体功能紊乱,活性氧产生增加、钙超载,引起细胞凋亡)会促进心脏重构[30]。
心梗后心排出量的降低也反射性激活RAAS,血管紧张素Ⅱ与血管紧张素Ⅱ 1 型(AT1)受体结合可引起醛固酮分泌增加、血管收缩、心肌细胞肥大和凋亡,进而导致水钠潴留和心肌纤维化,从而引发心衰症状、加重心脏重构[31-33]。
心排出量的下降还可导致利钠肽系统激活,利钠肽系统在心梗后心衰中发挥有利的代偿作用。利钠肽类物质与受体特异性结合后有扩张动、静脉及降低肺毛细血管楔压、全身动脉压、右心房压力的作用,进而降低心脏前、后负荷,改善心脏重构[34]。
4 心肌梗死后心力衰竭的诊断
要点4:心梗后心衰的诊断
(1)心梗后心衰的临床诊断,首先要明确心梗病史或明确影像学证据支持心梗的存在;其次,根据症状、体征、X 线胸片、利钠肽检测和超声心动图明确心衰的存在;超声心动图是评估心脏结构和功能的首选方法;另外,需排除其他原因导致的心衰(图2)。
(2)心梗后心衰的评估:急性心衰可根据Killip 心功能分级、Forrester 血流动力学分级进行评估,慢性心衰可根据NYHA 心功能分级方法进行评估。
4.1 心肌梗死后心力衰竭的临床诊断
心梗后心衰的诊断主要依赖于病史、症状、体征以及辅助检查。首先,患者要有明确的心梗病史或明确的影像学证据支持心梗的存在;其次,根据症状、体征、X 线胸片、利钠肽检测和超声心动图明确心衰的存在[35]。超声心动图是评估心脏结构和功能的首选方法,可提供房室容量、两个心室的收缩和舒张功能、室壁厚度、瓣膜功能和肺动脉高压等信息[36]。当超声心动图未能做出诊断时,心脏MRI(CMR)是较好的替代影像学检查方法[4]。
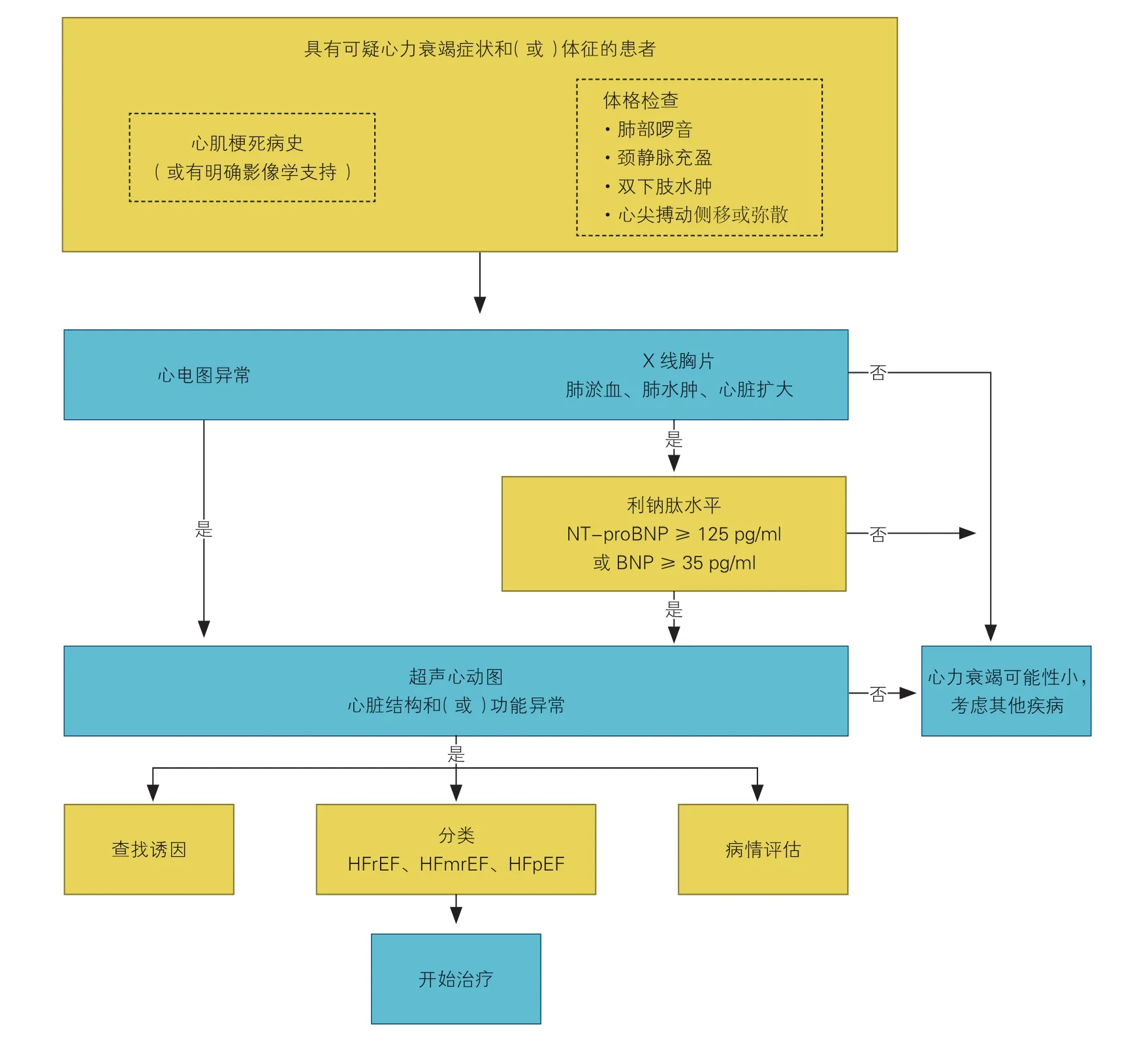
图2 心肌梗死后心力衰竭的诊断与评估流程
4.2 心肌梗死后心力衰竭的评估
推荐将B 型利钠肽(BNP)或 N 末端B 型利钠肽原(NT-proBNP)测定用于心梗后心衰的诊断以及病情严重程度和预后的评估 (Ⅰ,A)[4]。对于可疑急性心衰患者,若BNP<100 ng/L、NT-proBNP<300 ng/L,通常可以排除诊断。在诊断急性心衰时,应根据年龄和肾功能的不同,分层设置不同的NT-proBNP诊断界值:50 岁以下的患者NT-proBNP 水平>450 ng/L,50 岁以上的患者>900 ng/L,75 岁以上的患者>1 800 ng/L,肾功能不全(肾小球滤过率<60 ml/min)的患者>1 200 ng/L[37]。对于可疑慢性心衰患者,若BNP<35 ng/L、NT-proBNP<125 ng/L,通常可排除诊断。
急性心梗时心衰的严重程度可采用Killip 心功能分级进行评估[5](表2)。

表2 Killip 心功能分级
心衰的血流动力学改变主要表现为心输出量降低和肺循环或体循环淤血,其严重程度常与心衰的症状、体征相一致。对于心梗后急性心衰或慢性心衰急性发作,还可进行Forrester 血流动力学分级(表3)[38-39],根据有创血流动力学监测指标分类。
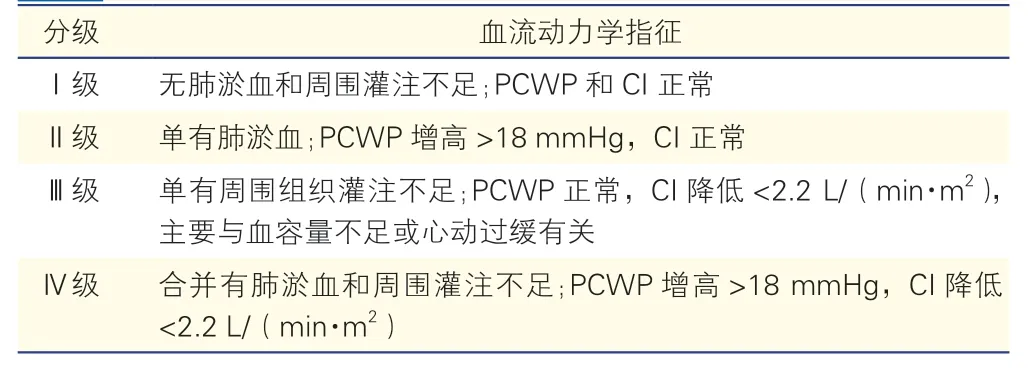
表3 Forrester 血流动力学分级
Killip 心功能分级或Forrester 血流动力学分级Ⅱ级及Ⅱ级以上均可被划分为心衰,其病情严重程度与病死率的增加相一致。
对于急性心衰,临床也可根据是否存在“淤血”(分为“湿”和“干”)和外周组织是否存在“低灌注”(分为“冷” 和“暖”)的临床表现,分为 “干暖”、“湿暖”、“湿冷” 和“干冷”4 型。
慢性心衰可采用NYHA 心功能分级方法评估,根据患者自觉活动能力划分为4 级(表4)[4]。
此外,也有中国学者提出应用CMR 检查对急性心梗后心脏功能进行评估和分级,并发现CMR评估结果与预后有关[40]。

表4 NYHA 心功能分级
5 心肌梗死后心力衰竭的预防
要点5:心梗后心衰的预防
(1)尽早实现心肌再灌注:及早开通梗死相关冠脉可挽救濒死心肌、缩小梗死心肌面积、减少心肌细胞的丢失,对于预防或延缓心衰的发生有重要作用,如早期药物或机械性再灌注治疗、球囊扩张治疗、主动脉内球囊反搏(IABP)等。
(2)预防心脏重构:阻断或延缓心脏重构是预防心梗后心衰的重要环节,所有心梗后患者均应长期服用β 受体阻滞剂和血管紧张素转换酶抑制剂(ACEI)治疗(Ⅰ,B);对不能耐受ACEI 的患者,可应用血管紧张素Ⅱ受体拮抗剂(ARB)类药物。
(3)心梗后心衰高危因素的防治:积极控制危险因素,如生活方式干预、戒烟,控制高血压、血脂代谢异常均可延缓心衰发作并延长生存期。
(4)心梗本身的规范化药物治疗:所有心梗患者都应接受抗栓治疗,并根据再灌注策略选择抗血小板治疗方案(Ⅰ,C),心梗后无禁忌证患者应常规使用β 受体阻滞剂(Ⅰ,B)、ACEI 或ARB(Ⅰ,A)、他汀类药物(Ⅰ,A)[4]。
5.1 尽早实现心肌再灌注
及早开通梗死相关冠脉可挽救濒死心肌、缩小梗死心肌面积、减少心肌细胞的丢失,对于预防或延缓心衰的发生有重要作用。2001~2010 年10 年期间[2],尽管中国直接PCI 的使用率由10.6%上升至28.1%(P<0.0001),但未接受再灌注治疗患者的比例并无显著变化(2001 年vs.2011 年:45.3% vs.44.8%,P=0.82),超过一半的STEMI 患者因救治延迟而错失再灌注最佳时机;而这10 年期间中国STEMI 患者院内死亡率也未显著降低。早期药物或机械性再灌注治疗对发病12 h 内、持续ST 段抬高或新发生左束支阻滞的STEMI 患者有明确的临床获益。有条件实施PCI 的医院应尽力在90 min 内完成球囊扩张治疗(Ⅰ,A)。若经救护车收治但120 min 内不能转运至PCI 中心完成再灌注治疗,最好在救护车上开始溶栓治疗(Ⅰ,A)。若患者就诊于无直接PCI 条件的医院,如能在首次医疗接触(first medical contact,FMC)后120 min 内转运至PCI 中心并完成再灌注治疗,则应将患者转运至可行PCI 的医院实施直接PCI(Ⅰ,B),且患者应在就诊后30 min 内转出;若FMC 至导丝通过梗死相关动脉时间>120 min,则应在FMC 后30 min 内开始溶栓(Ⅰ,A)[5]。若STEMI 患者因机械并发症导致血流动力学不稳定和(或)出现心原性休克,可使用IABP 作为辅助治疗手段(Ⅱa,C)[5]。
5.2 预防心脏重构
阻断或延缓心脏重构是预防心梗后心衰的重要环节。若无禁忌证,所有心梗后患者均应长期服用β 受体阻滞剂和ACEI 治疗(Ⅰ,B)[6];对不能耐受ACEI 的患者,可应用ARB 类药物。目前不推荐常规联合应用ACEI 和ARB[5]。对心梗后无症状性左心室收缩功能障碍[包括LVEF 降低和(或)局部室壁活动异常]的患者,推荐使用ACEI 和β 受体阻滞剂,以预防和延缓心衰发生,延长寿命[4]。近期研究发现,血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitor,ARNI)沙库巴曲缬沙坦能有效逆转心脏重构,且效果优于ACEI和ARB。动物实验发现,沙库巴曲缬沙坦能改善心肌纤维化水平、抑制促炎细胞因子基质金属蛋白酶-9 的活性以及醛固酮的生成,升高血中利钠肽水平,减轻肺充血,从而改善心梗后心脏重构的进展[41-43]。基于上述逆转心脏重构的证据,可以考虑心梗后的患者使用沙库巴曲缬沙坦来预防或延缓心脏重构。正在进行的PARADISE-MI 研究纳入急性心梗伴左心室收缩功能不全和(或)肺淤血、但无已知慢性心衰病史的患者,随机给予沙库巴曲缬沙坦或雷米普利治疗[44]。未来该研究能够明确沙库巴曲缬沙坦在心梗后心衰治疗中的作用。
5.3 心肌梗死后心力衰竭高危因素的防治
低LVEF 水平以及既往心梗、心房颤动、高血压、糖尿病、血脂代谢异常、脑卒中、慢性肾脏病、慢性阻塞性肺病、酗酒等病史均与心梗后急性心衰的发生风险增加相关[45-46]。积极控制危险因素,如生活方式干预、戒烟及控制血压、血脂、血糖等,均可延缓心衰发作并延长生存期。
6 心肌梗死后心力衰竭的治疗
对于心梗后急性心衰患者,需要改善和稳定血流动力学,缓解症状;对于心梗后慢性心衰患者,需规范药物治疗,延缓心脏重构,改善远期预后。
6.1 心肌梗死后急性心力衰竭的治疗
要点6A:心梗后急性心衰的治疗
(1)心梗后急性心衰的治疗目标是稳定血流动力学状态,纠正低氧,缓解症状,维护脏器灌注和功能。
(2)符合急诊血运重建指征的患者,应评估并行早期血运重建(Ⅰ,C)[5]。
(3)慢性心衰急性加重者应寻找与处理诱因。
6.1.1 治疗目标
心梗后急性心衰的治疗目标:稳定血流动力学状态,纠正低氧,缓解心衰症状,维护脏器灌注和功能,同时应重视改善患者的生活质量及短期和远期预后。
6.1.2 积极处理病因和诱因
心梗后急性心衰,符合急诊血运重建的指征(Ⅰ,C)[4-5],应评估并行早期血运重建;心梗后慢性心衰急性发作,应寻找导致心衰发作的诱因,并进行相应处理。
6.1.3 一般处理
包括体位选择(取半卧位或端坐位)、吸氧和镇静药物的使用。应根据患者呼吸困难严重程度选择不同的吸氧方式(具体内容见6.3 非药物治疗部分)。急性肺水肿患者可谨慎使用镇静药,若伴持续低血压、休克、意识障碍、缺氧、严重的慢性阻塞性肺病等情况,禁忌使用[4,10-11]。
6.1.4 药物治疗
要点6B:心梗后急性心衰的药物治疗
(1)利尿剂首选静脉用药,必要时可联合应用氢氯噻嗪或保钾利尿剂[4]。
(2)使用血管扩张药物需注意血压,收缩压<90 mmHg(1 mmHg=0.133 kPa)的患者不建议使用血管扩张剂[4,34]。
(3)对于急性心梗期的心衰患者,应谨慎使用正性肌力药物(Ⅱb,C)。左西孟旦能够改善心功能和血流动力学参数,但在生存预后方面的获益尚不明确[47]。
(4)血压急剧下降或出现低灌注表现时,可用血管收缩剂暂时提升血压,一旦症状缓解,立即减量乃至停用(Ⅱb,B)。
(5)慢性HFrEF 患者出现失代偿和心衰恶化,如无血流动力学不稳定或禁忌证,可继续原有的优化药物治疗方案。
利尿剂:首选静脉应用利尿剂如呋塞米、托拉塞米等,必要时可联合应用氢氯噻嗪或保钾利尿剂[4]。
血管扩张剂(Ⅱa,B):主要有硝酸酯类、硝普钠、重组BNP、乌拉地尔等。血管扩张剂使用前及使用过程中要注意患者血压,对于收缩压<90 mmHg 的患者,不建议使用此类药物[4,34]。
正性肌力药(Ⅱb,C):常用药物包括β 受体兴奋剂(多巴胺、多巴酚丁胺等)、洋地黄类制剂(西地兰、毛花甙C 等)、磷酸二酯酶抑制剂(米力农等)、钙增敏剂(左西孟旦)[4]。对于急性心梗期的心衰患者,应谨慎使用正性肌力药物。STEMI 患者PCI 后伴急性心衰时,使用左西孟旦能够改善心肌收缩,患者耐受良好且不增加心律失常风险[48];而对于急性心梗伴心原性休克的患者,荟萃分析显示,左西孟旦能够改善心功能和血流动力学参数,但在生存预后方面的获益尚不明确[47]。急性心梗24 h 内不建议使用洋地黄类药物[4]。
血管收缩剂(Ⅱb,B):在补充有效血容量基础上,血压急剧下降或出现低灌注表现时,可用血管收缩剂暂时提升血压,一旦症状缓解,立即减量乃至停用。血管收缩药物应用不当可能导致心律失常甚至加重心肌缺血。心原性休克时可首选去甲肾上腺素(Ⅱb,B)[4]。
改善预后的药物:在血流动力学稳定后应尽早启用,包括β 受体阻滞剂、ACEI 或ARB 或ARNI、醛固酮受体拮抗剂,根据病情适当调整用量[4]。对于有慢性心衰病史的患者,可以起始使用ARNI 代替ACEI 或ARB[4],血流动力学稳定后尽早使用。
6.1.5 心肌梗死后机械并发症的处理
游离壁破裂:游离壁破裂多见于心梗后24 h 内以及1 周左右,多表现为突发的意识丧失、休克、电机械分离和急性心脏压塞。疑诊游离壁破裂时应立即行床旁超声心动图检查进行确认。治疗需尽快外科手术,术前内科治疗的目标是稳定患者血流动力学状态,必要时可行机械循环支持[5]。
室间隔穿孔:室间隔穿孔最早可在心梗后24 h 内出现,表现为临床情况突然恶化,出现心衰或心原性休克。血管扩张剂联合IABP 有助于改善症状。血流动力学不稳定者宜及早手术(1 周内),在行室间隔修补术的同时行CABG,但早期手术病死率高;血流动力学稳定者宜在3~4 周后手术治疗[5]。
乳头肌或腱索断裂:此并发症多出现在心梗后2~7 d,往往导致急性二尖瓣反流,表现为突发的急性左心衰、肺水肿甚至心原性休克。可使用利尿剂、血管扩张剂等以及IABP 等降低左心室后负荷,必要时可使用正性肌力药物。此类患者宜尽早外科手术[5]。
6.2 心肌梗死后慢性心力衰竭的治疗
6.2.1 治疗目标
心梗后慢性心衰的治疗目标主要是改善临床症状和生活质量,减缓或逆转心脏重构,减少再住院,降低死亡率。
6.2.2 药物治疗
要点6C:心梗后慢性心衰的的药物治疗
(1)有液体潴留表现的患者应使用利尿剂(Ⅰ,C)[4]。
(2)除非存在禁忌,所有心梗后心衰患者均应接受β 受体阻滞剂、ACEI 或ARB 治疗(Ⅰ,A)[4]。
(3)对于NYHA 心功能Ⅱ~Ⅲ级、有症状的心梗后HFrEF 患者,若能够耐受ACEI 或ARB,可考虑以ARNI 替代ACEI 或ARB,以进一步改善预后(Ⅰ,B)[4]。
(4) 对 于NYHA 心 功 能 Ⅱ~Ⅳ 级、LVEF ≤35%、已使用ACEI(或ARB 或ARNI)及β 受体阻滞剂治疗、仍持续有症状的患者,可加用醛固酮受体拮抗剂(Ⅰ,A)[4]。
利尿剂:有液体潴留表现的患者应使用利尿剂(Ⅰ,C)[4],多使用口服利尿剂,包括袢利尿剂(如呋塞米、托拉塞米)、噻嗪类利尿剂(如氢氯噻嗪、吲达帕胺)和保钾利尿剂(阿米洛利、氨苯蝶啶)[11]。长期使用较大剂量利尿剂可能会导致RAAS 激活和电解质紊乱,因此推荐使用维持剂量,即以最小的剂量长期维持患者在“干重状态”。
β 受体阻滞剂:除非存在禁忌,所有心梗后心衰患者均应接受β 受体阻滞剂治疗(Ⅰ,A)[4]。对LVEF<40%的HFrEF 患者,β 受体阻滞剂一般应以小剂量起始,每2~4 周递增,直至达到目标剂量或最大耐受剂量[4,8,49]。目前,美托洛尔[50-51]、比索洛尔[52]和卡维地洛[52]是三种获得指南推荐的用于心衰治疗的药物,可降低心衰患者死亡率和(或)住院率。
ACEI:ACEI 是HFrEF 的基础治疗。对于ACEI 在心梗后心衰中的作用,AIRE 研究纳入了2 006 例急性心梗后心衰患者,平均随访15 个月的结果表明,服用雷米普利者的死亡率明显低于安慰剂对照组,相对危险度降低27%;次要终点的分析显示,服用雷米普利的患者中死亡、严重或顽固性心衰、心梗、脑卒中的复合终点发生风险降低了19%[53]。该研究奠定了ACEI 在心梗后心衰中的治疗地位。除非有禁忌证或不能耐受,所有心梗后HFrEF 患者均应使用ACEI(Ⅰ,A)[4]。ACEI 在心梗后心衰患者中的应用通常推荐从小剂量开始,在随访中逐渐增加剂量,直至达到目标剂量或最大耐受剂量。
ARB:对ACEI 治疗不能耐受的患者,可换用ARB(Ⅰ,A)[4]。常用药物包括缬沙坦[54]、氯沙坦[55]、坎地沙坦[56]等。OPTIMAAL 研究纳入了5 477 例急性心梗伴心衰或Q 波型急性前壁梗死或再梗死患者,平均随访(2.7±0.9)年,发现氯沙坦组和卡托普利组的主要终点(全因死亡率)和次要终点(猝死、致死性或非致死性再次心梗、全因住院率)均无显著差异,但氯沙坦比卡托普利有更好的耐受性,因药物不良反应终止治疗者较少[55]。VALIANT 研究显示,缬沙坦在降低心梗后心衰患者死亡率方面具有与卡托普利同样的疗效[57]。建议ARB 类药物从小剂量起始应用,逐步增至推荐剂量或可耐受的最大剂量。
ARNI:沙库巴曲缬沙坦是首个ARNI 类药物,通过抑制血管紧张素受体和脑啡肽酶起到阻滞AT1受体和增强利钠肽系统的作用[58-59]。PARADIGMHF 研究纳入了8 399 例心衰患者(NYHA 心功能Ⅱ~Ⅳ级、LVEF ≤35%),其中沙库巴曲缬沙坦组中43.4%的患者有心梗病史,依那普利组中43.1%的患者有心梗病史;平均随访27 个月发现,沙库巴曲缬沙坦较依那普利可进一步降低主要终点(心血管死亡或心衰住院的复合终点)发生风险(HR=0.80,95%CI:0.73~0.87,P<0.001)、预先定义的更广泛的复合终点(包括心梗、脑卒中和心脏复苏后猝死)发生风险(HR=0.83,95%CI:0.76~0.90,P<0.001)以及事后分析冠脉复合终点(包括心血管死亡、非致死性心梗、心绞痛住院或冠脉血管重建)发生风 险(HR=0.83,95%CI:0.75~0.92,P<0.001)[60]。TRANSITION 研究进一步表明,急性心衰患者在血流动力学相对稳定后早期启用沙库巴曲缬沙坦治疗有较好的可行性和安全性[61]。基于这些资料,沙库巴曲缬沙坦在心梗后心衰的治疗中应考虑优先和早期应用。对于NYHA 心功能Ⅱ~Ⅲ级、有症状的心梗后HFrEF 患者,若能够耐受ACEI 或ARB,可考虑以ARNI 替代ACEI 或ARB,以进一步改善预后(Ⅰ,B)[4]。根据患者耐受情况,沙库巴曲缬沙坦剂量应每2~4 周倍增一次,直至达到每次200 mg、2 次/d 的目标维持剂量。
醛固酮受体拮抗剂:长期应用ACEI 或ARB,存在醛固酮“逃逸现象”。因此,在ACEI 或ARB 基础上加用醛固酮受体拮抗剂,有助于进一步抑制醛固酮的有害作用,常用醛固酮拮抗剂有依普利酮[62]和螺内酯[63]。EPHESUS 研究比较依普利酮和安慰剂对心梗后心衰患者临床结局的影响,平均随访16 个月后发现,依普利酮组全因死亡率、心原性猝死率和因心衰住院率均显著低于对照组[62]。对于NYHA心功能Ⅱ~Ⅳ级、LVEF ≤35%、已使用ACEI(或ARB 或ARNI)和β 受体阻滞剂治疗、仍持续有症状的患者,可加用醛固酮受体拮抗剂(Ⅰ,A)[4]。
伊伐布雷定:SHIFT 研究显示,伊伐布雷定的使用能够改善HFrEF 患者左心室功能和生活质量,使心血管死亡和心衰恶化住院的相对风险降低18%[64];SHIFT 研究中国患者亚组分析显示,这一风险能够降低44%[65]。在NYHA 心功能Ⅱ~Ⅳ级、LVEF ≤35%的窦性心律患者中,对于已经使用ACEI(或ARB 或ARNI)、β 受体阻滞剂等药物规范治疗而心率仍≥70 次/min(Ⅱa,B),或心率≥70 次/min 且对β 受体阻滞剂禁忌或不能耐受者,推荐使用依伐布雷定(Ⅱa,C)[4]。
其他药物:作为一种新型降糖药,钠-葡萄糖共转运蛋白2(sodium-dependent glucose transporters 2,SGLT2)抑制剂被证实具有心血管保护作用。DAPA-HF 研究纳入4 744 例HFrEF 患者(其中糖尿病患者占45%,心梗患者占44%),随机给予达格列净(10 mg,1 次/d)或安慰剂治疗,主要终点为心血管死亡、因心衰住院和因心衰于急诊就诊的复合终点,研究结果显示,对于HFrEF 患者,应用达格列净可显著降低主要终点事件、全因死亡和心血管死亡风险[66-67]。维利西呱(vericiguat)是一种口服的可溶性鸟苷酸环化酶激活剂。VICTORIA 研究纳入5 050 例近期发生过失代偿事件的慢性HFrEF 患者,在标准治疗的基础上随机给予维利西呱(目标剂量10 mg,1 次/d)或安慰剂治疗;中位随访10.8 个月,维利西呱显著降低心血管死亡或首次因心衰住院的复合终点事件发生风险(降幅为10%),提示维利西呱可为HFrEF 患者带来获益[68]。CK-1827452 是一种可直接激活肌球蛋白的新型药物,同样具有改善心功能的潜能[69-70]。这些药物在心梗后心衰患者中使用的有效性与安全性尚需要进一步研究。其他药物如洋地黄类药物、血管扩张剂(硝酸酯、肼屈嗪)、改善能量代谢药物(如曲美他嗪、辅酶Q10、左卡尼汀、磷酸肌酸等)以及芪苈强心胶囊等可以改善慢性心衰患者的临床症状、心脏功能和生活质量[8],但对心梗后慢性心衰患者的长期和短期临床预后的影响尚无确切证据。
6.3 心肌梗死后心力衰竭的非药物治疗
要点6D:心梗后心衰的非药物治疗
(1)当急性心梗导致急性心衰伴血流动力学障碍、严重心肌缺血并发心原性休克,且不能由药物纠正时,可以给予IABP 治疗(Ⅰ,A)[4]。
(2)符合适应证的患者,推荐给予埋藏式心脏复律除颤器(ICD)或心脏再同步化治疗(CRT),也可考虑给予机械通气(包括无创呼吸机辅助通气、气管插管和人工机械通气)或血液净化治疗。
(3)经常规治疗病情无明显缓解者,可行短期体外膜肺氧合(ECMO)或心室辅助泵治疗[4,71]。
(4)血运重建策略需要心脏团队对患者的临床状况、冠脉解剖、预期的血运重建完整性、心肌存活能力、同时存在的瓣膜疾病和共病进行仔细评估后制定。
(5)经皮心室重建术是一项治疗左心室室壁瘤合并心衰患者的新技术,其临床应用价值有待进一步检验。
(6)心功能受到严重损害且其他治疗方法不适用的重度心衰患者,心脏移植可作为最后的选择。
6.3.1 机械通气
包括无创呼吸机辅助通气、气管插管和人工机械通气,适用于心跳、呼吸骤停进行心肺复苏的患者及合并Ⅰ型或Ⅱ型呼吸衰竭的患者。常规氧疗方法(鼻导管和面罩)效果不满意(呼吸频率>25次/min、血氧饱和度<90%)时,应尽早使用无创正压通气(non-invasive positive pressure ventilation,NIPPV)(Ⅱa,B)[4]。经积极治疗后病情仍继续恶化(存在意识障碍,呼吸节律异常,或呼吸频率<8次/min,自主呼吸微弱或消失,二氧化碳分压进行性升高)或不能耐受NIPPV 或存在NIPPV 治疗禁忌证者,应及时予以气管插管,行有创机械通气(Ⅰ,C)[4]。
6.3.2 血液净化治疗
单纯血液滤过适合发生急性肺水肿且对袢利尿剂和噻嗪类利尿剂抵抗或血钠水平<110 mmol/L 且有神经精神症状者;合并肾功能进行性减退、血肌酐水平>500 μmol/L 者,适合血液透析等净化治疗。
6.3.3 主动脉内球囊反搏
当急性心梗导致急性心衰伴血流动力学障碍、严重心肌缺血并发心原性休克,且不能由药物纠正时,可以给予IABP 治疗(Ⅰ,A)[4,72-73]。
6.3.4 心室机械辅助装置
经常规治疗病情无明显缓解者,可行短期ECMO、心室辅助泵治疗[4,71]。
6.3.5 心脏再同步化治疗
心梗后心衰患者,在规范治疗至少3 个月后若符合:窦性心律、QRS 时限≥150 ms、左束支阻滞、LVEF ≤35%、有心衰症状,推荐CRT(Ⅰ,A)[4]。
6.3.6 埋藏式心脏复律除颤器
对于缺血性心脏病患者,心梗后至少40 d 及血运重建后至少90 d,预期生存期>1 年,经指南指导的优化药物治疗3 个月以上后心功能仍为Ⅱ~Ⅲ级、LVEF ≤35%、状态良好的患者,推荐植入ICD,以预防猝死发作,降低死亡率(Ⅰ,A)[4,74]。
6.3.7 血运重建
与单纯的药物治疗相比,冠脉血运重建术在改善缺血性心衰患者的生存率方面更有优势[75]。然而,最佳的血运重建策略尚未确定。心脏团队应在仔细评估患者的临床状况、冠脉解剖、预期的血运重建完整性、心肌存活能力、同时存在的瓣膜疾病和共病后,确定选择CABG 还是PCI。
6.3.8 室壁瘤的治疗
合并室壁瘤的顽固性心衰患者可行室壁瘤切除术,切除矛盾运动的室壁,尽可能地恢复左心室形态[76]。经皮心室重建术是一项治疗左心室室壁瘤合并心衰患者的新技术,利用一种新型的左心室分隔装置(又称降落伞装置)来减少左心室舒张、收缩末期容积和收缩期室内分流,从而达到增加左心室射血量、改善心功能和临床症状的目的[77-78],但其临床应用价值有待进一步验证。
6.3.9 心脏移植
对于心功能受到严重损害且其他治疗方法不适用的重度心衰患者,心脏移植可作为最后的选择。
7 心肌梗死后心力衰竭患者的管理
要点7:心梗后心衰患者的管理
(1)出院后每2 周、病情稳定后每1~2 个月复诊一次,超声心动图每3 个月复查一次。
(2)患者应遵循医疗方案,保持良好心态,病情稳定后适当运动,可根据医疗条件和自身意愿选择相应的远程监控模式。
心梗后心衰患者的管理是一项复杂艰巨的任务,也涉及到日常生活的诸多方面。对慢性心衰高危人群进行规范化治疗及管理可延缓心衰的进展及心功能的恶化,提高生存率和生活质量。
7.1 随访频率和内容
推荐患者出院后每2 周、病情稳定后每1~2 个月复诊一次,测量血压、心率,临床评估心功能。必要时行血常规、肾功能、电解质、利钠肽、心电图以及超声心动图检查,超声心动图每3 个月复查一次。根据检查结果进行治疗方案调整,同时注意对合并症的管理。
7.2 多学科管理方案
患者应遵循医疗方案,遵守饮食和锻炼建议,根据医生建议规范使用药物,改变生活习惯,从而带来更多获益。
7.2.1 生活方式管理
合理膳食:坚持低钠饮食,建议轻度心衰患者每日摄入食盐2~3 g,中重度心衰患者每日摄入食盐<2 g,重度心衰患者每日最多饮水1.5~2.0 L。注意保持大便通畅;每日称体重及监测血压、心率;戒烟;注意休息,勿劳累,避免感染;同时,鼓励病情稳定的患者进行适当运动,以日常体力活动为主,运动以不出现心衰症状为宜;控制高血压、糖尿病等心血管疾病危险因素[79]。
7.2.2 健康教育
普及相关医学知识,包括心衰患者的饮食和锻炼、心衰症状的早期检测和处理、药物治疗等。教会心衰患者及其家属如何识别心衰症状及恶化征兆,提高患者自我管理的参与度,提高治疗依从性。
7.2.3 心理教育
有计划地指导患者进行心理疏导,避免在应对疾病的过程中出现各种社会心理行为问题。保持良好的精神状态有利于缓解病情、减少心衰急性发作。
7.2.4 运动康复
安静卧床是心衰加重时治疗的基本原则,但长期卧床会导致一系列并发症,患者心衰症状改善后应鼓励患者适当运动。运动康复适应证为NYHA 心功能Ⅰ~Ⅲ级的稳定性心衰。禁忌证包括:急性冠脉综合征早期、恶性心律失常、高度房室阻滞、急性心肌炎、感染性心内膜炎、急性心衰、未控制的高血压、严重主动脉瓣狭窄、梗阻性肥厚型心肌病、心腔内血栓等。
中国慢性心衰患者运动康复仍处于发展阶段,临床医师应通过教育帮助患者树立长期运动的信心,循序渐进地指导患者进行运动,详细记录运动计划和实际情况,逐渐培养患者定期进行运动训练的习惯。禁忌剧烈运动及饱餐后运动,如运动中出现任何不适(如胸痛、呼吸困难等症状),应立即停止运动,若经休息或服药后上述不适症状仍无明显缓解,应立即就诊。伴有糖尿病的心衰患者需格外重视血糖监测[37,80]。
7.2.5 远程监控
远程监控对心梗后心衰患者的院外管理越来越重要,包括居家远程监控、植入式血流动力学监测系统、移动健康技术和心衰患者日记等。远程监控便于医生及时了解患者的病情变化,并指导调整院外治疗方案[7]。目前证实,居家远程监控能明显改善患者的生活质量[81],但其远期临床获益仍有待大规模临床研究认证。患者可根据医疗条件和自身意愿选择相应的远程监控模式,参与疾病管理。
7.2.6 心力衰竭中心的作用
中国于2017 年开始了全国范围的心衰中心建设和认证项目,先后颁布了标准版和基层版中国心衰中心认证标准,旨在通过区域性心衰中心的建立,推进心衰规范化诊疗和管理。心梗后心衰患者的长期随访是心衰中心建设工作的重要部分,依托心衰中心,能够更好地对心梗后心衰患者进行院内和院外管理,最终达到提高生活质量、改善预后的目的。
8 小结
心衰是心梗后的常见并发症,心梗后心衰的发生显著增加患者死亡率和再入院率,并严重影响患者的生活质量,带来巨大的社会经济负担。目前,中国心梗后心衰疾病负担严重,只有不断加强临床医师对心梗后心衰的预防、诊断、治疗以及管理意识,才能在现有的诊疗手段基础上改善患者的临床结局。本文就心梗后心衰相关的临床关键问题进行了讨论和总结,并推荐了临床诊疗方案和管理模式,上述内容还需要在今后的临床实践中验证并加以优化。
共识专家组成员(以姓氏汉语拼音为序):安健(山西省心血管病医院),卜军(上海交通大学医学院附属仁济医院),陈纪言(广东省人民医院),陈良龙(福建医科大学附属协和医院),陈韵岱(中国人民解放军总医院),程翔(华中科技大学同济医学院附属协和医院),丛洪良(天津市胸科医院),崔晓通(复旦大学附属中山医院),董蔚(中国人民解放军总医院),董吁钢(中山大学附属第一医院),杜志民(中山大学附属第一医院),方唯一(上海市胸科医院),傅国胜(浙江大学医学院附属邵逸夫医院),高传玉(华中阜外医院),葛均波(复旦大学附属中山医院),郭宁(西安交通大学第一附属医院),郭晓纲(浙江大学医学院附属第一医院),何奔(上海市胸科医院),贺勇(四川大学华西医院),洪浪(江西省人民医院),侯玉清(南方医科大学南方医院),黄岚(陆军军医大学新桥医院),霍勇(北京大学第一医院),贾绍斌(宁夏医科大学总医院),蒋峻(浙江大学医学院附属第二医院),金玮(上海交通大学医学院附属瑞金医院),金泽宁(首都医科大学附属北京天坛医院),晋军(陆军军医大学新桥医院),黎励文(广东省人民医院),李保(山西医科大学第二医院),李春坚(江苏省人民医院),李建平(北京大学人民医院),李浪(广西医科大学附属第一医院),李为民(哈尔滨医科大学附属第一医院),李新立(江苏省人民医院),李妍(空军军医大学唐都医院),梁春(上海长征医院),刘惠亮(北京电力医院),刘强(深圳市中医院),刘世明(广州医科大学附属第二医院),刘学波(同济大学附属同济医院),柳景华(首都医科大学附属北京安贞医院),卢成志(天津市第一中心医院),罗建方(广东省人民医院),吕树铮(首都医科大学附属北京安贞医院),马根山(东南大学附属中大医院),马礼坤(安徽省立医院),马依彤(新疆医科大学第一附属医院),聂绍平(首都医科大学附属北京安贞医院),钱菊英(复旦大学附属中山医院),邱朝晖(上海交通大学医学院附属同仁医院),邱春光(郑州大学第一附属医院),曲新凯(复旦大学附属华东医院),沈成兴(上海市第六人民医院),苏国海(山东大学附属济南市中心医院),苏晞(武汉亚洲心脏病医院),唐熠达(北京大学第三医院),陶剑虹(四川省人民医院),陶凌(空军军医大学西京医院),王华(北京医院),王建安(浙江大学医学院附属第二医院),王景峰(中山大学孙逸仙纪念医院),王乐丰(首都医科大学附属北京朝阳医院),王丽霞(河南省人民医院),王连生(江苏省人民医院),王振兴(江苏省中医院),吴强(贵州省人民医院),吴永健(中国医学科学院阜外医院),向定成(中国人民解放军南部战区总医院),徐标(南京大学医学院附属鼓楼医院),徐亚伟(上海市第十人民医院),杨杰孚(北京医院),杨清(天津医科大学总医院),姚朱华(天津市人民医院),于波(哈尔滨医科大学附属第二医院),余再新(中南大学湘雅医院),袁祖贻(西安交通大学第一附属医院),苑海涛(山东省立医院),殷伟贤(中国台湾振兴医院),曾春雨(陆军特色医学中心),曾和松(华中科技大学同济医学院附属同济医院),张宏(云南省第一人民医院),张金盈(郑州大学第一附属医院),张俊杰(南京市第一医院),张瑞岩(上海交通大学医学院附属瑞金医院),张钲(兰州大学第一附属医院),张志辉(陆军军医大学西南医院),郑金刚(中日友好医院),周京敏(复旦大学附属中山医院),周胜华(中南大学湘雅二医院),周玉杰(首都医科大学附属北京安贞医院),祝烨(四川大学华西医院),Sato Naoki(日 本Kawaguchi Cardiovascular and Respiratory Hospital),Yoshihiko Saito(日本Nara Medical University Hospital)
学术秘书:周京敏(复旦大学附属中山医院),崔晓通(复旦大学附属中山医院)
利益冲突:所有作者均声明不存在利益冲突

