放射治疗相关肿瘤血管生成的研究进展
黄 皓 ,周光明,2,胡文涛,2*
(1. 苏州大学放射医学与防护学院,苏州 215123;2. 放射医学与辐射防护国家重点实验室,苏州 215123)
近年来,放射治疗技术发展迅速[1-2],调强放射治疗(intensity-modulated radiation therapy, IMRT)、容积调强弧形治疗(volumetric-modulated arc therapy, VMAT)、图像引导放射治疗(image-guided radiation therapy,IGRT)等放射线剂量输送方式的革新和质子、重离子等高传能线密度(linear energy transfer, LET)射线的应用大大提高了肿瘤放射治疗的水平。然而,放疗后肿瘤的转移和复发仍然是局部晚期肿瘤患者死亡的主要原因。研究表明,肿瘤转移的一个重要因素就是放疗导致的肿瘤血管生成[3]。在辐射的刺激作用下,肿瘤细胞会分泌多种细胞因子,如血管内皮生长因子(vascular endothelial growth factor, VEGF)、转化生长因子 -β(transforming growth factor-β, TGF-β)等,其中VEGF是一种强效的促血管生成因子,能够诱导肿瘤组织内部的血管增生,这些新生血管将氧气和营养物质输送给肿瘤组织,促进其增殖的同时也促进了其转移和复发。可见,肿瘤血管生成是放疗后肿瘤复发和转移的关键。
1 放射治疗引起的肿瘤转移与血管生成密切相关
已经有许多临床研究表明,辐射能够刺激肿瘤内部血管增生,导致肿瘤细胞恶性化程度增高,进而促进肿瘤的转移和复发。Pueyo等[4]分多次辐照人皮肤癌A431细胞系,将存活的癌细胞经皮下注射进入裸鼠体内,通过分析肿瘤生长、细胞增殖指数Ki-67、微血管密度(microvessel density, MVD)、表皮生长因子受体(epidermal growth factor receptor, EGFR)和转化生长因子 -α(transforming growth factor-α, TGF-α)的转录水平以及血管内皮生长因子(vascular endothelial growth factor, VEGF)的分泌水平发现,与未经处理的细胞相比,受照细胞形成的肿瘤具有更快的生长速度、更高的Ki-67指数和更加丰富的血管生成,故推测这种侵袭性表型与辐射诱导的细胞外信号相关激酶 ERK-1/2(extracellular regulated protein kinase-1/2,ERK-1/2)和蛋白激酶 B(protein kinase B, PKB 或 Akt)的激活、EGFR和TGF-α转录水平的增高以及VEGF分泌的增加有关。Jung等[5]发现,在电离辐射的作用下,肿瘤细胞的应力纤维和黏着斑增加,而细胞间连接减少,故推测放疗后癌细胞的转移可能涉及细胞间黏附的丧失。此外,辐射上调了细胞内p38丝裂原激活的蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)磷酸化水平,诱导发生了一系列与上皮间充质转化(epithelial-mesenchymal transition, EMT)相关的变化,显著增强了细胞的运动性。由此说明,放射治疗引起的EMT相关的细胞迁移在放疗导致的晚期肿瘤进展中起着重要作用[6]。Koukourakis等[7]对24 例头颈部鳞状细胞癌(squamous cell head and neck cancer, SCHNC)患者进行了常规分割放疗(总剂量为20 Gy),并在放疗前后进行了原发灶活检,应用免疫组织化学的方法评估MVD[8]和胸苷磷酸化酶(thymidine phosphorylase, TP)的表达,结果发现,放疗后存活癌组织区域的MVD显著高于放疗前,具有核TP表达的癌细胞也显著增加,表明放疗期间丰富的血管生成对SCHNC放疗产生了不良影响。在另一项研究中,Koukourakis等[9]对25例接受术前放化疗的Ⅱ/Ⅲ期结直肠癌患者进行了检查,评估了其增殖指数Ki-67、血管密度(vascular density, VD)和乏氧诱导因子-1 α(hypoxia-inducible factor-1α, HIF-1α)的表达水平,结果发现,放疗前的高VD值与较差的无局部复发生存率(local relapse free survival, LRFS)有相关性,而增殖指数Ki-67和HIF-1α与LRFS无相关性。放疗后患者的增殖指数Ki-67增高,VD值也超过治疗前的水平,表示血管新生导致了较低的LRFS,这与结直肠癌患者放疗的失败密切相关。Marques等[10]研究发现,放疗过程中受到低剂量照射的直肠癌患者的癌旁组织中的促肿瘤血管生成基因显著上调,MVD显著升高,说明放疗诱导的肿瘤血管生成不容忽视。Zhu等[11]的研究也发现,放疗能诱导肺癌患者肿瘤组织内的HIF-1α/VEGF通路上调,而抑制该通路可以降低放疗诱导的肿瘤血管生成,表明放疗诱导的肺癌血管生成涉及HIF-1α/VEGF通路的激活。
综合上述研究结果可知,放射治疗之后,残余的肿瘤细胞具有更高的恶性程度、更强的运动性以及更丰富的血管生成,这些特征将导致肿瘤的复发和转移,最终造成放射治疗的失败。
2 放射治疗相关肿瘤血管生成的分子机制
电离辐射可以诱导多种细胞膜酪氨酸激酶受体的活化,包括红细胞白血病病毒癌基因同源物(erythroblastic leukemia viral oncogene homolog, ErbB)家族成员和胰岛素样生长因子 -1(insulin-like growth factor-1,IGF-1)等。生长因子受体(如EGFR)和IGF-1发出的信号可以通过多个下游信号分子传递,例如通过原癌基因Ras、磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、c-Jun N 末端激酶(c-Jun N-terminal kinase, JNK)、p38MAPK、Fas受体(Fas receptor,Fas-R)和肿瘤坏死因子受体(tumor necrosis factor receptor, TNF-R)等向半胱天冬蛋白酶原和活化B细胞的核因子-kappa轻链增强子(nuclear factor kappa-lightchain-enhancer of activated B cells, NF-κB)进行信号传导[12]。这些由辐射诱导的下游分子有一部分可直接靶向VEGF[13],还有一部分可以通过促进HIF-1α蛋白表达或激活HIF-1α的转录间接促进VEGF的表达,最终调控血管生成(图1)。
受辐射调控的血管生成信号通路包括环氧合酶-2(cyclooxygenase-2, COX-2)、一氧化氮合成酶(nitric oxide synthase,NOS)、EGFR、IGF-1等。这些通路能够提供诱导血管生成的共刺激信号:1)辐射激活COX-2[14-15],进而诱导产生前列腺素H2(prostaglandin H2, PGH2)。PGH2可作用于血栓素 A2(thromboxane A2, TXA2)直接调控血管生成,也可以通过前列腺素E2(prostaglandin E2, PGE2)增加 HIF-1α和 VEGF 的表达水平[16]。此外,有研究数据表明,PGE2还能够与前列腺素E2受体2亚型(prostaglandin E2 receptor subtype 2, EP2)结合,并激活环状腺苷单磷酸(adenosine monophosphate, AMP)和 VEGF 的产生[17];2)NOS的激活是电离辐射介导的早期信号事件[18-19],而NO可以通过 PI3K/Akt/FRAP[20]或者 PI3K/Akt/mTOR[21]途径诱导HIF-1α的表达[22];3)辐射激活的EGFR通路较为复杂,它可通过多条受体介导的HIF-1α调节通路,刺激血管生成[23],包括Ras/MEK/MAPK、Ras/MEK/ERK/MNK、PI3K/Akt/FRAP、PI3K/Akt/mTOR等激酶级联信号通路[24],并最终通过VEGF促进血管生成;4)辐射激活的IGF-1通路[22]也有多条途径,包括PI3K/Akt/FRAP、PI3K/Akt/mTOR、MEK/ERK/MNK、IGF-1/MEK/MAPK等激酶级联信号通路,最终通过HIF-1 α和VEGF发挥促血管生成的作用(图1)。
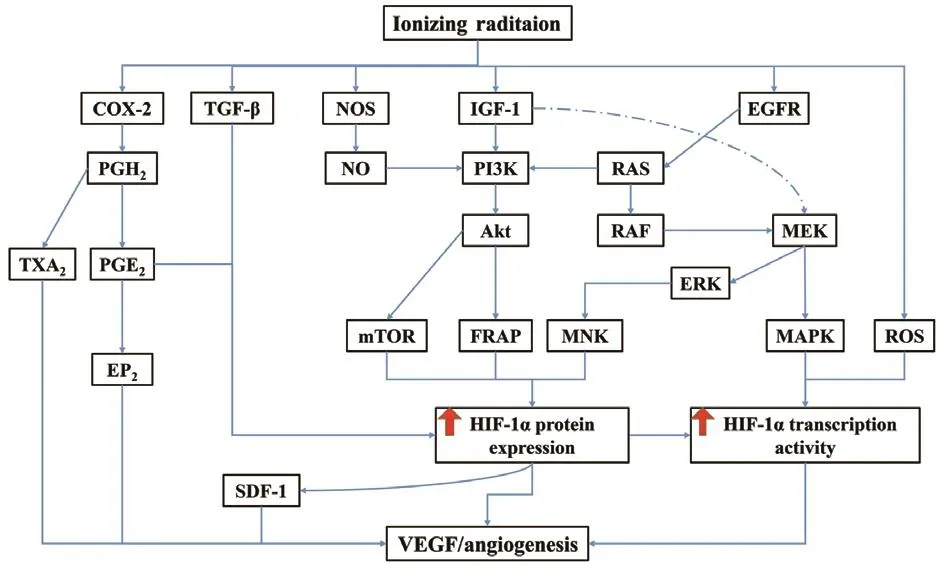
图1 辐射诱导血管生成的可能机制[25]Fig. 1 Potential mechanisms of radiation-induced angiogenesis[25]RAF:迅速加速的纤维肉瘤激酶;FRAP:FK506结合蛋白-12/雷帕霉素相关蛋白激酶;mTOR:哺乳动物雷帕霉素靶蛋白;MEK:丝裂原活化蛋白激酶激酶;MNK:MAP激酶相互作用的丝氨酸/苏氨酸激酶。RAF: Rapidly accelerated fibrosarcoma kinase; FRAP: FK506-binding protein-12/rapamycin-associated protein kinase; mTOR: Mammalian target of rapamycin; MEK: Mitogen-activated protein kinase kinase;MNK: MAP kinase interacting serine/threonine kinase.
有研究表明,辐射可以通过基质细胞衍生因子 -1(stromal cell-derived factor-1, SDF-1)[26]和活性氧(reactive oxygen species, ROS)[27]来激活血管生成,前者受到HIF-1α蛋白的间接调控,而后者则要通过激活HIF-1α的转录来对血管生成产生影响。然而,这些研究并未探究其中具体的分子机制,具体的分子机制还有待于后续的研究。最近有学者提出,细胞外囊泡(extracellular vesicles, EVs)在辐射诱导的肿瘤血管生成中也发挥了重要作用。受辐照肿瘤细胞来源的EVs介导的miR-23a[28]或血管生成素样蛋白 4(angiopoietin-like 4, ANGPTL4)[29]等分子能通过增强肺癌组织中人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)的增殖和迁移促进肿瘤组织的血管生成。
除了以上几条信号通路以外,辐射还可对肿瘤血管系统本身产生影响。一方面,随着肿瘤的快速生长,血液灌注不足使得肿瘤微环境变得缺氧[30],在乏氧的条件下,低剂量照射可激活血管内皮细胞的血管内皮生长因子受体 2(vascular endothelial growth factor receptor 2, VEGFR2),并增强 VEGF 的表达[31-32]。另一方面,辐射还会导致血管内皮细胞的损伤,尤其是那些处于增殖期的血管,这会使得原本因为肿瘤细胞过度增殖形成的乏氧微环境的乏氧程度加重,进一步刺激肿瘤细胞中乏氧诱导因子HIF-1α的表达,从而通过靶向血管内皮生长因子VEGF来刺激血管生成。此外,辐射还可通过TGF-β对血管生成产生间接影响。辐射能够诱导肿瘤细胞中TGF-β表达上调,而TGF-β能够通过激活HIF-1α进而诱导VEGF的表达[33]。TGF-β还能促进肿瘤微环境(tumor microenvironment, TME)的重塑、EMT等,它是促进实体瘤转移的关键因素之一[34-35]。总之,在辐照后的肿瘤微环境里,TGF-β的表达增强是出现继发恶性肿瘤(secondary malignant neoplasm, SMN)的主要原因之一。
综上可知,辐射通过多条分子通路刺激肿瘤组织内的血管生成,其中多数分子通路涉及HIF-1 α/VEGF的激活。在某些肿瘤中,细胞外囊泡在辐射诱导的肿瘤血管生成中也发挥了重要作用。
3 放射治疗和血管生成抑制剂联合治疗方案用于肿瘤治疗的临床研究进展
肿瘤组织的生长依赖于强力扩张的脉管系统,尤其离不开输送营养物质和氧气的血管[36]。而任何实体肿瘤在生长到一定阶段后,都会出现由于瘤体内部区域血管分布不足、血液灌注不佳所导致的乏氧区域,这样的区域被称为乏氧微环境。乏氧条件通过抑制辐射引起的DNA损伤的“固定”而形成辐射抗性。而抗血管生成剂可特异性靶向并抑制新生血管的生长,调节癌症的血流和氧合作用,使得处于乏氧状态的肿瘤组织能够再度氧合,从而导致肿瘤组织的放射敏感性增加[37-39]。目前,多种天然或合成的血管生成抑制剂已被发现或开发,这些药物通常分为4类:1)天然存在的血管生成抑制剂(如血管内皮抑素);2)抗促血管生成受体的抗体(如Avastin);3)促血管生成配体的清除剂(如DC101);4)针对促血管生成受体的酪氨酸激酶活性的抑制剂(如SU6668)[40]。
在临床治疗方面,自从2004年美国食品药品监督管理局(Food and Drug Administration, FDA)批准首个用于治疗转移性结直肠癌的血管生成抑制剂(贝伐单抗)以来,血管生成已成为癌症治疗的热点靶标。在随后的几年中,许多血管生成抑制剂陆续被开发,其中包括从单克隆抗体、内源性肽、有机小分子到microRNA等多种产品[41]。
目前,这些血管生成抑制剂已被用于靶向治疗各种癌症。然而,由于耐药性的出现,研究人员不得不开发新的血管抑制剂,并进行相应的临床试验。Chao等[42]开发出了一类新型的甾族化合物SR16388,旨在阻断癌组织中的血管生成。这种先导化合物在纳摩尔范围内对雌激素受体-α(estrogen receptor alpha, ER-α)和雌激素受体 -β(estrogen receptor beta,ER-β)具有结合亲和力。其体外试验结果发现,它能够抑制人微血管内皮细胞(human microvascular endothelial cells, HMVEC)和各种类型的人类癌细胞的增殖。3 mg/L的SR16388能使鸡胚绒毛尿囊膜(chorioallantoic membrane, CAM)中的血管密度大大降低 ;2 μmol/L的SR16388可阻止HMVEC在Matrigel中形成血管样结构;0.5 μmol/L的SR16388对HMVEC细胞的迁移抑制率为80%。此外,SR16388还下调了非小细胞肺癌(non-small cell lung cancer, NSCLC)中促血管生成转录因子、HIF-1α以及信号转导和转录激活因子 3(signal transducer and activator of transcription 3, STAT3)的表达。这些结果表明,SR16388可有效降低体内血管化程度并抑制肿瘤生长。Matsumoto等[43]对抗血管生成剂舒尼替尼的治疗效果进行了研究,结果发现:使用舒尼替尼这种多靶点酪氨酸激酶抑制剂进行抗血管生成治疗后2~4 d,肿瘤氧合短暂改善,MVD降低了45%;舒尼替尼能抑制血管正常化窗口期间肿瘤氧分压的波动程度,导致肿瘤缺氧程度减轻。这表明舒尼替尼能够有效抑制血管生成,改善肿瘤内部区域的乏氧程度。
放疗所致的肿瘤血管生成在肿瘤的复发和转移中扮演了重要的角色,而单纯的血管抑制剂疗法虽然能够在一定程度上抑制肿瘤的生长,但其耐药性的产生、肿瘤缺氧加剧以及化疗药物的递送阻碍等局限性导致临床中施用血管生成抑制剂后总体生存率的改善较差[44]。针对这些问题,研究人员已在探究通过抗血管药物联合放射治疗(radiation therapy, RT)来提高局部控制率的可能性[45-46]。一些研究结果已揭示,血管生成抑制剂与RT联合使用产生加成效应的可能机制包括:1)直接的肿瘤抑制效应;2)通过消除无效的肿瘤血管网络[47-48]、减少组织间液压力、使内皮细胞辐射増敏[49]等机制改善肿瘤的氧合作用;3)对抗放疗诱导的血管形成,预防或延迟肿瘤复发。Gu等[50]发现具有DNA修复作用的人嘌呤/嘧啶核酸内切酶 1(apurinic/apyrimidinic endonuclease 1, APE1)同时也是一种重要的血管生成调节剂。他们研究了APE1在NSCLC放疗诱导的肿瘤血管生成中的作用及其潜在机制,发现NSCLC中APE1和VEGF的表达率高,分别为77.94%和66.18%。此外,APE1的表达与VEGF和MVD显著相关;APE1和VEGF的高表达与无病生存时间(disease-free survival, DFS)缩短显著相关;X射线可同时诱导APE1和VEGF在A549细胞中的高表达,且呈现剂量依赖性;APE1的沉默显著抑制了辐照诱导的内皮细胞的迁移和毛细血管样结构的形成。这些结果表明,血管生成调节剂APE1可能在辐射诱导的血管生成中起关键作用,放疗期间给予靶向抑制APE1的siRNA可能成为增强放疗反应、有效消除转移并提高NSCLC放疗效果的有效辅助疗法。Teicher等[51]最先在体内评估血管生成抑制剂与单剂量放疗联用的效果,发现联合治疗可显著延缓肿瘤的再生长。他们以大鼠皮下胶质肉瘤为模型,用抗血管生成剂TNP-470和米诺环素对其进行治疗,结果发现,5 d后,动物体内肿瘤乏氧的程度减轻,与未治疗组相比,治疗组因乏氧程度的减轻使得肿瘤对单剂量(10、20和30 Gy)放射治疗的反应明显增强。目前,这些发现已应用到各种临床前肿瘤模型的研究中,并具有不同程度的疗效[52-54]。
国外的一些临床研究显示,放疗联合血管抑制剂的疗效显著[55]。贝伐单抗作为一种VEGF抑制剂,已用于头颈癌(head and neck cancer, HNC)的临床试验,其结果指出,联合用药之后,放疗效果得到了明显改善[56]。David等[57]报道了用贝伐单抗和厄洛替尼(EGFR阻滞剂)联合放化疗(chemoradiotherapy, CRT)治疗29例局部晚期HNC患者的结果。调强放疗总剂量为70 Gy左右(69.5~71.5 Gy),贝伐单抗和厄洛替尼的中位药物剂量分别为3 905 mg和4 900 mg,联合治疗之后,存活患者完全缓解率(cure rate, CR)达到96%,3年局部区域控制率、无远处转移生存率、总生存率分别为85%、93%、86%。Haas等[58]采用血管抑制药物帕唑帕尼联合放射治疗的方案对12例肢体软组织肉瘤(extremity soft tissue sarcomas, ESTS)患者进行治疗。每天给予1次帕唑帕尼(药物剂量分为400、600和800 mg 3组),共治疗6周,并于第8天开始术前放疗(总剂量为50 Gy),5~7周后有10例患者接受了手术。结果显示,10例患者中有4例病理完全缓解。还有1份病例研究报告显示,1例肾癌患者在接受放疗(10×3 Gy)联合新辅助药物以及帕唑帕尼后,胃和食管转移得到完全缓解[59]。Viswanathan等[60]研究了术后放疗期间联合贝伐单抗和化疗药物的治疗效果,30位子宫内膜癌(endometrial cancer, EC)患者在手术后第29~56天开始进行IMRT治疗,在放疗的第1、29天给予顺铂[50 mg/(m2·d)]治疗,同时,在放疗第1、15和29天给予贝伐单抗[5 mg/(kg·d)]治疗,之后以可选择的高剂量率(6 Gy,3次分割,60 Gy/h)或者低剂量率(25 Gy,0.8~1.2 Gy/h)的照射方式增加剂量,随后是4个周期的卡铂和紫杉醇(剂量为135 mg/m2)治疗,最终2年总体生存率和无进展生存率分别为96.7%和79.1%。结果表明,术后化疗和盆腔调强放疗加用贝伐单抗治疗的耐受性良好,提高了高危子宫内膜癌患者的2年总体生存率。
国内也有不少学者报道了放疗联合血管生成抑制剂的临床研究(表1)。Chen等[61]发现在联合索拉非尼和常规分割放疗时的药物毒副作用是可以接受的。40例肝细胞癌(hepatocellular carcinoma, HCC)患者从放疗开始以200 mg/次、2次/d的剂量给药(索拉非尼),并持续至患者出现临床或放射学进展为止,累积RT剂量为40~60 Gy(2.0~2.5 Gy/次),共33例患者完成了全部RT疗程,部分病人出现2级或2级以上的手足皮肤反应、腹泻、肝毒性等情况。最终有22例患者(55.0%)完全缓解或部分缓解,2年总体生存率和内野无进展生存率(infield progressionfree survival, IFPS)分别为32%和39%。结果表明,在联合放疗与索拉非尼协同治疗时,放疗与血管抑制剂的剂量还有待优化。Bao等[62]对不可切除的Ⅲ期NSCLC患者实施了内皮抑素联合同步放化疗(concurrent chemoradiotherapy, CCRT)的治疗方案。患者在第1、3、5和7周接受内皮抑素[7.5 mg/(m2·d)]治疗,在第8、36天分别给予2个疗程的紫杉醇(65 mg/m2)和顺铂(65 mg/m2)治疗,同时进行胸腔常规分割放射治疗(2 Gy/次),累积剂量达60~66 Gy。在48例可评估患者中,有83%的患者处于IIIB期,65%的患者有N3期转移。总体应答率为77%,第1、2、3年局部控制率分别为75%、67%和51%,无进展生存率分别为48%、27%和16%,总体生存率分别为81%、50%和30%。结果表明,内皮抑素与同步放化疗CCRT联合用于局部晚期NSCLC显示出了可观的生存率和局部控制率。Zhai等[63]为研究厄洛替尼和放疗同时作为不耐受放化疗的食管癌(esophageal squamous cell carcinoma, ESCC)患者的替代治疗方式的安全性和有效性,共招募了18例局部晚期食管鳞状细胞癌患者。所有患者均接受IMRT,总剂量为60 Gy(2 Gy/次),放疗期间同时给予厄洛替尼150 mg/d,共60 d。治疗期间出现5例(27.8%)3级食管炎、2例(11.1%)3级皮疹、1例2级放射性肺炎和1例5级放射性肺炎,没有观察到3/4级肝功能受损或血液学毒性。放疗后1个月,有2例(11.1%)患者完全缓解,11例(61.1%)患者部分缓解,5例(27.8%)患者病情稳定。最终2年总生存率、无进展生存率和局部区域无复发生存率分别为44.4%、38.9%和66.7%。研究结果表明,对于不能耐受放化疗的食管鳞状细胞癌患者,给予厄洛替尼联合放疗是可以耐受且有效的。
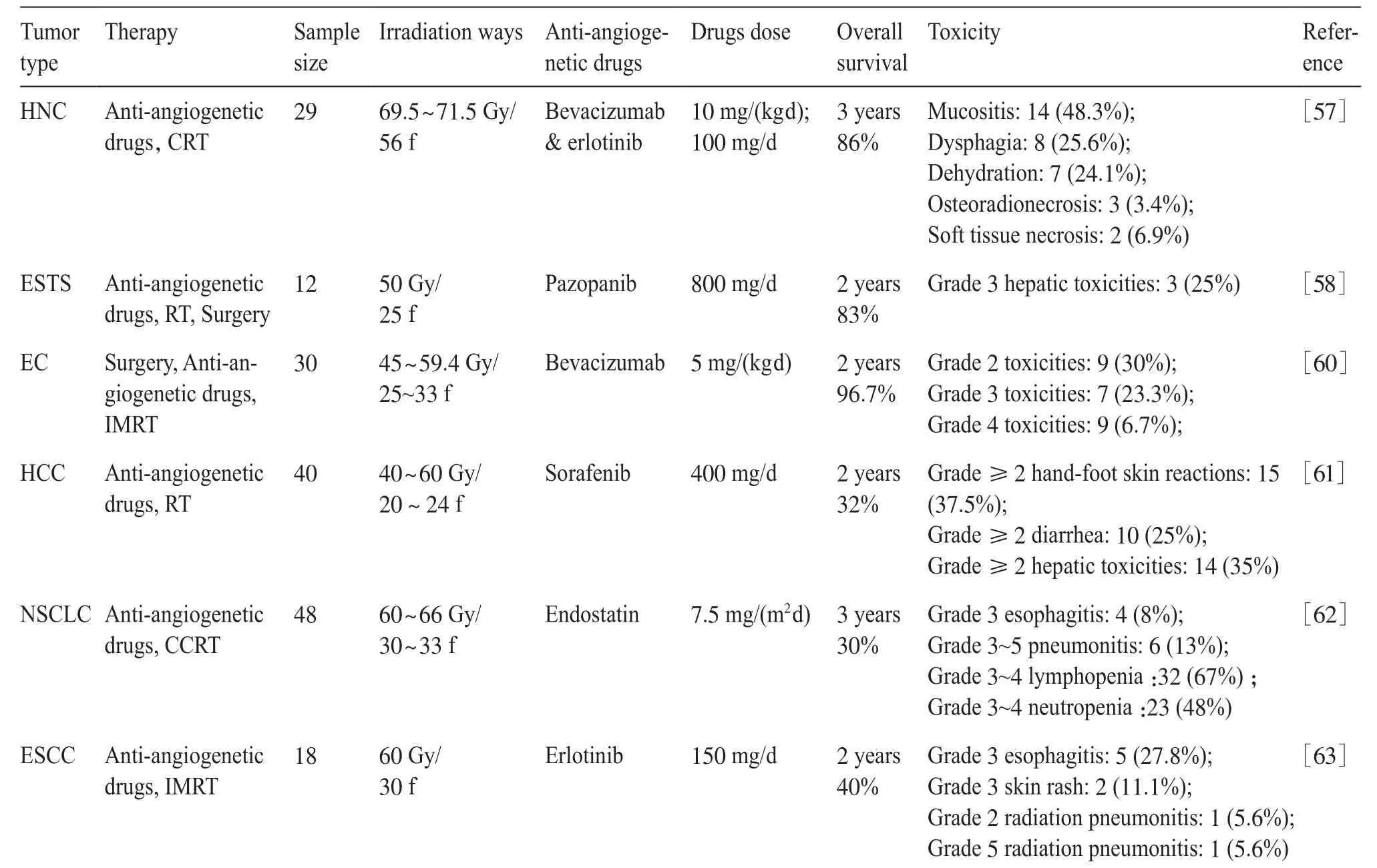
表1 血管抑制剂联合放疗案例一览Tab. 1 Case summary of anti-angiogenetic drugs and radiotherapy
以上临床研究表明,血管生成抑制剂联合放射治疗的局部控制率和总体生存率相对于单纯放疗有明显提高,具有降低对正常组织的放射性损伤、提高患者毒性耐受能力等特点,对于改善患者预后,减少肿瘤复发有明显的效果。可以预见,抗血管生成这种辅助疗法在未来的肿瘤放疗中将扮演越来越重要的角色。
4 总结与展望
血管生成对肿瘤放射治疗效果的影响不言而喻。近年来,已有学者提出血管生成可以作为肿瘤对放射治疗反应的预测因子[65-66]。而抗血管生成药物的出现,不仅为肿瘤治疗提供了新的思路,也极大地改善了放射治疗的效果[67]。此外,不断发展的医学影像学技术如高分辨率计算机断层扫描(high resolution computed tomography, HRCT)、磁共振成像(magnetic resonance imaging, MRI)等为血管生成情况的监控提供了便利[68-69]。
尽管目前已有一些临床研究基础和对初步疗效的肯定,但对于放射治疗联合血管生成抑制剂的疗效还有待优化,患者耐受性等问题还有待解决,其毒副作用尚有待降低,具体的治疗效果可能会受到年龄、性别、人种、肿瘤类型、患者身体条件、肿瘤的恶性程度等多方面因素的影响,这些实际存在的问题都对这种新的联合治疗方案提出了挑战。通过分析放疗导致肿瘤血管生成的分子机制可知,辐射诱导的肿瘤血管生成是包含了辐射应答通路在内的多信号通路协同作用的结果。因此,新的血管生成抑制靶点的发现和多靶点药物的开发可能会对这种特殊条件下的肿瘤血管生成产生更好的抑制效果。通过综述相关文献,我们认为放疗相关肿瘤血管生成研究可在以下几个方面进一步深化:1)放疗相关肿瘤血管生成过程中的表观遗传调控机制;2)高LET射线放疗(如碳离子)过程中肿瘤血管生成情况如何?是否需要与抗肿瘤血管生成药物联用?3)可动态监测肿瘤组织内部氧合程度和血管发生过程的非侵入性方法的开发;4)辐射诱导的非靶效应在肿瘤血管生成中作用如何?相信在科研人员和临床医生的共同努力下,在不久的将来,血管抑制剂联合放疗的治疗方案将更加成熟和普及,对放疗效果的改善将起到更为重要的推动作用。

