基于装载白藜芦醇的脂质体包裹介孔碳纳米管用于靶向及近红外激光触发的化疗/光热协同肿瘤治疗
李 璟,伍 旭,彭 倩,王晨旭,杨 凡*
(1. 湖南省人民医院老年医学研究所,长沙 410016;2. 中南大学肿瘤研究所,长沙 410078)
介孔材料是一类孔径介于2~50 nm之间的多孔材料,具有有序而稳定的纳米级孔隙和巨大的比表面积,因此其作为药物载体系统有着巨大的应用前景[1]。介孔碳纳米管(mesoporous carbon nanotube,MCN)是介孔材料中的一员,其不仅具有介孔材料本身固有的优点,而且还具有出色的光热转化能力,可以用于肿瘤的光热治疗(photothermal therapy,PTT)[2]。近年来,基于MCN的肿瘤光热治疗体系受到研究人员的广泛关注,成为颇为热门的研究对象[3]。Chen等[4]制备了具有磁性和热敏感性的有序介孔碳纳米球,并装载了抗肿瘤药物阿霉素(doxorubicin, DOX),用于肿瘤的化疗/光热协同治疗。Cai等[5]开发了基于氧化介孔碳纳米颗粒的药物转运体系,在颗粒表面修饰长链聚乙二醇(polyethylene glycol, PEG)分子,介孔内装载药物DOX,并用氨基化的氧化锌量子点封堵介孔口,用于肿瘤的化疗/光热协同治疗。
白藜芦醇(resveratrol, Res)是最初从植物中提取得到的一种活性多酚类物质,是植物为了抵御细菌或真菌入侵而产生的抗毒素[6],其在抗肿瘤和治疗心血管疾病、肥胖、糖尿病等方面有一定的疗效[7],是一种极具前景的抗癌分子。然而,Res在临床中的应用效果却不尽如人意,主要是由于:1)Res为脂溶性物质,在水中的溶解度小于68.8 μg/mL,所以通过口服的吸收率极低[8];2)Res在体内代谢迅速,其在人体血液中的半衰期约为8~14 min,难以保持较高的血药浓度[9];3)Res有顺式(cis-)和反式(trans-)两种异构体,其活性形式为trans-Res,然而,trans-Res的稳定性非常差,暴露在紫外光下会迅速异构化为无活性的cis-Res[10]。因此,Res的生物利用度非常低,因到达体内作用位点的药物浓度达不到有效浓度,导致其在体内的实际效果有限。
本文拟发展一种基于MCN的Res载药系统,希望能够高效地增加Res的水溶性、稳定性及生物利用度。同时,利用MCN的光热转化能力,实现近红外(near infrared, NIR)激光刺激-响应的药物定点释放,进一步通过修饰叶酸靶向分子实现药物的靶向定点释放。更为重要的是,将肿瘤的化疗与光热治疗有机地结合起来,可发挥两者各自的优势,以达到最大的疗效,产生最小的毒副作用,避免多药耐药的产生。
1 材料与方法
1.1 试剂与仪器
MCN购自南京先丰纳米材料科技有限公司;Res、atto647N-生物素(atto647N-biotin, ATTO)、链霉亲和素(streptavidin, SA)购自美国Sigma-Aldrich公司;1,2-二肉豆蔻酰基磷脂酰甘油(1,2-dimyristoyl-sn-glycero-3-phosphoglycerol, DMPG)购自美国Avanti公司 ;叶酸-聚乙二醇-二硬脂酰基磷脂酰乙醇胺[1,2-distearoyl-sn-glycero-3-phosphoethanolamine-poly(ethylene glycol)5000-folate, FA-PEG-DSPE]、生物素-聚乙二醇-二硬脂酰基磷脂酰乙醇胺[1,2-distearoylsn-glycero-3-phosphoethanolamine-poly(ethylene glycol)2000-biotin, biotin-PEG-DSPE]购自美国 Nanocs公司 ;噻唑蓝(methylthiazole tetrazolium, MTT)购自上海梯希爱化成工业发展有限公司;胎牛血清、罗斯威尔帕克纪念研究所 -1640(roswell park memorial institute-1640,RPMI-1640)培养基和细胞消化液购自美国Gibco公司 ;Hoechst 33342购自美国Invitrogen公司 ;所有试验用水均为超纯水(电阻率>18.2 MΩ·cm);人乳腺癌细胞 MCF-7(Michigan cancer foundation-7)、人肺癌细胞A549由本实验室细胞中心提供;雌性BALB/c裸鼠购自湖南斯莱克景达实验动物有限公司。
F-20型高分辨透射电镜(transmission electron mi-croscope, TEM)(日本电子光学研究所);F-7000型荧光分光光度计(日本Hitachi公司);DU-800型紫外-可见分光光度计(美国Beckman公司);3000HS型Zetasizer分析仪(美国Malvern公司);E60型红外热成像仪(美国FLIR公司);LSM900型激光共聚焦显微镜(德国Carl Zeiss);SB2200-T型超声波清洗器(美国Branson公司);Synergy LX型酶标仪(美国BioTek公司);Direct Q8型超纯水装置(法国Merck Millipore公司);HERAcell 150i型细胞培养箱(德国Thermo公司)。
1.2 试验原理
如图1所示,首先采用薄膜水化法制备纳米脂质体。纳米脂质体的组成成分为:1)DMPG,其能使脂质体成型并带负电荷;2)具有叶酸受体靶向能力的磷脂FA-PEG-DSPE;3)可修饰荧光染料的磷脂biotin-PEG-DSPE,在脂质体合成后通过链霉素-亲和素的方法将NIR荧光染料ATTO修饰在纳米脂质体上,用于荧光示踪。随后,利用MCN内介孔结构吸附抗肿瘤药物Res。同时,在MCN表面包裹叶酸-聚乙二醇-脂质体(folate-polyethylene glycol-liposome, FA-PEGLip),用于对MCN的介孔进行封堵,防止Res提前释放。FA-PEG-Lip的包裹原理为:在超声条件下,脂质体中的磷脂分子通过亲疏水作用发生重排,磷脂疏水性的尾部倾向于同样疏水的MCN纳米管表面,亲水性的磷脂头部朝向外侧。最终形成装载Res的FAPEG-Lip包裹的MCN(FA-PEG-Lip@MCN/Res)纳米体系。
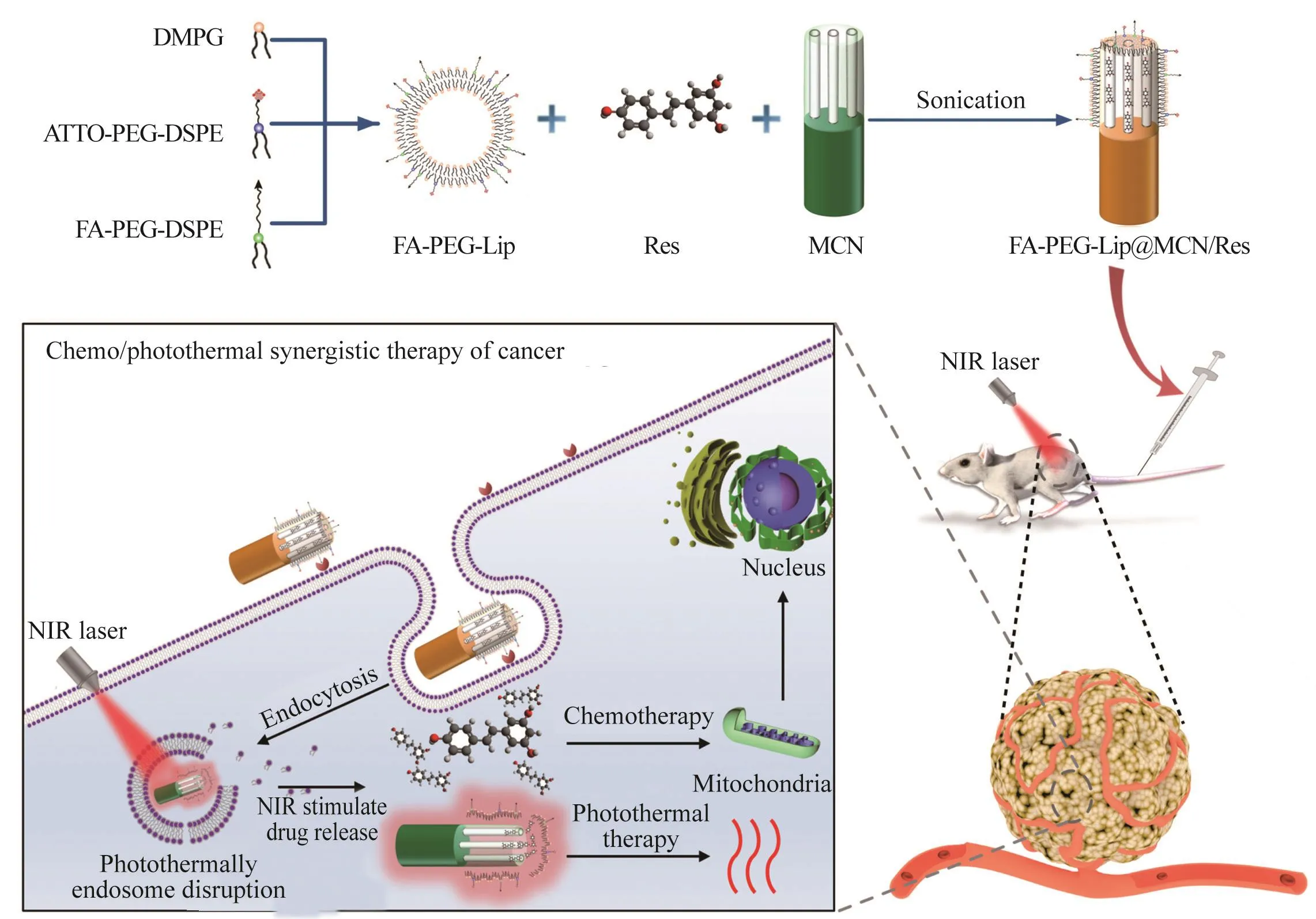
图1 FA-PEG-Lip@MCN/Res多功能纳米体系的制备及其应用于叶酸受体介导的靶向化疗/光热协同肿瘤治疗原理图Fig. 1 Schematic illustration of the synthesis of FA-PEG-Lip@MCN/Res nanocomposites and their application for folate-mediated targeted chemo/photothermal synergistic cancer therapy
FA-PEG-Lip@MCN/Res纳米体系通过尾静脉注射进入小鼠体内,经血液循环进入肿瘤部位后,可以通过叶酸受体的靶向识别停留在肿瘤细胞表面,并通过细胞内吞过程进入肿瘤细胞内。在NIR激光的照射下,FA-PEG-Lip@MCN/Res纳米体系将所吸收的光能转化为热能。光致升温不仅可以使纳米体系从内涵体中逃逸到细胞质中,而且可以使FA-PEG-Lip@MCN/Res纳米体系外层包裹的FA-PEG-Lip磷脂脱落,使MCN的介孔失去封堵物,从而将Res从MCN的介孔内释放出来。释放在细胞质中的Res可以作用于线粒体,进而作用于细胞核,诱导肿瘤细胞凋亡。光致高温本身也能够诱导细胞内的关键蛋白变性,诱导肿瘤细胞凋亡。因此,通过化疗/光热协同治疗可实现高效的肿瘤杀伤。
1.3 FA-PEG-Lip@MCN纳米复合体系的制备
1.3.1 FA-PEG-Lip和FA/biotin-PEG-Lip纳米脂质体的制备
首先采用薄膜水化法制备FA-PEG-Lip纳米脂质体[11]。将DMPG、FA-PEG-DSPE按照物质的量之比为9∶1(总的物质的量为3 μmol)溶于3 mL氯仿/甲醇溶液中。然后,将上述溶液置于圆底烧瓶中,在旋转蒸发仪上37℃水浴条件下减压蒸干有机溶剂,得到一层附在圆底烧瓶内壁的薄脂膜。将含脂膜的圆底烧瓶置于玻璃真空干燥机内干燥过夜,以完全去除残留的有机溶剂。随后,将4 mL超纯水加入脂膜中,60℃水浴超声10 min,使脂膜在水溶液中自组装成磷脂双分子层的纳米脂质体。最后,使用注射剂将上述脂质体溶液过0.22 μm的聚碳酸酯膜2次,得到粒径分布相对均一的脂质体溶液。将该脂质体溶液保存在4℃环境中备用。
含有生物素基团修饰的叶酸/生物素-聚乙二醇-脂质体(FA/biotin-PEG-Lip)的制备所加入的组成磷脂为DMPG、FA-PEG-DSPE和biotin-PEG-DSPE,且3种磷脂物质的量之比为17∶2∶1,总的磷脂含量保持在3 μmol。其他过程与上述FA-PEG-Lip脂质体制备过程基本相同。
1.3.2 FA/ATTO-PEG-Lip纳米脂质体的制备
为了获得NIR荧光成像的能力,本文将NIR荧光染料ATTO通过亲和素-生物素交联的方法修饰到上述合成的FA/biotin-PEG-Lip脂质体表面。将0.004 mmol/L SA加入4 mL FA/biotin-PEG-Lip脂质体中,在37℃金属浴中震荡反应1 h,得到FA/SA-biotin-PEG-Lip脂质体。最后,将0.040 mmol/L的ATTO加入体系中继续反应1 h,得到FA/ATTO-SA-biotin-PEGLip。使用截留量为10 kD的透析袋透析过夜,以去除过量的游离染料。简便起见,下文将FA/ATTO-SA-biotin-PEG-Lip缩写为FA/ATTO-PEG-Lip。
1.3.3 FA-PEG-Lip@MCN和FA/ATTO-PEG-Lip@MCN纳米复合体系的制备
将 5 mg MCN 粉末加入 20 mL FA-PEG-Lip 溶液中,然后将混合液置于冰水浴中,使用超声波细胞破碎仪(功率:200 W)超声3 h。得到的产物以3 000 r/min的转速离心15 min,以去除未被脂质体包裹的MCN。小心收集上清溶液,即为FA-PEG-Lip包裹的MCN(FA-PEG-Lip@MCN)。通过将FA-PEG-Lip溶液替换成FA/ATTO-PEG-Lip溶液,并使用相同的超声包裹的方法可以得到FA/ATTO-PEG-Lip包裹的MCN(FA/ATTO-PEG-Lip@MCN)。
1.4 抗肿瘤药物Res的装载与NIR激光控制的药物释放行为的研究
本试验以抗肿瘤药物Res为模式药物,通过FAPEG-Lip@MCN对Res的装载来评估所构建的药物转运体系的药物装载能力及NIR激光控制的药物释放行为。将不同质量浓度的Res溶液、1 mg/mL MCN溶液与FA-PEG-Lip溶液混合,并在冰水浴中超声处理8 h,制备装载Res的FA-PEG-Lip@MCN(FA-PEGLip@MCN/Res)。未装载的游离Res分子通过截留分子量为100 kD的超滤管离心去除。
建立Res的标准曲线,以测量Res在FA-PEGLip@MCN/Res纳米体系中的载药量。然后,采用紫外 -可见分光光度计测定1 mg/mL FA-PEG-Lip@MCN/Res溶液在306 nm处的吸光度(A),同时测定未装载Res的纳米体系FA-PEG-Lip@MCN在306 nm处的吸光度(A0),通过A减去A0即可得到纳米体系内装载的Res分子在306 nm的吸光度。根据所建立的标准曲线计算得到Res的装载质量。并通过公式(1)计算得到Res的载药量:

NIR激光刺激的Res释放行为的考察在37℃、pH为7.4的磷酸盐缓冲液(phosphate buffer saline, PBS)中进行。以780 nm半导体激光器作为NIR光源,同时设置没有NIR激光照射的FA-PEG-Lip@MCN/Res纳米体系作为对照。取少量FA-PEG-Lip@MCN/Res纳米体系置于2 mL离心管中,加入1.5 mL PBS缓冲液溶液。每隔一定时间,采用功率密度为0.8 W/cm2的NIR激光照射样品10 min,取200 μL激光照射后的样品高速离心(10 000 r/min,15 min),通过测量上清液中Res分子在306 nm处的紫外-可见吸收值来考察Res从纳米体系中释放的情况。进一步通过已建立的Res标准曲线计算所释放Res的质量,最后根据公式(2)求得在NIR激光刺激下的Res释放曲线。将测量完毕的上清液放回上述样品体系中以保持体系的总体积不变。

1.5 FA/ATTO-PEG-Lip@MCN/Res对肿瘤细胞的靶向识别效果的考察
以具有荧光示踪能力的FA/ATTO-PEG-Lip@MCN/Res纳米体系为对象,考察其对叶酸受体阳性的MCF-7细胞的特异性识别效果,采用叶酸受体阴性的A549细胞作为对照。先分别将A549细胞和MCF-7细胞以1×104个/孔的密度均匀地铺在35 mm的激光共聚焦皿中,培养过夜,使细胞充分贴壁。然后,用D-Hanks缓冲液清洗细胞,加入200 μL无血清培养基,将100 μg/mL FA/ATTO-PEG-Lip@MCN/Res纳米体系分别加入MCF-7及A549细胞中,在冰上孵育20 min,以提供纳米体系靶向识别机会,避免非特异性吸附。用D-Hanks缓冲液清洗两组细胞后,用Hoechst 33342染核10 min。最后将细胞孵育在PBS缓冲液中,使用激光共聚焦显微镜(100倍油镜)拍照。
1.6 细胞水平上NIR激光刺激的化疗/光热协同治疗效果的考察
通过细胞毒性试验考察纳米体系对MCF-7细胞的化疗/光热协同杀伤效果。首先,将处于对数生长期的MCF-7细胞(1×105个/孔,100 μL)接种于96孔板内,在37℃、5%CO2的环境下培养过夜。然后向细胞中分别加入20 μL不同质量浓度的Res、FAPEG-Lip@MCN和FA-PEG-Lip@MCN/Res。37℃条件下孵育3 h后,用D-Hanks缓冲液清洗,并向每孔加入100 μL含10%FBS的新鲜培养基。按照试验的分组情况,对需要NIR激光照射组采用功率密度为0.8 W/cm2的780 nm激光器照射5 min后,在37℃、5%CO2的环境下继续培养 24 h。随后,加入 20 μL MTT试剂,孵育4 h。小心去除含MTT的培养基,将150 μL DMSO加入每个孔中。震荡3 min后,用酶标仪测定样品在490 nm处的吸光值。以上试验均重复3次。以没有经过任何处理的细胞作为对照组,以未加入任何细胞或者试剂孔的紫外-可见吸收值为空白组,按照公式(3)计算细胞存活率:

1.7 活体水平上NIR激光刺激的化疗/光热协同治疗效果的考察
首先制备MCF-7荷瘤裸鼠模型,通过皮下注射将200 μL分散在PBS缓冲液中的MCF-7细胞注射在BALB/c裸鼠的后腿上部。等待数日,当肿瘤体积生长到大于100 mm3时,随机将荷瘤裸鼠分为5个试验组(n=3):阴性对照组(PBS + NIR光照)、游离药物组(Res处理)、单独化疗组(FA-PEG-Lip@MCN/Res处理)、单独PTT组(FA-PEG-Lip@MCN + NIR光照)、化疗/PTT组(FA-PEG-Lip@MCN/Res + NIR光照)。各种不同纳米体系通过尾静脉分别注射进入各试验组荷瘤小鼠体内。以MCN的质量计算,纳米体系注射剂量为2 mg/kg。需要NIR激光照射时,780 nm激光以0.8 W/cm2功率密度在肿瘤组织上连续照射5 min。每隔1 d采用游标卡尺监测肿瘤大小的变化,并根据公式(4)计算肿瘤的体积。采用相对肿瘤体积(V/V0)描述肿瘤大小的变化,其中V0为第0天测量得到的肿瘤体积,V为第n天测量得到的肿瘤体积。同时,每隔1 d称量小鼠体重,以监测可能产生的药物急性毒性。
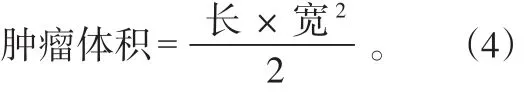
2 结果与分析
2.1 FA-PEG-Lip@MCN纳米复合体的制备及表征
基于纳米脂质体中的磷脂与MCN之间的亲疏水作用制备得到叶酸-聚乙二醇-脂质体包裹的MCN(FA-PEG-Lip@MCN)纳米体系。采用TEM表征裸的MCN及经过脂质体包裹后FA-PEG-Lip@MCN的形貌及粒径。结果显示,MCN具有典型的介孔结构(图2a),宽为(90±10)nm,长为(900±100)nm。而FA-PEG-Lip@MCN(图2b)在经过纳米脂质体的包裹后,仍然保留了规律的介孔结构,宽度也没有发生太大变化[(80±10)nm],但是长度有所降低[(600±100)nm]。FA-PEG-Lip@MCN长度的减少是由于脂质体包裹过程中的超声处理所致。X射线能谱(energy-dispersive X-ray spectrum, EDS)显示(图 2c),MCN主要由碳元素组成(另外的铜元素峰来自铜网),说明该碳纳米管是由高纯度的碳元素构成的。FA-PEGLip@MCN纳米体系除碳元素外还出现了磷元素的特征峰(图2d),而磷元素来自MCN表面包裹的脂质体。该数据初步证实FA-PEG-Lip可以成功地包裹在MCN纳米片表面。化学元素面扫分析显示(图2e),FAPEG-Lip@MCN纳米体系出现了4种元素共定位,其中碳元素来自MCN,氮元素、氧元素和磷元素来自表面包裹的FA-PEG-Lip,这再次证实了FA-PEG-Lip可以成功地包裹在MCN纳米片表面。继续采用动态光散射(dynamic light scattering, DLS)法考察制备得到的FA-PEG-Lip@MCN纳米体系。如图3a所示:裸MCN纳米管的表面电位为+22.7 mV;由带负电荷的纳米脂质体(Zeta电位:-38.3 mV)包裹形成FA-PEG-Lip@MCN后表面电位下降为-10.2 mV。表面电位测定结果再次为脂质体成功地包裹在MCN上提供了坚实的证据。综上所述,通过一系列试验,从元素组成变化、Zeta电位变化等方面均能证明FA-PEG-Lip@MCN纳米体系制备成功。
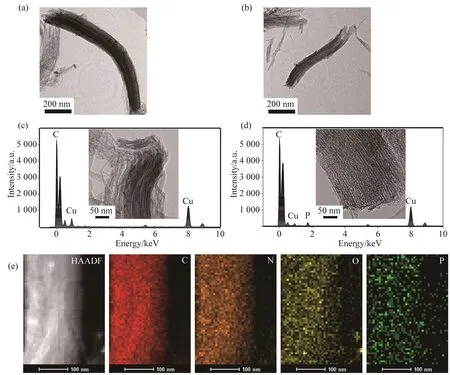
图2 不同样品的透射电镜、能谱图和元素面扫描图Fig. 2 TEM images, EDS data and elemental mapping results of different samples(a)MCN纳米管的透射电镜图;(b)FA-PEG-Lip@MCN纳米体系的透射电镜图;(c)MCN纳米管的X-射线能谱图;(d)FA-PEG-Lip@MCN纳米体系的X-射线能谱图(插入图为放大倍数更大的透射电镜图);(e)FA-PEG-Lip@MCN纳米体系的元素面扫描图。HAADF:高角度环形暗场成像图;C:碳元素维度分布(红色);N:氮元素维度分布(橙色);O:氧元素维度分布(黄色);P:磷元素维度分布(绿色)。(a) TEM image of MCN nanotubes; (b) TEM image of FA-PEG-Lip@MCN nanocomposites; (c) EDS data of MCN nanotubes; (d) EDS data of FAPEG-Lip@MCN nanocomposites (the insert shows the TEM images with higher magni fication); (e) Elemental mapping results of FA-PEG-Lip@MCN.HAADF: High-angle annular dark field image; C: Elemental mapping image of C (red); N: Elemental mapping image of N (orange); O: Elemental mapping image of O (yellow); P: EDS elemental mapping image of P (green).
用小角度X射线衍射(X-ray diffraction, XRD)对合成的MCN进行了表征。结果如图3b所示,MCN及FA-PEG-Lip@MCN在2θ≈1°附近均出现了典型的无定型介孔结构的衍射峰,进一步证明了纳米脂质体的包裹对FA-PEG-Lip@MCN纳米体系的介孔结构基本没有影响,为其作为抗肿瘤药物载体提供了基础。此外,广角XRD(图3c)的2θ值在24°~43°之间有一个宽的衍射峰,表明合成的MCN纳米管具有无定形介孔碳的性质。氮气吸附-解吸表明(图3d),合成的MCN在相对压力(P/Po)≈ 0.4处具有典型的IV型曲线,通过Barrett-Joyner-Halenda模型计算得到介孔尺寸为3.4 nm。MCN具有规则的介孔结构,能够为药物的吸附提供巨大的比表面积,因而可作为药物载体。
2.2 合成FA-PEG-Lip@MCN/Res的表征
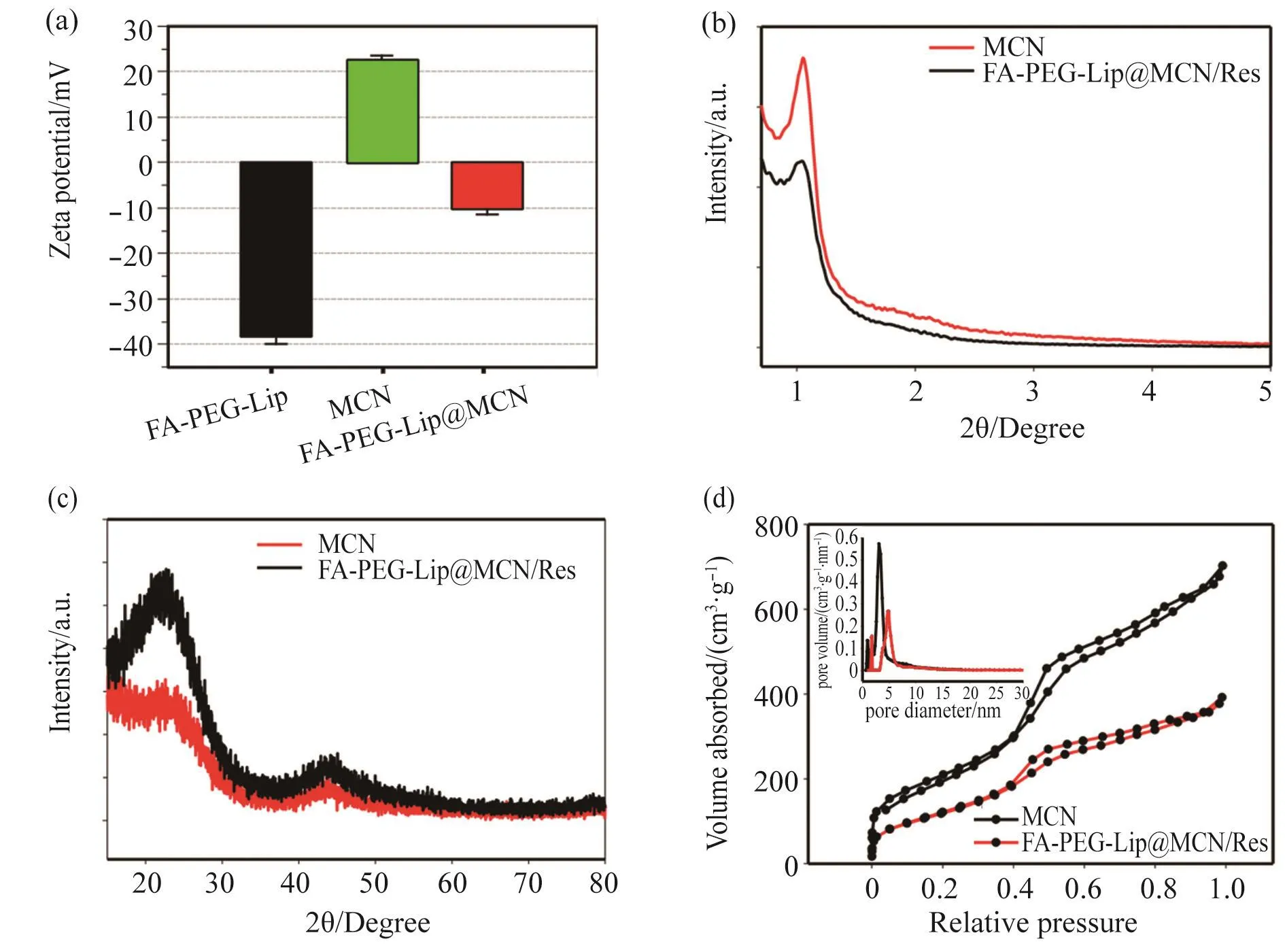
图3 不同样品的表征结果Fig. 3 Characterization of different samples(a)Zeta电位结果;(b)小角度X衍射图;(c)广角X衍射图;(d)氮气吸附-脱附图谱(插入图为相应的孔径分布图)。(a) Zeta potential results; (b) Small-angle XRD pattern; (c) Wide-angle XRD pattern; (d) N2 adsorption-desorption isotherms (the insert shows the corresponding pore diameter distributions).
在证明FA-PEG-Lip@MCN的成功合成后,本文选择了Res作为模式药物研究该纳米体系的载药性能。Res是一种活性多酚类物质,其在抗肿瘤、治疗心血管疾病、肥胖、糖尿病等方面有一定的防治作用[7]。但是由于其为脂溶性药物,在体内代谢迅速,因此,游离Res到达体内作用位点的药物浓度达不到所需的量,在生物体内的实际效果有限。本文通过将Res与MCN、FA-PEG-Lip混合并超声处理制备装载Res的FA-PEG-Lip@MCN(FA-PEG-Lip@MCN/Res)纳米体系,拟提高其水溶性和稳定性,以达到安全、高效地增强Res疗效的目的。测定FA-PEG-Lip@MCN/Res纳米体系的紫外-可见吸收光谱的结果如图4a所示。在306 nm处发现了Res的特征吸收峰,初步证明Res分子可以被成功装载到FA-PEG-Lip@MCN/Res纳米体系中。根据文献报道,MCN对吸附在其表面的荧光分子有强烈的淬灭作用[12],所以本文通过测量同质量浓度的Res在装载进入FA-PEGLip@MCN/Res纳米体系前后的荧光发射光谱来验证其是否成功装载。使用325 nm光激发FA-PEG-Lip@MCN/Res纳米体系,在400 nm处观察Res荧光发射光谱的强度变化。如图4b所示,Res在装载进入FAPEG-Lip@MCN/Res纳米体系后,荧光强度明显下降,仅存在一个微弱的荧光发射峰。这是由于Res分子吸附在MCN表面后其荧光被MCN淬灭所致。通过紫外-可见分光光度计测量FA-PEG-Lip@MCN/Res纳米体系的吸收值,并根据Res的标准曲线计算出Res在FA-PEG-Lip@MCN/Res纳米体系的载药量约为 131.59 mg/g MCN。

图4 不同样品的紫外-可见吸收光谱和荧光光谱的表征结果Fig. 4 UV-vis absorption spectra and fluorescence spectra of different samples(a)FA-PEG-Lip@MCN/Res的紫外-可见吸收光谱 ;(b)FA-PEG-Lip@MCN/Res的荧光光谱 ;(c)FA/ATTO-PEG-Lip@MCN/Res的紫外-可见吸收光谱;(d)FA/ATTO-PEG-Lip@MCN/Res的荧光光谱(插入图为荧光成像照片)。(a) UV-vis absorption spectra of FA-PEG-Lip@MCN/Res; (b) Fluorescence spectra of FA-PEG-Lip@MCN/Res; (c) UV-vis absorption spectra of FA/ATTO-PEG-Lip@MCN/Res; (d) Fluorescence spectra of FA/ATTO-PEG-Lip@MCN/Res (the insert shows the fl uorescence images).
将NIR荧光染料ATTO通过链霉素-亲和素交联的方法修饰到纳米体系上制备ATTO交联的FA-PEGLip@MCN/Res(FA/ATTO-PEG-Lip@MCN/Res),以获得NIR荧光示踪能力。如图4c所示,采用紫外-可见分光光度计测定FA/ATTO-PEG-Lip@MCN/Res的吸收光谱,发现在647 nm处出现了ATTO的特征吸收峰。随后测定FA/ATTO-PEG-Lip@MCN/Res纳米体系的荧光光谱发现(图4d),FA-PEG-Lip@MCN/Res没有任何荧光,而在修饰带ATTO染料的脂质体后,FA/ATTOPEG-Lip@MCN/Res纳米体系发出了较强的荧光信号,证明FA/ATTO-PEG-Lip@MCN/Res确实具有较好的荧光示踪能力。
为考察FA-PEG-Lip@MCN/Res纳米体系的光热升温能力,本文采用780 nm激光以0.8 W/cm2的功率密度照射不同质量浓度的FA-PEG-Lip@MCN/Res溶液,实时监测溶液的温度变化。结果如图5a所示,超纯水对照的温度仅轻微上升到30.5℃。而不同质量浓度的FA-PEG-Lip@MCN/Res溶液则有明显的升温,质量浓度为31.25、62.50、125.00、250.00和500.00 μg/mL 的 FA-PEG-Lip@MCN/Res溶液经过5 min的NIR激光照射后,温度分别上升到44.5、48.1、53.2、56.4和61.2℃。红外热成像仪拍摄的热成像图则更为直观地展示了温度的变化情况。如图5b所示,FA-PEG-Lip@MCN/Res纳米体系的温度表现出与质量浓度及NIR激光照射时间呈正相关。此外,经过5轮的反复升温,该纳米体系的升温能力未发生明显衰减(图5c),说明该FA-PEG-Lip@MCN/Res纳米体系具有良好的光热稳定性。有文献报道,大于45℃的温度就能够引起肿瘤细胞的凋亡[13]。所以,FA-PEGLip@MCN/Res纳米体系能够作为光热试剂应用于肿瘤的PTT。
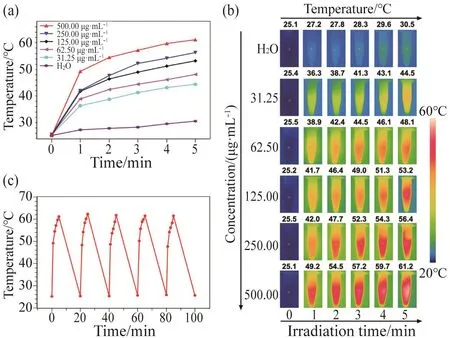
图5 光热升温效率的考察Fig. 5 Investigation of photothermal transduction efficiency(a)不同质量浓度的FA-PEG-Lip@MCN/Res用NIR激光(780 nm,0.8 W/cm2)照射后的温度变化 ;(b)不同质量浓度的FA-PEG-Lip@MCN/Res在NIR激光照射下的红外热成像图;(c)FA-PEG-Lip@MCN/Res经过5轮循环的光热稳定性考察。(a) Photothermal heating curves of FA-PEG-Lip@MCN/Res with different concentrations upon NIR laser exposure (780 nm, 0.8 W/cm2);(b) Thermal imaging photographs of different concentrations of FAPEG-Lip@MCN/Res upon NIR laser illumination; (c) The photothermal stability of FA-PEG-Lip@MCN/Res for five cycles.
2.3 NIR激光触发的药物控制释放行为的考察
能使所包裹的药物分子以NIR激光刺激-响应的方式释放是本文的主要设计意图之一。故本文对比了FA-PEG-Lip@MCN/Res纳米体系在有、无NIR光刺激的情况下药物的释放行为。如图6所示,在没有NIR激光照射的情况下,FA-PEG-Lip@MCN/Res纳米体系中Res的释放较少,在整个240 min的考察期间,仅有不到40%的药物释放。而加入NIR激光照射刺激后,FA-PEG-Lip@MCN/Res纳米体系表现出瀑布型的药物突释。例如:在第50分钟使用780 nm激光以0.8 W/cm2的功率密度进行10 min照射后,药物的释放量由15.47%增加到34.41%。当停止NIR光照之后,药物的释放速率则随之降低。重新进行光照后,药物释放再次加速,以此往复。具体的情况为:在第110分钟进行NIR激光照射后,Res的释放量由43.95%增加到60.66%;在第170分钟进行NIR激光照射后,药物的释放量由68.73%增加到80.75%;经过第230 分钟NIR激光照射后,药物的释放量由85.71%增加到90.88%。综上所述,FA-PEG-Lip@MCN/Res纳米体系中的Res可以在NIR激光照射刺激下实现可控释放。

图6 FA-PEG-Lip@MCN/Res溶液在有、无NIR激光(780 nm,0.8 W/cm2)照射下Res的释放曲线Fig. 6 NIR-laser-triggered release behavior of FA-PEG-Lip@MCN/Res with or without NIR laser (780 nm, 0.8 W/cm2) illumination
2.4 FA/ATTO-PEG-Lip@MCN/Res对肿瘤细胞的靶向识别效果考察
为验证所构建的FA-PEG-Lip@MCN/Res纳米体系对肿瘤细胞的靶向识别效果,本文采用修饰了NIR荧光染料ATTO的FA/ATTO-PEG-Lip@MCN/Res考察其对叶酸受体阳性肿瘤细胞的特异性识别情况。如图7所示,激光共聚焦(confocal laser scanning microscopy, CLSM)试验表明,叶酸受体阳性的MCF-7细胞表面出现较强的红色荧光信号,而叶酸受体阴性的A549细胞表面则仅有微弱的荧光信号,这是由于FA/ATTO-PEG-Lip@MCN/Res纳米体系经由叶酸受体介导的识别作用特异性结合到了MCF-7细胞上所致。以上结果可以证实,FA/ATTO-PEG-Lip@MCN/Res纳米体系确实能够靶向识别叶酸受体阳性的MCF-7细胞。
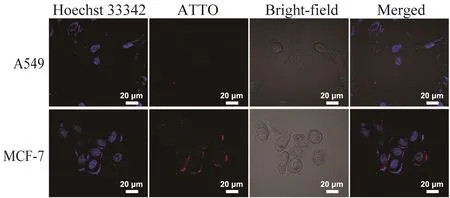
图7 特异性识别效果的考察Fig. 7 Specific binding assay将FA/ATTO-PEG-Lip@MCN/Res分别与叶酸受体阴性的A549细胞和叶酸受体阳性的MCF-7细胞孵育后的激光共聚焦显微镜成像图。其中蓝色代表Hoechst 33342的荧光,红色代表ATTO染料的荧光。CLSM images of folate receptor-negative A549, and folate receptorpositive MCF7 cells treated with FA/ATTO-PEG-Lip@MCN/Res.Blue represents the fl uorescence of Hoechst 33342, red represents the fl uorescence of ATTO dye.
2.5 肿瘤细胞化疗/光热协同杀伤效果的考察
良好的生物相容性是一个具有临床应用前景的纳米药物运输载体的必备条件之一。在考察纳米体系肿瘤治疗效果之前需先评价药物载体FAPEG-Lip@MCN本身的生物安全性。如图8a所示,与FA-PEG-Lip@MCN孵育后的MCF-7细胞表现出良好的存活率,即使FA-PEG-Lip@MCN的质量浓度高达80 μg/mL时,MCF-7细胞的存活率仍然保持在92.43%。以上结果说明药物载体FA-PEG-Lip@MCN拥有良好的生物相容性。
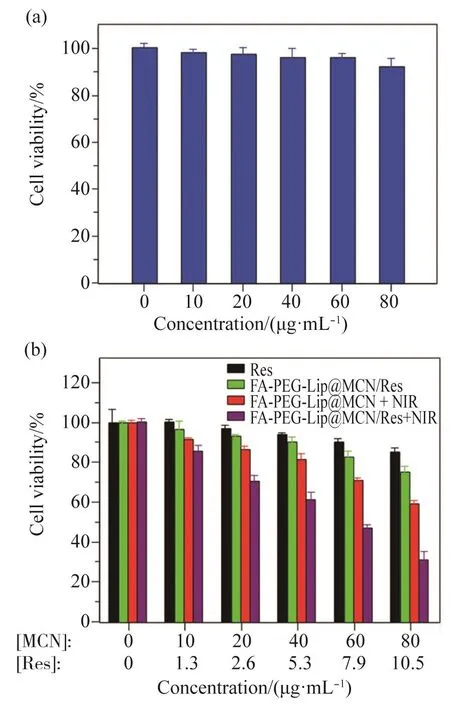
图8 细胞水平上的协同治疗Fig. 8 Synergistic therapy in vitro(a)不同质量浓度的FA-PEG-Lip@MCN对MCF-7细胞的毒性考察;(b)不同治疗方式对MCF-7的杀伤效果。(a) Cytotoxicity assays of different concentration of FA-PEG-Lip@MCN with MCF-7 cells; (b) Cytotoxicity assays of MCF-7 cells following various treatments as indicated.
同时,本文进一步开展了细胞水平上的化疗/光热协同肿瘤治疗的研究。如图8b所示,游离Res(黑色柱)对MCF-7细胞的杀伤能力较弱,即便将游离Res的质量浓度提高到10.5 μg/mL,其对肿瘤细胞的治疗效果仍然非常有限。当将Res装载到FA-PEG-Lip@MCN/Res纳米体系内时,FA-PEG-Lip@MCN/Res(绿色柱)对MCF-7细胞的杀伤效果有一定提升(Res:85.03% vs FA-PEG-Lip@MCN/Res:75.02%)。同时,单独PTT组(红色柱)也展现出了一定的肿瘤细胞杀伤能力,用质量浓度为80 μg/mL(以复合体系中MCN的质量浓度计算)的FA-PEG-Lip@MCN + NIR处理后的MCF-7细胞存活率为59.11%。而化疗/光热协同治疗组(紫色柱)取得了最好的肿瘤细胞治疗效果,用质量浓度为80 μg/mL(以复合体系中MCN的质量浓度计算)的FAPEG-Lip@MCN/Res + NIR处理后的MCF-7细胞存活率仅仅为31.23%。以上结果初步证明FA-PEG-Lip@MCN/Res纳米体系具有化疗/光热协同肿瘤治疗的能力。
2.6 活体水平上的化疗/光热协同肿瘤治疗效果的考察
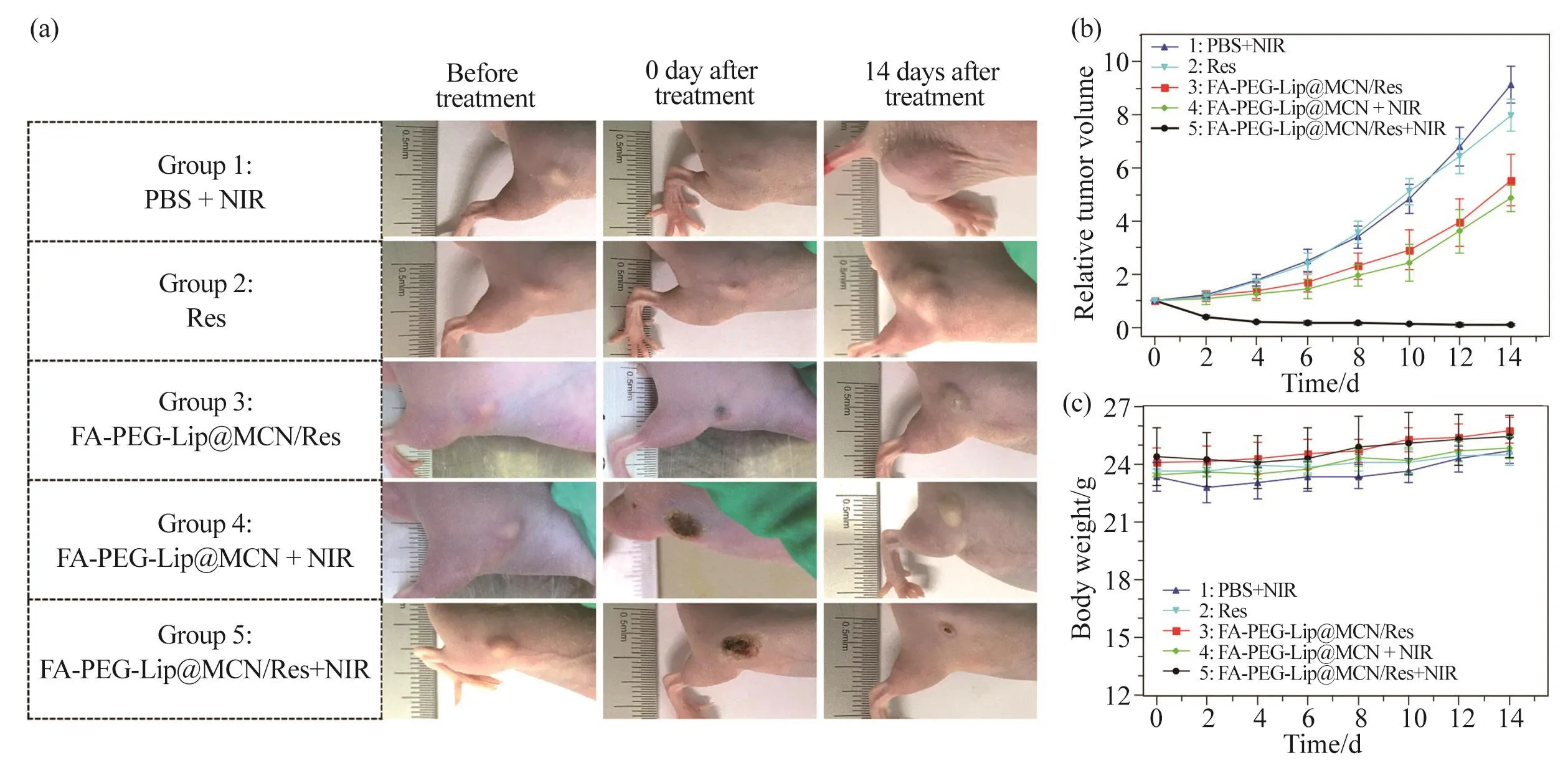
图9 活体水平上的协同治疗Fig. 9 Synergistic therapy in vivo(a)具有代表性的荷瘤小鼠经过不同处理的照片;(b)不同治疗组荷瘤小鼠的肿瘤生长曲线;(c)不同治疗组的荷瘤小鼠的体重变化曲线。(a) Digital photographs of representative mice with different treatments; (b) Tumor growth curves of different groups of tumor-bearing mice after various treatment; (c) Body weight curves of different groups of tumor-bearing mice after various treatment.
在获得FA-PEG-Lip@MCN/Res纳米体系对肿瘤细胞有高效的化疗/光热协同杀伤结果后,本文进一步在更为复杂的活体水平上开展了肿瘤协同治疗试验。将荷瘤裸鼠随机分为以下5个试验组:1)阴性对照组(PBS + NIR光照);2)游离药物组(Res处理);3)单独化疗组(FA-PEG-Lip@MCN/Res处理);4)单独PTT组(FA-PEG-Lip@MCN + NIR光照);5)化疗/PTT协同治疗组(FA-PEG-Lip@MCN/Res + NIR光照)。在进行完各组治疗后,每隔1 d使用游标卡尺测量肿瘤的大小,根据公式算出肿瘤的相对体积,并绘制肿瘤的生长曲线,以此判断各组的治疗效果。如图9a和9b所示:试验组1(PBS + NIR光照)中荷瘤裸鼠的肿瘤生长基本没有受到任何抑制,其肿瘤仍然以较快的速度在长大;试验组2(游离Res处理)对肿瘤生长抑制的能力仍然非常有限,可能由于游离Res在活体内被快速代谢所致;试验组3(FA-PEG-Lip@MCN/Res单独化疗)中肿瘤的治疗效果明显好于同质量浓度游离Res的疗效,这可能是由于Res在装载进入FAPEG-Lip@MCN/Res后,其稳定性及生物利用度有所提升[14];试验组4(FA-PEG-Lip@MCN + NIR光照)中肿瘤的生长速度同样有所减缓,说明单独PTT也有一定的疗效;令人印象深刻的是,试验组5(FA-PEGLip@MCN/Res + NIR光照)中肿瘤生长被完全抑制。试验组5之所以取得良好的治疗效果,是因为该纳米体系所具有的叶酸受体靶向运输能力、抗肿瘤药物的控制释放以及化疗与PTT的协同杀伤多种功能共同作用的结果。同时本文监测了各组小鼠在治疗过程中体重的变化情况(图9c),结果没有发现小鼠体重减轻的情况,说明各个组治疗后均没有产生急性毒副作用。以上结果说明,FA-PEG-Lip@MCN/Res纳米体系在活体水平上取得了良好的化疗/光热协同肿瘤治疗效果。
3 讨论
恶性肿瘤已经成为中国人的主要死亡原因之一[15],中国医学科学院肿瘤医院赫捷院士团队[16]的最新癌症统计数据显示,在我国,全年恶性肿瘤发病约392.9万人,死亡约233.8万人。这意味着,我国每1分钟即有7.4人被确诊患癌,4.4人死于恶性肿瘤,其防控形势异常严峻。而化疗、放疗、手术治疗等传统的肿瘤治疗方法存在靶向能力差、毒副作用大及复发率高等缺陷[17]。并且肿瘤存在异质性,即肿瘤组织内部的肿瘤细胞并不是完全一样的,各个肿瘤细胞从基因型到表现型均存在差异,并由此导致肿瘤细胞的生长速度、侵袭能力差异较大,且对抗肿瘤药物的敏感程度也有所不同[18]。长期采用一种方式进行肿瘤治疗很容易造成肿瘤的多药耐药,从而失去治疗效果。而根据肿瘤异质性设计更精准的治疗方法组合才能发挥最大的疗效、产生最小的毒副作用,避免多药耐药的发生。基于此,发展一种协同治疗体系来进行肿瘤治疗是十分必要的。
光热治疗是利用纳米材料优异的吸光能力将光能转换为热能,通过加热病灶部位来达到杀伤肿瘤细胞目的的一种治疗方式,其能够通过“双选择”实现对肿瘤部位的特异性治疗。首先,纳米治疗体系所修饰的靶向分子对肿瘤组织有特异性识别的能力,此为第一重选择过程;其次,可以通过控制治疗激光的照射部位、照射激光强度以及照射时间实现对肿瘤部位的特异性杀伤[19],此为第二重选择过程。因此,光热治疗具有高特异性和低毒副作用的优势。MCN具有独特的表面效应、超大的比表面积、良好的光热转换效率以及较好的生物相容性等物理化学性质,在肿瘤的化疗/光热协同治疗领域潜力巨大[20]。
本文基于MCN为药物运输载体运载抗肿瘤药物Res,同时选用FA-PEG-Lip包裹,构建了装载Res的FA-PEG-Lip包裹MCN(FA-PEG-Lip@MCN/Res)纳米体系。该纳米体系能够通过叶酸受体介导的靶向识别过程特异性进入叶酸受体阳性的肿瘤细胞。由于Res能通过氢键和疏水作用吸附在MCN的介孔结构内[21],所以该纳米体系能够提高Res的水溶性、稳定性、生物利用度,从而提高Res的抗肿瘤治疗效果。同时,利用FA-PEG-Lip@MCN/Res纳米体系中MCN的高效光热转化能力,一方面可以提高肿瘤部位的局部温度,进而直接杀死肿瘤,实现肿瘤的PTT;另一方面,光致升温可以作为一种刺激信号,控制药物在肿瘤部位定点释放。此外,适度高温也可以增加肿瘤组织对化疗药物的敏感性,实现化疗、光热作用效果的叠加,从而达到肿瘤的协同治疗。细胞水平上以及动物水平上的试验表明,该纳米体系能够实现高效的肿瘤化疗/光热协同治疗。基于其优异的协同治疗效果及良好的生物安全性,我们相信FA-PEG-Lip@MCN/Res纳米体系有望应用于实际的临床肿瘤治疗。

