微生物炭基土壤调理剂对水稻生长生理和镉吸收的影响
宋如荻,彭晓英,王亦豪,田梓轩a,刘福来b,2,王惠群*
(1. 湖南农业大学 a. 生物科学技术学院;b. 芒属植物生态应用技术湖南省工程实验室,长沙 410128;2. 哥本哈根大学理学院植物与环境科学系,泰斯特鲁普 DK-2630)
水稻(Oryza stivaL.)是一种重要的全球粮食作物,中国60%以上的人口以水稻作为主食[1]。由于地球上人口急速增长,耕地重金属污染加剧,使得提高粮食产量和品质的压力越来越大[2-3]。因此,如何保证粮食安全就成为了人们长久以来关注和研究的热点[4-6]。水稻镉含量超标事件让人们认识到土壤退化或酸化带来的问题的严重性。目前水稻综合降镉技术体系是“VIP+n”(V :variety ;I:irrigation ;P :pH adjustment;n :other technology。如菌肥、生物炭、有机肥、叶面阻控剂硅肥等)[7]。近年来,各种提高酸性稻田的pH值以降低籽粒对镉积累的土壤调理剂进入了人们的研究视野,其中备受关注的是微生物菌剂、生物炭和活性硅等土壤调理剂[8-15]。植物产生的细胞分裂素(cytokinin, CTK)和生长素(indole-3-acetic acid,IAA)等植物激素能调节其生长和发育。许多活跃的细菌生长在植物的根际和根系内,通过某些机制刺激植物的生长,这些细菌总称为根围细菌。许多根围细菌能够合成CTK,称为细胞分裂素生产菌(cytokinin producing bacteria, CPB),如枯草芽胞杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)和假单孢菌(Pseudomons adaceae),其能通过增加根际和根系内的CTK含量来影响植株植物激素的平衡,促进植株生长[16]。CTK生产菌菌剂是一种微生物混合菌剂,包含胶质芽孢杆菌(Bacillus mucilaginosusKrassilnikov)、巨大芽孢杆菌(Bacillus megaterium)、枯草芽孢杆菌、木霉菌(Trichodermaspp.)、光合菌(photosynthetic bacteria, PSB)和菌根菌(mycorrhizal fungi),其与肥料配施可提高小麦、马铃薯和甜瓜等作物的光合速率、根系活力、水分利用率及对肥料的利用率,以达到增产的目的[17-19]。生物炭是生物质经高温限氧热裂解而成的多孔状炭化物,是一种良好的吸附材料,在肥料缓释、土壤改良和环境修复等方面被人们认知。生物炭可以改变土壤的理化性质,提高土壤中微生物的生物量和多样性以及水稻的肥料利用率,促进植物的生长和发育,从而提高产量[9-11]。硅是多数植物需要的有益元素,能够提高植物光合速率和干物质的积累,改善植物体内水分代谢和水分利用率等。水稻是典型的喜硅植物,硅对缓解水稻生物与非生物胁迫具有重要作用[14-15,20]。南荻(Miscanthus lutarioripariusL.)是禾本科(Poaceae)芒属(Miscanthus)多年生的高大草本植物,具有发达根状茎,生物量大,主要在我国长江中下游及洞庭湖区连片生长,分布面积约1 000 km2。南荻的秸秆在500℃条件下缺氧热裂解,生产出硅含量较高、镉含量较低的南荻炭[21]。南荻炭可通过其多级孔的物理吸附及带电吸附降低土壤中镉离子的移动性。
目前较多的研究都只关注了单一的降镉材料,但由于土壤是一个复杂的生态系统,因此单一土壤调理剂会随着时间的推移而存在吸附镉的解吸作用,使其降镉效果不稳定[22]。有研究表明,生物炭比重较小,很难与土壤沉积界面充分接触,使其镉钝化剂效应不稳定。同时,单一生物炭对镉污染土壤修复同其他金属元素一样存在解吸附和缓释作用[23]。硅虽能提高水稻的抗逆能力,但因为活性硅在土壤中易被作物耗竭而导致土壤缺硅,所以随着土壤中活性硅的减少,土壤镉解吸附作用就会增强[24]。研究已发现,生物炭与矿物肥料结合使用时,其与矿物元素的相互作用可以增强水稻在不同类型的非生物胁迫下的性能[25-26]。而对于以南荻炭、活性硅以及细胞分裂素生产菌剂二元或多元复配的土壤调理剂在镉污染土壤-水稻生态系统中对水稻生长生理和镉吸收的影响机制目前还缺乏深入认识。因此本研究应用多学科交叉领域的土壤调理剂技术研究材料细胞分裂素生产菌剂、南荻炭和活性硅,制备多元复配材料——微生物炭基土壤调理剂。通过南荻炭、活性硅以及细胞分裂素生产菌剂间的协同和互补作用促进水稻的生长发育,增强土壤的酸缓冲能力,提高根系对镉的生理生化阻控作用,从而达到提高水稻产量和品质的目的,为进一歩筛选出水稻专用微生物炭基土壤调理剂配方提供一定的理论基础。
1 材料与方法
1.1 试验材料
试验水稻品种为黄华占。盆栽用的圆柱形聚乙烯塑料桶的上表面直径为30 cm,下表面直径为28 cm,高度为25 cm。盆栽土壤的基本理化性质如下:土壤类型为黏性红壤,pH为5.32,有机质含量为1.37 g/kg,全氮含量为0.58 g/kg,全磷含量为0.26 g/kg,全钾含量为15.27 g/kg,镉含量为 1.84 mg/kg。南荻炭为生物质能源多联产技术生产的生物炭,其限氧热裂解温度为500℃。南荻炭基本理化性质如下:碳含量为75.41 g/kg,氮含量为0.78 g/kg,磷含量为0.19 g/kg,钾含量为0.95 g/kg,硅含量为506.00 mg/kg,总比表面积为33.60 m2/g,pH为9.77。细胞分裂素生产菌剂为固体且钝化的混合菌剂,包含胶质芽孢杆菌、巨大芽孢杆菌、枯草芽孢杆菌、木霉菌、光合菌和菌根菌。活化后使用时其有效菌的数量不少于2×109CFU/g(CFU为菌落形成单位),总有效活菌数不少于1011CFU/g。活性硅是佛山市铁人环保科技有限公司生产的降镉灵硅肥,其硅含量为85 g/L。然后将硅肥稀释成Na2SiO3的质量浓度为300 mg/L的溶液。
1.2 试验设计及水稻盆栽的培养方法
镉污染土壤水稻盆栽试验在自动遮雨棚中进行。采用随机区组设计,共有细胞分裂素生产菌剂、南荻炭和活性硅3个处理因素,共设4个处理:CK(常规施肥)、T1(常规施肥+细胞分裂素生产菌剂)、T2(常规施肥+细胞分裂素生产菌剂+南荻炭)和T3(常规施肥+细胞分裂素生产菌剂+南荻炭+活性硅)。每个处理重复4次。
2018年5月7日开始试验,每盆加入10 kg风干的镉污染土壤和6.5 g复合肥(mN∶mP2O5∶mK2O=21∶7∶12)。细胞分裂素生产菌剂加入量为10 g/盆。南荻炭加入量为100 g/盆,每盆加入25 mL的Na2SiO3的质量浓度为300 mg/L的硅肥溶液。每个处理都对应加入风干土壤、复合肥、南荻炭和活性硅,均匀混合后装入盆中;加入自来水使液面高于土壤2 cm,土壤孵育10 d。于2018年5月17日将水稻催芽后采用直播的方式进行培育,每盆50粒左右,在幼苗三叶期时,间苗至24株/盆。在水稻分蘖前期将细胞分裂素生产菌剂以10 g/盆的量用自来水活化后施入水稻盆栽中。在水稻全生育期间淹水2 cm左右。水稻分蘖中期追施6 g/盆的尿素。在水稻分蘖期施加烯啶吡蚜酮以防治白粉虱和蚜虫。成熟期间用防虫尼龙网防鸟。
1.3 样品采集与测定方法
1.3.1 样品的选择和采集
在水稻抽穗期(8月4日—8月5日),各处理分别选取长势一致的6株水稻做好标记。8月4日对标记植株的剑叶进行光合作用参数的测定,8月5日将标记植株挖出后洗净并进行各生理生化指标的测定。于收获期收获植株,进行株高、籽粒相对产量和镉含量的测定。
1.3.2 光合作用参数的测定方法
选用LI-6400便携式光合系统测定剑叶的光合作用参数,光通量密度为 1 000 μmol/(m2·s)。测定时是晴朗无风天气,测定时间为上午9:00—11:00。
1.3.3 丙二醛含量和抗氧化酶活性的测定
剑叶丙二醛含量采用硫代巴比妥酸(thiobarbituric acid, TBA)法测定,参照李子芳等[27]的方法稍作修改。过氧化物酶活性采用愈创木酚分光光度测定法进行测定,参照王伟玲等[28]的方法并稍作修改。过氧化氢酶活性采用南京建成试剂盒法测定。超氧化物歧化酶活性采用黄嘌呤氧化酶法测定[29]。
1.3.4 根系活力和根系微生物多样性的测定
根系活力参照王秀波等[30]的氯化三苯基四氮唑(2, 3, 5-triphenyltetrazolium chloride, TTC)法测定。应用上海美吉生物医药科技有限公司的宏基因组测序测定根系真菌和细菌多样性,以测定根系微生物的多样性。
1.3.5 株高与相对产量的测定
株高的测定方式为采用卷尺测定收获期水稻植株茎基部至穗尖的长度。计算每盆水稻的实际产量。每盆实际产量=∑Wi=W1+W2+W3+……Wn,其中W为每株饱粒重(g)。
1.3.6 茎秆和籽粒的镉含量测定
镉含量测定采用GB 5009.268-2016的食品中多元素测定方法,应用电感耦合等离子体质谱仪测定。镉转运系数X=C籽粒/C茎秆。其中X为镉转运系数;C籽粒为茎叶镉含量(mg/kg);C茎秆为根镉含量(mg/kg)[31]。
1.4 数据处理
采用 Microsoft Excel 2010 和数据处理系统分析软件DPS v12.5对数据进行分析;采用Duncan方法进行多重比较分析。
2 结果与分析
2.1 微生物炭基土壤调理剂对抽穗期剑叶光合作用参数的影响
由表1可知,在抽穗期,水稻剑叶的净光合速率在CK出现了最小值,其他3个处理均与CK有显著性差异。其大小的顺序为T3>T2>T1>CK,T3的净光合速率为17.67 μmol/(m2·s),比CK提高了38.05%。蒸腾速率大小的顺序为 T2>T1>T3>CK,T2为14.27 g/(m2·h),比CK提高了36.69% ;T2与其他3个处理结果的差异均具有显著性。气孔导度的大小排序为T3>T2>T1>CK,CK的最小值为0.52 mmol/(m2·s),T3的最大值为1.00 mmol/(m2·s),T3比CK提高了92.31%,T1、T2和T3与CK都有显著性差异。胞间CO2浓度的大小排序为T1>CK>T2>T3,各处理间没有显著性差异。由此说明,微生物炭基土壤调理剂能提高抽穗期水稻的光合作用能力。
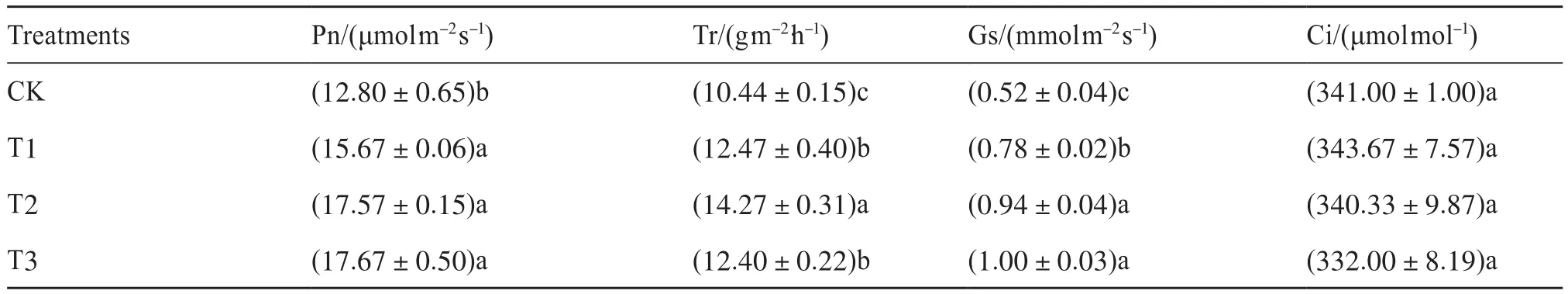
表1 微生物炭基土壤调理剂对抽穗期剑叶光合作用参数的影响Tab. 1 Effects of microbial and biochar soil conditioner on photosynthetic parameters of the rice flag leaves at heading stage
2.2 微生物炭基土壤调理剂对抽穗期剑叶抗逆生理的影响
从表2可知,抽穗期剑叶丙二醛(malondialdehyde,MDA)含量大小的排序为T2<T3<T1=CK,其中T2的最小值为0.036 μmol/g,4个处理间没有显著性差异。过氧化物酶活性大小的顺序为T2>T3>T1>CK,T2的过氧化物酶活性与CK、T1和T3都具有显著性差异。过氧化氢酶活性大小的顺序为T3>T2>T1>CK,T1、T2和T3的过氧化氢酶活性都与CK有显著性差异。T3的超氧化物歧化酶活性为1.98 U/mg,比CK的提高了4.21%。T1、T2和T3的超氧化物歧化酶活性与CK相比都有显著性差异。总之,微生物炭基土壤调理剂能降低膜脂过氧化作用的产物MDA的含量,提高抗氧化酶的活性,从而增强水稻的抗逆能力。

表2 微生物炭基土壤调理剂对抽穗期剑片抗逆生理的影响Tab. 2 Effects of microbial and biochar soil conditioner on resistant physiology of the rice flag leaves at heading stage
2.3 微生物炭基土壤调理剂对抽穗期根系生理的影响
由图1可知,不同处理的根系活力的大小顺序为T3>T1>T2>CK,CK最小,为53.38 μg/(g·h),T3最大,为154.32 μg/(g·h)。T3与CK之间处理后的根系活力差异具有显著性。这表明,微生物炭基土壤调理剂能够增强水稻的根系活力。
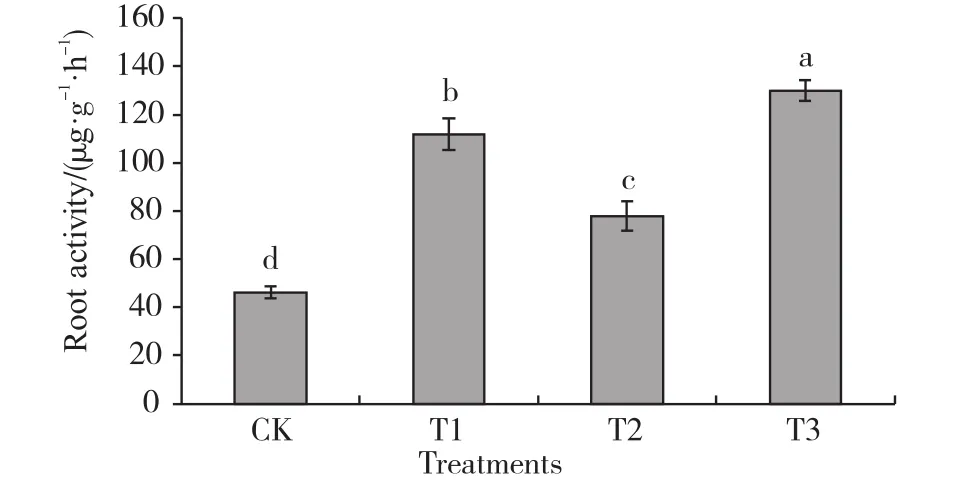
图1 微生物炭基土壤调理剂对抽穗期根系活力的影响Fig. 1 Effects of microbial and biochar soil conditioner on root activities at heading stage图中的不同小写字母表示Duncan’s多重分析统计检验达5%显著性水平。The different lowercase letters in the figure indicate that Duncan’s multiple analysis statistical test reaches 5% signi ficance level.
各处理抽穗期根系样品经宏基因组测序后得出各处理根系样品一共有6 333个细菌OTUs(OTUs 为可执行的分类操作单位)和976个真菌OTUs。由图2a可知,4个处理根系样品重合部分的细菌OTUs为966个,只占OTUs总数的15.25%,说明施用不同微生物炭基土壤调理剂对细菌的丰度有明显的影响。而CK与T1处理共有1 197个细菌OTUs,CK与T2共有1 141个细菌OUTs,CK与T3共有1 194个细菌OTUs,T1与T2共有1 248个细菌OTUs,T1与T3共有1 292个细菌OTUs,T2与T3共有1 340个细菌OTUs。结果表明,CK与其他处理之间的细菌种类组成的相似性大小的顺序为T1>T3>T2,微生物炭基土壤调理剂T1、T2和T3间的细菌种类组成的相似性大于CK与T1、T2和T3间的细菌种类组成的相似性。
由图2b可知,各处理根系样品重合部分的真菌OTUs为77个,只占总数的7.89%。这说明施用细胞分裂素、南荻炭、硅肥对真菌的丰度有明显的影响,而CK与T1处理共有102个真菌OTUs,CK与T2共有97个真菌OUTs,CK与T3共有110个真菌OTUs,T1与T2共有129个真菌OTUs,T1与T3共有131个真菌OTUs,T2与T3共有148个真菌OTUs。结果表明,CK与其他处理之间的真菌种类组成的相似性大小的顺序为T3>T1>T2,微生物炭基土壤调理剂T1、T2和T3间的真菌种类组成的相似性大于CK与T1、T2和T3间的真菌种类组成的相似性。
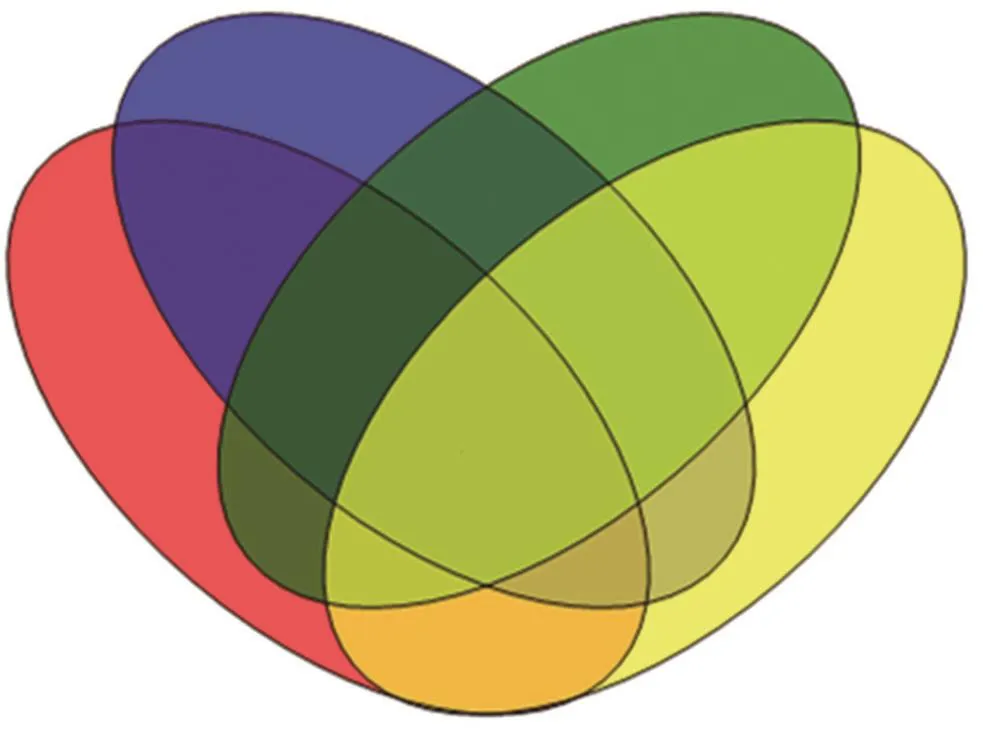
图2 细菌(a)和真菌(b)OTUs分布维恩图Fig. 2 Bacterial (a) and fungal (b) OTUs distribution Wenn diagram
由图3a可知,4个处理根系细菌在门的分类水平上最大丰度排名前十的种类为:变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、纤维杆菌门(Fibrobacteres)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloro fl exi)、螺旋菌门(Spirochaetae)、疣微菌门(Verrucomicrobia)和Lgnavibacteriae。进一步分析处理间的差异发现,添加了细胞分裂素生产菌的T1中变形菌门的丰度比CK稍有提高,提高了3.16%,而T2、T3虽相比CK的丰度有所降低,但T3的丰度略大于T2,说明对比2种调理剂施用,3种调理剂同时施用使变形菌门的丰度稍微上升了。T2、T3的放线菌门的丰度比CK均有提升,分别提高了8.77%、7.83%。T1对比CK的丰度下降了0.04%,放线菌门的丰度略有下降。T1、T2、T3中的拟杆菌门的丰度对比CK稍有下降,分别下降了2.14%、1.11%、0.52%,但随着3种调理剂的依次加入,拟杆菌门的丰度略微上升。T1、T2、T3中的厚壁菌门的丰度对比CK均有提升,分别提高了1.73%、3.88%、3.36%。T1、T2、T3中的纤维菌门的丰度对比CK稍有下降,分别下降了3.37%、2.72%、1.90%,但随着3种调理剂的依次加入,纤维菌门丰度有上升趋势。
由图3b可知,4 个处理根系真菌在门的分类水平上最大丰度排名前三的种类为:子囊菌门(Ascomycota)、未鉴定(unclassified_k_Fungi)、担子菌门(Basidiomycota)。其中,T1、T2、T3中的子囊菌门的丰度对比CK稍有下降,分别下降了1.29%、3.72%、4.19%。处理T1、T2中的担子菌门的丰度对比CK都有所下降,分别下降了1.13%、0.52%。而施用了3种调理剂的T3中的担子菌门的丰度比CK提高了0.62%。
2.4 微生物炭基土壤调理剂对收获期株高与产量构成的影响
由表3可知,在收获期水稻株高大小的顺序为T3>T1>CK>T2,但是各处理间没有显著性差异。各处理千粒重大小的顺序为T1>T3>T2>CK,CK最小,为18.04 g,T1最大,为21.12 g,T1比CK提高了17.07%。T1、T3的千粒重与CK都有显著性差异,T2与CK的千粒重没有显著性差异。相对产量大小的顺序为T3>T2>T1>CK,其中T1、T2 、T3与CK的相对产量都有显著性差异,T1、T2和T3对CK增产率分别为20.07%、24.28%和27.94%。结果表明,微生物炭基土壤调理剂能够增加收获期的株高,明显增加相对产量。
2.5 微生物炭基土壤调理剂对收获期水稻镉吸收和转运的影响
由表4可知,水稻茎秆镉含量的大小顺序为CK>T1>T2>T3,CK镉含量最大,为1.05 mg/kg,T3镉含量最小,为0.85 mg/kg,T1、T2、T3茎秆的镉含量分别比CK降低了12.62%、13.57%、24.05%。水稻籽粒镉含量的大小顺序为CK>T1>T2>T3,CK最大,为0.52 mg/kg,T3最小,为0.20 mg/kg。T1、T2、T3与CK籽粒的镉含量都有显著性差异,分别比CK降低了50.00%、61.54%、64.29%。土壤到茎秆的镉转运系数大小的排序为CK>T1>T2>T3,但各处理间没有显著性差异。茎秆到籽粒的镉转运系数大小的顺序为CK>T1>T2=T3,T1、T2、T3比CK的茎秆到籽粒的镉转运系数均有显著降低,分别降低了50.00%、53.80%、61.50%,T1、T2、T3与CK的茎秆到籽粒的镉转运系数都有显著性差异。结果表明,微生物炭基土壤调理剂能够降低籽粒的镉含量和茎秆到籽粒的镉转运系数。
3 讨论
3.1 微生物炭基土壤调理剂能够增强水稻的抗逆生理能力
水稻抗逆生理能力通常用逆境和自然衰老过程中叶片膜脂过氧化产物丙二醛的含量、抗氧化酶的活性和电导率等表示。过氧化物酶、过氧化氢酶与超氧化物歧化酶是植物抗氧化物酶系统中的3种关键酶,可通过催化植物体组织与细胞内超氧阴离子发生歧化反应,消除自由基对植物细胞的氧化伤害,促进植物生长[32]。研究表明,南荻炭具有大量孔隙结构和活性硅含量,具有较强的吸附性能。硅在水稻植株中主要以无定形态的SiO2·nH2O的形式存在[33]。硅通过减少镉的吸收和氧化应激来减轻植株中镉的毒性,施用硅肥能促进水稻地上部的生长发育[34]。活跃在根系周围的细胞分裂素生产菌能促进植株的生长,提高植物抵抗干旱逆境胁迫的能力[12]。本研究结果表明,使用微生物炭基土壤调理剂后,植物细胞膜脂过氧化产物丙二醛的含量减少了,在一定程度上提高了过氧化氢酶、过氧化物酶、超氧化物歧化酶的活性。这说明,微生物炭基土壤调理剂可有效提高水稻抗逆生理能力。
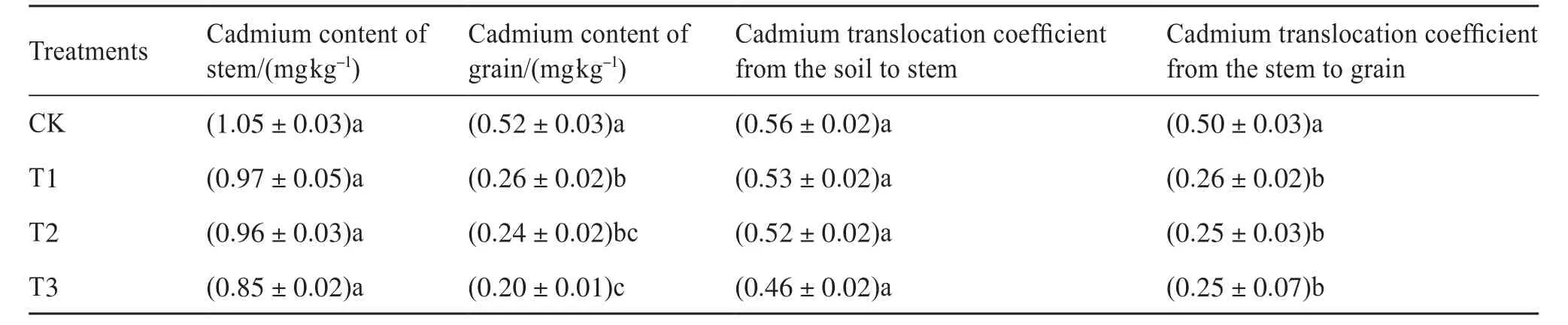
表4 微生物炭基土壤调理剂对收获期水稻镉吸收和转运的影响Tab. 4 Effects of microbial and biochar soil conditioners on cadmium uptake and translocation at harvest in rice
3.2 微生物炭基土壤调理剂能够提高水稻的根系活力和细菌多样性
本研究结果表明,微生物炭基土壤调理剂具有提高水稻根系活力的能力,这与前人的研究结果相似[17]。本研究结果还表明,施加微生物炭基土壤调理剂后提高了总体根系细菌种类的多样性和分布的均匀程度。这和Graber等[35]的研究结果一致,可能是由于生物炭的多孔性,细菌在土壤中生长及繁殖有了更多的空间,因而增加了细菌的数量。而根系中真菌OUTs丰度、物种丰度及均匀度总体来说减少,说明施加微生物炭基土壤调理剂会降低根际土壤真菌种类的多样性和分布的均匀程度。这些研究结果与Van Zwieten等[26]的研究结果一致。水稻根系细菌的丰度提高说明微生物炭基土壤调理剂对根系细菌的增殖有促进作用,能使得细菌与真菌的比值增加,因此细菌型土壤被普遍认为是土壤肥力提高的标志[36]。微生物炭基土壤调理剂也可能使稻田土壤向“细菌型”土壤转变,这有待进一步证实。
3.3 微生物炭基土壤调理剂能够提高抽穗期水稻的光合作用能力、增加收获期的株高和相对产量
生物炭能提高作物的肥料利用率。硅肥能使固定磷肥的游离铁、铝变得不可溶,从而降低对磷的固定;溶解的硅酸进入土壤黏土矿物的晶格中,能降低土壤对磷的吸附,从而提高作物的肥料利用率。本研究结果表明,南荻炭、细胞分裂素生产菌和活性硅对水稻的光合作用具有协同促进水稻生长生理的能力,这与许依等[37]的研究结果一致。施用微生物炭基土壤调理剂处理的株高相比对照的株高有一定程度的提高,这与南荻炭、细胞分裂素生产菌、活性硅能提高土壤中的营养元素和根系植物激素稳态有直接关系。此外,施用微生物炭基土壤调理剂能提高水稻的每盆相对产量,这与南荻炭与不同类型土壤调理剂互作施用有紧密联系。总之,南荻炭、活性硅和细胞分裂素生产菌协同作用形成的微生物炭基土壤调理剂能够通过提高水稻的光合作用能力、增加株高来提高产量。
3.4 微生物炭基土壤调理剂能够降低籽粒镉含量和茎秆到籽粒的镉转运系数,提高籽粒品质
镉进入水稻籽粒大约分为4个步骤:①土壤镉向根表迁移;②根表镉(主要吸附在根表胶膜镉)向根内移动;③镉从根表运输进入根内;④根中镉向地上水稻各部分输送、分配和积累。南荻炭和其他生物炭一样,具有沉淀和吸附镉离子的能力,阻控步骤①[38]。同时南荻炭的孔隙结构可为微生物提供栖息地。细胞分裂素生产菌对镉的阻控主要有胞外吸附与胞内积累,阻控步骤①和②。碱性生物炭能使土壤溶液中的碱性基团如硅酸根离子、磷酸根离子和碳酸根离子等与重金属形成难溶性化合物[39]。活性硅可以减轻许多植物的镉毒害,通过形成硅镉复合物或抑制水稻镉吸收和迁移的转运蛋白基因表达来降低镉的积累,主要能阻控步骤②和③,也阻控步骤①和④[40]。本研究中添加了南荻炭的T2、T3处理相较CK来说,其茎秆中镉含量降低,籽粒中镉含量均显著降低,且添加了微生物炭基土壤调理剂的T1、T2、T3处理,其土壤向茎秆的镉转运系数相较于CK均有一定程度的降低。而T1、T2、T3的茎秆向籽粒的镉转运系数不仅比CK降低了,同时与CK的差异具有显著性。这说明茎秆向籽粒的镉转运系数的降低可能得到更高品质的籽粒。因此,我们可以制备基于生物质炭的多元复配技术新产品微生物炭基土壤调理剂,并将其与硅、细胞分裂素生产菌剂共同施用来进一步提高土壤酸缓冲容量,通过多重协同效应和互补效应来阻控土壤镉进入水稻,减少籽粒镉的积累。其准确的水稻镉阻控机理还需要进一步的研究。

