一株冢村菌的筛选及其对邻苯二甲酸二丁酯的降解特性研究
王雨婷,靳 拓,胡 芳,黄仕林,刘慧君*,金德才
(1. 北京农学院,农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206;2. 农业农村部农业生态与资源保护总站,北京 100125;3. 湖南省长沙生态环境监测中心,长沙 410001;4. 中国科学院生态环境研究中心,中国科学院环境生物技术重点实验室,北京 100085)
邻苯二甲酸酯(phthalic acid esters, PAEs)是被广泛应用于橡胶用品、塑料、涂料、农药、食品包装、个人护理用品等领域的一类人工合成的持久性有机化合物[1]。在PAEs被广泛应用的同时,其对人类健康和生态环境安全的威胁也受到了人们的关注。由于PAEs对整个生态系统具有潜伏性、广泛性和深远性的危害,世界各国都十分重视其污染问题。国内外有大量研究表明,PAEs具有致畸性、致癌性、致突变性及生殖毒性[2],并对人体有低浓度长期危害的特征。目前,邻苯二甲酸二丁酯(dibutyl phthalate, DBP)、邻苯二甲酸丁苄酯(benzyl butyl phthalate, BBP)、邻苯二甲酸二辛酯(dioctyl phthalate, DOP)等多种PAEs已被美国环保局(Environmental Protection Agency, EPA)和中国环境监测总站列为优先控制的污染物。
PAEs在塑料中主要通过氢键或范德华力与聚烯烃类分子进行连接,在环境中不易分解。目前在大气、湖泊、饮用水、土壤甚至室内环境中均可检测到PAEs的存在[3],同时,PAEs还可以通过食物链进入生物体内[4],对其造成严重危害。
PAEs已经成为我国环境中广泛存在的一类有机污染物,生物降解是其在环境中降解的主要途径[5]。DBP主要作为软化剂应用于聚氯乙烯(polyvinyl chloride, PVC)等合成材料中,是应用最广泛的PAEs化合物之一。其对环境污染的主要原因是人为造成的,任何来源的DBP均可通过食物链进入消化道,最终在人体内蓄积,从而对人体健康构成威胁[6]。国内外对DBP的生物降解进行了大量的研究,主要包括高效降解菌株的筛选和降解动力学研究以及酶促降解性和降解途径等方面。目前分离得到对DBP具有高效降解性能的菌株主要有红球菌(Rhodococcussp.)[7-8]、分枝杆菌(Mycobacteriumsp.)[9]、假单胞菌(Pseudomonassp.)[10]、戈登氏菌(Gordoniasp.)[11-12]、芽孢杆菌(Bacillussp.)[13]和皮氏伯克霍尔德氏菌(Burkholderia pickettii)[14]等,但我国对于PAEs污染物的微生物降解机制、降解基因以及降解酶的研究相对较少,且降解菌菌属相对集中,需要扩大PAEs的生物降解菌种资源库。目前,国内外学者对冢村菌(Tsukamurella)的研究相对较少,且关于冢村菌降解PAEs的研究未见报道。
本研究从土壤中筛选出一株能够把DBP高效降解的菌株SD2,采用16S rDNA序列分析及系统发育树构建将其鉴定为冢村菌,并分析在不同影响因子条件下菌株SD2的DBP降解特性,为冢村菌降解有机污染物的研究提供了参考。
1 材料与方法
1.1 试验材料及培养基
主要试剂:邻苯二甲酸二甲酯(dimethyl phthalate,DMP);邻苯二甲酸二乙酯(diethyl phthalate, DEP);DBP;DOP;甲醇(分析纯)和乙酸乙酯(分析纯)。
无机盐培养基 :K2HPO45.8 g/L,KH2PO44.5 g/L,(NH4)SO42.0 g/L,MgCl20.16 g/L,CaCl20.02 g/L,Na2MoO4·2H2O 2.4 mg/L,FeCl31.8 mg/L,MnCl2·2H2O 1.5 mg/L ;将pH值调至7,121℃高压灭菌20 min。PAEs固体培养基:在1 L无机盐培养基中加入20 g琼脂,121℃高压灭菌20 min[15]。
1.2 菌株筛选、形态观察及生理生化鉴定
称取 1 g 的样品于 100 mL 含 100 mg/L PAEs(DMP、DEP、DBP、DOP的质量浓度均为25 mg/L)的无机盐培养基中,采用梯度压力法驯化,在30℃下振荡培养7 d。随后逐步转接至质量浓度分别为200、300、400、500 mg/L的PAEs无机盐培养液中培养,每个质量浓度梯度下均驯化7 d左右。用接种环蘸取少量菌液,采用平板划线法在PAEs固体平板上进行划线分离纯化。选取长势良好的单菌落接种到PAEs固体平板上,重复此操作,直至得到纯的单菌落,并通过肉眼观察法对分离得到的单菌落的形态进行观察。生理生化鉴定参考文献[16]的方法进行。
1.3 细菌底物广谱性测试
在20 mL的无机盐培养基中分别加入200 mg/L DBP、200 mg/L DMP、200 mg/L DEP、200 mg/L DOP、200 mg/L邻苯二甲酸二(2-乙基)己酯[di-(2-ethylhcxyl) phthalate, DEHP]、200 mg/L 甲苯、200 mg/L邻苯二甲酸单丁酯(mono-n-butyl phthalate, MBP)、200 mg/L 原儿茶酸(protocatechuic acid, PCA)、200 mg/L 邻苯二甲酸二异辛酯(diisooctyl phthalate,DIOP)、200 mg/L邻苯二甲酸(phthalic acid, PA)作为菌株生长的唯一碳源,用高压蒸汽锅121℃下高压灭菌20 min。取1 mL菌液至无机盐培养基中,在温度为30℃、转速为150 r/min的摇床中震荡培养7 d,重复2次,观察菌株的生长情况。
1.4 细菌的16S rDNA的扩增和系统发育树的构建
用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和 1492R(5'-TACGGCTACCTTGTTACGACTT-3')扩增16S rDNA 片段[17]。50 μL 反应体系含有 10×PCR buffer 5.0 μL、10 mmol/L dNTP 1.0 μL、25 mmol/L MgCl24.0 μL、Taq 酶 0.5 μL、引物 27F 1.0 μL、引物l492R l.0 μL、DNA模板 4.0 μL,其余成分为 ddH2O。反应条件 :94℃预变性 5 min ;94℃变性30 s,60℃退火30 s,72℃延伸 90 s,共35个循环 ;72℃延伸10 min,4℃保存。取5.0 μL的反应液进行琼脂糖凝胶电泳。聚合酶链式反应(polymerase chain reaction, PCR)产物的测序工作由睿博兴科公司完成,并通过MEGA7.0软件中的邻接法(neighbor-joining)构建系统发育树。为了进一步确定该菌的分类地位,本研究将所得到的16S rRNA基因序列通过数据库EzBioCloud(https://www.ezbiocloud.net/)和细菌模式菌种进行了相似性比对[18]。
1.5 DBP的生物降解试验
取菌株于含有50 μL DBP的100 mL无机盐培养液中振荡培养7 d,离心(转速为10 000 r/min)5 min,用pH为7、浓度为0.02 mol/L的Na2HPO4·NaH2PO4缓冲液洗涤3次,收集菌体于锥形瓶中。吸取1 mL菌悬液,根据不同条件在含500 mg/L DBP的无机盐培养基中培养。
1.6 高效液相色谱分析法
1.6.1 样品处理
将培养后的培养基菌液摇匀,全部转移至50 mL无菌离心管中,加入10 mL乙酸乙酯,离心(转速为6 000 r/min)5 min ;收集有机相至烧杯中,用10 mL乙酸乙酯萃取水相1次,并再次收集有机相至烧杯中。在通风橱中挥发一晚后,用甲醇定容至10 mL,稀释至原浓度的1/5;用高效液相色谱仪测定DBP的残留量。
1.6.2 液相色谱条件
色谱柱为SinoChrom ODS-BP(4.6 mm×200 mm×5 μm),柱温为 35℃,V流动相甲醇∶V水=9∶l,流速为0.5 mL/min。检测器波长为228 nm,进样量为20 μL。
1.7 气相质谱分析
1.7.1 样品处理
将培养完的菌液转移至50 mL无菌离心管中,加入10 mL乙酸乙酯,离心(转速为6 000 r/min)5 min。收集有机相至烧杯中,用10 mL乙酸乙酯萃取水相1次,并再次收集有机相至烧杯中。在通风橱中挥发干后,用色谱纯的正己烷定容至10 mL,稀释至原浓度的1/5。
1.7.2 气相质谱条件
Thermo Trace DSQ Ⅱ色谱质谱联用仪条件 :1)初始温度为60℃,以 20℃/min升温至220℃并保留10 min,随后以5℃/min升温至300℃并保留5 min;2)离子源温度为230℃,全扫描方式进行;3)进样口温度为260℃,接口温度为280℃,流速为1.0 mL/min ;4)进样量为1 μL。
2 结果与分析
2.1 PAEs降解菌SD2的分离与分子生物学鉴定
通过肉眼观察法可观察到菌株SD2在平板上呈白色,菌落较大,表面呈不规则形状,粗糙,微隆起,不透明,短杆状,革兰氏阳性(图1),专性好氧气,无鞭毛。
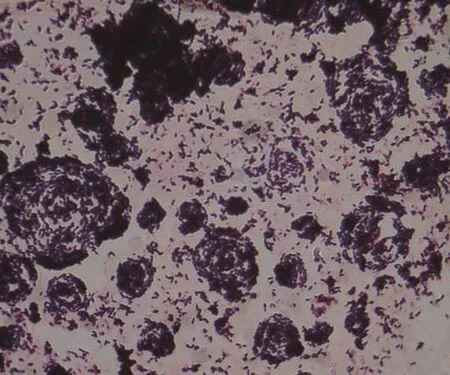
图1 菌株SD2的革兰氏染色结果(×100)Fig. 1 Gram staining result of strain SD2 (×100)
本文采用PCR扩增技术获得了菌株SD2的16S rDNA序列,测序的长度为1 378 bp。用MEGA 7软件中的Clustal W将其与GenBank中已知菌株的16S rRNA基因序列进行比较,然后用neighbor-joining构建系统发育树。结果表明,SD2与多种冢村菌的16S rRNA基因相似性高达99%(图2)。同时,在数据库EzBioCloud上的比对结果显示,和SD2最相似的前十二个有效发表模式菌株均为冢村菌,其中SD2和Tsukamurella tyrosinosolvensDSM 44234T相似度为100%,和Tsukamurella ocularisHKU63T相似度为99.85%,和其他属的相似度均低于96%。因此可以判定SD2属于冢村菌属。

图2 菌株SD2的16S rDNA序列分析与系统发育树的构建Fig. 2 16S rDNA sequence analysis and phylogenetic tree construction of strain SD2
2.2 底物广谱性试验
底物广谱性试验结果如表1所示。由表1可见,SD2可以利用常见的且在污染环境中含量较高的PAEs类化合物(如DMP、DEP、DBP等),但无法利用支链较长的PAEs(如DOP)。同时,SD2对主要的PAEs类化合物中的代谢产物(如PA、PCA)具有一定的利用能力。这预示着SD2具备将PAEs及其代谢产物完全降解的能力。

表1 PAEs降解菌株SD2的底物广谱性Tab. 1 Substrate utilization profile for strain SD2
2.3 培养条件对菌株降解DBP的影响
2.3.1 初始pH值对菌株降解DBP的影响
用0.1 mol/L的盐酸和0.1 mol/L的NaOH调整无机盐培养基的pH值分别至4、5、6、7、8、9、10,以DBP为唯一碳源,在温度为30℃、转速为150 r/min 的条件下振荡培养3 d。初始pH值对菌株降解DBP的影响如图3所示。
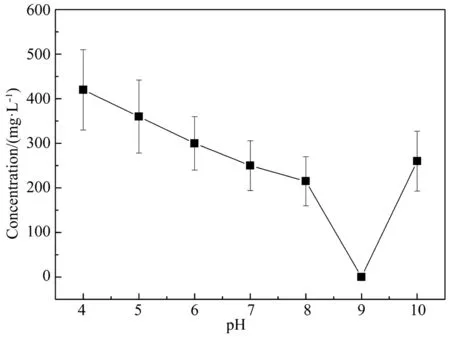
图3 初始pH值对菌株SD2降解DBP的影响Fig. 3 Effects of initial pH on DBP degradation by strain SD2
在pH值为4~8时,瓶中残留DBP的质量浓度呈缓慢下降趋势,菌株生长缓慢,其对DBP的降解作用受到抑制。在初始pH值为9时,DBP质量浓度为0,表示DBP已经完全被降解,菌株可以良好生长。在初始pH值为10时,菌株生长缓慢,其对DBP的降解作用受到抑制。酸碱度是影响微生物生长的重要因素之一,不同pH值可以影响酶的活性,从而影响菌株降解DBP的能力。由此可见,SD2降解DBP的最适pH值为9。该菌株在偏碱性条件下可以生长,且较适宜降解DBP,同时,初始pH值过低不利于菌株的生长以及DBP的降解。
2.3.2 初始温度对菌株降解DBP的影响
DBP为唯一碳源,在温度分别为25、30、35、40和45℃,pH值为7,转速为150 r/min的条件下振荡培养3 d,初始温度对菌株降解DBP的影响如图4所示。
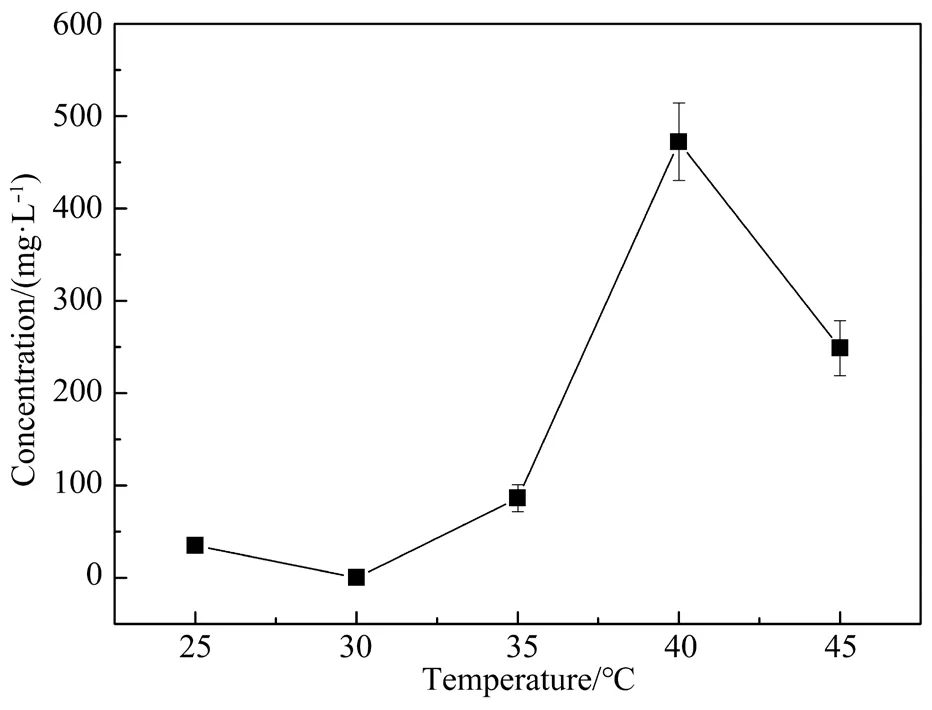
图4 初始温度对菌株SD2降解DBP的影响Fig. 4 Effect of initial temperature on DBP degradation by strain SD2
在25~35℃时,DBP已基本上被SD2完全降解,菌株可以良好生长,具有较高的降解能力。在30℃时,DBP的质量浓度为0,表示DBP已被完全降解。超过35℃时,菌株生长较慢。温度也是影响微生物生长的重要因素之一,不同的温度会影响酶的活性,从而影响微生物的生长与降解有机物的能力[19]。由此可见,该菌株适宜在30℃左右温度下生长,且降解DBP的能力较高。温度过高会抑制SD2的生长和DBP的降解。
2.3.3 转速对菌株降解DBP的影响
以DBP为唯一碳源,在温度为30℃,pH值为7,转速分别为0、75、150、225 r/min的条件下振荡培养3 d,转速对菌株降解DBP的影响如图5所示。
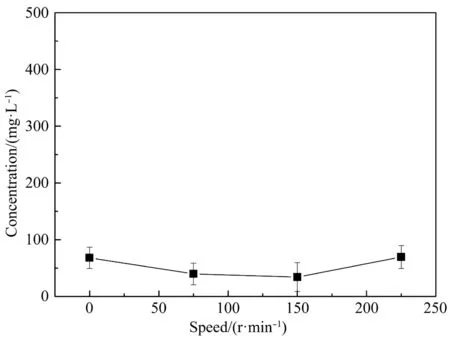
图5 转速对菌株SD2降解DBP的影响Fig. 5 Effect of rotation speed on DBP degradation by strain SD2
在静止时,SD2对DBP降解的能力较强,菌株可以正常生长。随着转速的增加,SD2在不同转速条件下对降解DBP的影响差别较小,DBP均可以被降解,在不同转速下菌株都能良好生长。与其他转速相比,最适宜降解DBP的转速为150 r/min。
2.3.4 培养时间对菌株降解DBP的影响
以DBP为唯一碳源,在温度为30℃、pH值为7、转速为150 r/min的条件下振荡培养3 d,分别于12、24、36、48、60、72 h时取样。培养时间对菌株降解DBP的影响如图6所示。
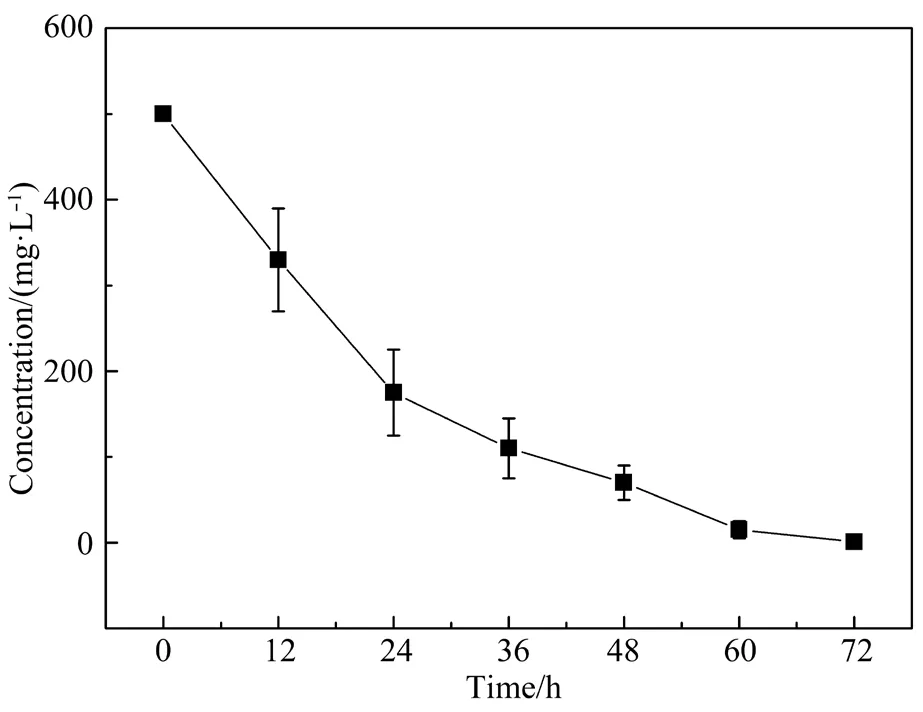
图6 培养时间对SD2降解DBP的影响Fig. 6 Effect of culture time on DBP degradation by strain SD2
在培养初期,菌株的生长及DBP的降解速度较快,SD2可以很快利用DBP提供的碳源。在72 h时,DBP可以被完全降解,充分说明SD2是一株高效降解菌。
2.4 代谢产物分析
通过气相质谱联用仪(gas chromatograph-mass spectrometer, GC-MS)检测DBP降解过程中的产物,并与气质联用的质谱数据库进行比对可知,在SD2降解DBP 12 h后,在保留时间(待测组分从进样到出现峰最大值所需的时间)为9.40 min和8.10 min时检测到了DBP和邻苯二甲酸丁基甲酯;SD2降解DBP 36 h后,在保留时间为5.69 min时检测到了PA。质谱图如图7所示。
经菌株SD2降解12 h后,可以检测到DBP的存在。经菌株SD2降解36 h后,可以检测到PA,通过降解试验,在降解36 h后,降解速度趋于平缓,可能是因为反应生成了中间产物邻苯二甲酸丁基甲酯和PA,而SD2对降解邻苯二甲酸丁基甲酯和PA的能力较弱,从而导致降解速度变慢。降解72 h后几乎没有检测到DBP及其中间产物,表明DBP已几乎被完全降解。
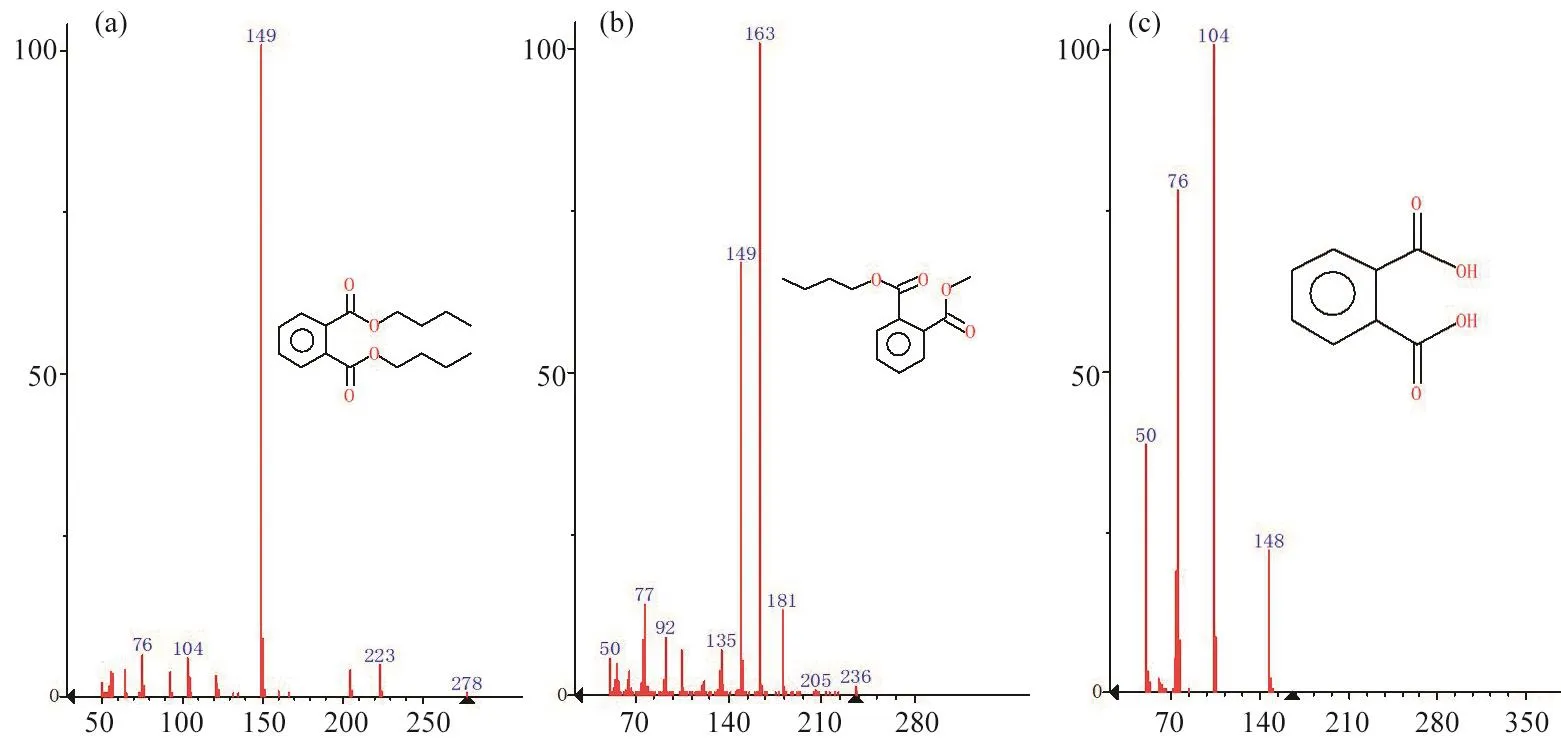
图7 邻苯二甲酸二丁酯及其代谢产物的质谱图Fig. 7 Mass spectrum of dibutyl phthalate and its metabolic product(a)邻苯二甲酸二丁酯的质谱图;(b)邻苯二甲酸丁基甲酯的质谱图;(c)PA的质谱图。(a) Mass spectrum of dibutyl phthalate; (b) Mass spectrum of butylmethyl phthalate; (c) Mass spectrum of phthalic acid.
研究表明,在好氧微生物的降解过程中,通过微生物酯酶将PAEs水解可生成邻苯二甲酸单酯,并将其再生为PA。而成功降解PA才是完成整个降解过程的一个至关重要的步骤[20]。结合底物广谱试验结果可知,该菌能继续利用PA以及后续的代谢产物PCA,基本可以推测该菌能够完全降解DBP。
3 讨论
冢村菌是一类需氧、不产芽孢、无动力的革兰氏阳性菌,主要分布于土壤、水以及活化淤泥的泡沫中[21]。虽然对于微生物可降解PAEs的研究很多,但是目前有关于冢村菌的生物降解研究的报告不多,仅有冢村菌降解十六烷和烷烃的研究报道[22-23]。本文第一次报道了该菌属能够降解PAEs污染物的研究。
本研究对冢村菌的降解特性及降解产物进行了分析。从农田土壤中筛选出一株能够以DBP为唯一碳源和能源生长的微生物SD2。经PCR扩增得到其16S rDNA并构建分子系统发育树,分析发现SD2与多种冢村菌的16S rRNA基因的相似性高达99%。因此,初步鉴定该菌株为冢村菌。通过底物广谱性试验发现,菌株SD2可以利用多种常见的PAEs类化合物,是一株能够广泛降解PAEs的菌株。本研究利用高效液相色谱(high performance liquid chromatography,HPLC)测定了SD2的降解性能,发现了SD2对DBP的最佳降解条件:温度为30℃,pH值为9,转速为150 r/min。在该最佳条件下,SD2在72 h内可以完全降解500 mg/L的DBP,表明该菌偏爱在偏碱性环境中生长,并具备较高的DBP降解能力。通过GC-MS分析可初步推断,SD2与DBP反应生成的中间产物为邻苯二甲酸丁基甲酯和PA。结合底物广谱试验可知,PA及PCA均能被SD2降解,预示SD2可以完全降解DBP,并将土壤中PAEs转化为CO2和H2O,同时不会产生二次污染。下一步将开展该菌种的降解机制研究,通过基因组和转录组测序,预测相关的降解基因并测定相关的酶活性质,为后续的应用开发提供基础。
总之,本研究所筛选的冢村菌的底物广谱性良好,降解速度快,在降解PAEs及其中间代谢产物中起到了重要作用,对环境污染的治理及修复具有一定的应用潜力,同时进一步扩大了PAEs生物降解菌资源,并为冢村菌降解有机污染物的研究提供了有利参考。

