细鳞鱼温和气单胞菌LAMP检测方法的建立
郭玉丹,杜迎春,何亚鹏,时晓,贾斌*
(1. 石河子大学动物科技学院,新疆 石河子 832003;2. 北京市水生野生动植物救护中心,北京 102100)
细鳞鱼(Brachymystaxlenok)属鲑形目(Salmoniformes)、鲑形科(Salmonidae)、鲑亚科 (Salmoninae)、细鳞鱼属(Brachymystax),是我国名贵的陆封型冷水鱼[1]。细鳞鱼又名小红鱼(新疆),细鳞子(东北),花鱼(山西),化鱼(河北),含脂率达3.8%~7%且无肌间刺,自宋朝时就作为贡品[2-3]。
近年来由于人类肆意滥捕滥捞、筑坝拦湖、截河漂流、旅游活动增加等人为因素导致细鳞鱼数量急剧下降[4-5]。为维持种群延续和水域生态系统的生物多样性,细鳞鱼的人工驯养日益重要。温和气单胞菌(Aeromonassobria)是多种淡、海水养殖鱼类的一种重要病原菌,是鱼类条件致病菌,如在水质不佳、水温上升等应激下,可引起水生动物大规模发病[6-11],常与嗜水气单胞菌混合感染[12],可导致鱼败血症、溃疡腐烂[13-14]。感染鱼离群独居、水体打转、摄食减少、鳍部出血,剖开鱼体大多呈现肝肾出血、腹部膨胀有积水,且人吃了该菌感染的鱼后会引发腹泻、败血病[15-16]。本试验从患病鱼体内分离得到1株菌,经过细菌鉴定确定为温和气单胞菌,在此基础上选择该菌高表达管家基因zipA作为目的基因设计筛选最佳引物,建立一种快速检测该菌的环介导恒温扩增技术(LAMP),为该菌检测提供工具。
1 材料与方法
1.1 材料
驯养车间患病细鳞鱼若干尾,用于细菌分离鉴定;试验所用中间气单胞菌(ATCC33907)、豚鼠气单孢菌(ATCC15468)、杀鲑气单胞菌(ATCC27013)为北京水生野生动植物救护中心实验室保存。
细菌微量生化鉴定管(北京陆桥技术股份有限公司),BstDNA链置换聚合酶及缓冲液Buffer(美国纽英伦生物技术),细菌基因组DNA提取试剂盒(天根生化科技(北京)有限公司出品),SYBER Green I核酸染料(北京百泰克生物技术有限公司),引物稀释液TE(Solarbio),电泳液(上海生工),2×ESTaqMaster Mix(康维世纪),琼脂粉(北京兰伯瑞生物技术有限公司)。
1.2 细菌分离
在无菌操作台下,取患病鱼肠积液涂布在固体LB培养基上划线,在28 ℃培养12~24 h。待长出菌落后,挑取优势菌落,放入LB培养基中摇菌后再次划线传代,纯培养,一部分用于基因组提取,一部分甘油保存于-80 ℃冰箱,另取单个菌落进行革兰染色。
1.3 细菌鉴定
1.3.1 常规鉴定
选用24项生化鉴定指标,采用菌悬液法,用接种针从平板上挑取单个菌落至无菌水中,仔细研磨至0.5麦氏浊度的均一菌悬液分别滴入所选的安瓿瓶中,每瓶3滴,置于28 ℃培养。
1.3.2 16S rRNA序列分析
16S rRNA通用引物 P1:5′-AGAGTTTGATCCTGGCTCAG-3′P2:5′-ACGGCTACCTTGTTACGATCT-3′进行常规PCR扩增。PCR反应体系为:无酶ddH2O水8.5 μL、模板2 μL、10 μmol/L引物各1.5 μL、2×EsTaqMasterMix(Dye)12.5 μL。PCR扩增程序:94 ℃预变性4 min; 94 ℃ 变性30 s,56 ℃ 退火 30 s,72 ℃ 延伸45 s,共 35 个循环;72 ℃ 延伸10 min。应用 DNAStar 等生物信息学软件进行序列同源性比对和系统进化分析。
1.4 LAMP引物设计
选温和气单胞菌zipA基因作为靶基因,利用在线引物设计软件Primer Explorer V4(http://primerexplorer.jp/e/)设计完成(表1)。共设计好5套引物,设计好的引物提交华大公司进行合成。其中F3 和B3为外引物,FIP和BIP为内引物,LF和LB为环引物。

表1 温和气单胞菌LAMP引物序列
1.5 LAMP反应体系的优化
对内外引物浓度比例、dNTPs体积、Mg2+体积、反应温度和扩增时间进行优化。引物比例的优化:内外引物的比例为1∶1、2∶1、3∶1、4∶1、 5∶1 、 6∶1 、7∶1 、 8∶1 ;MgSO4体积的优化:所加的MgSO4量为0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5 μL;dNTPs的优化:所加的dNTPs量为0.5、1.5、2.0、2.5、3.0、3.5 μL;温度的优化:扩增温度为61.5 ℃、62.5 ℃、63.5 ℃、64.5 ℃、65.5 ℃。LAMP反应条件和体系都在前一步优化的基础上进行反应,恒温水浴锅孵育,用2%的琼脂糖凝胶电泳检测,观察电泳是否有良好的梯形条带,结合反应液浑浊度和颜色反应来确定最佳条件和体系。
1.6 LAMP 特异性试验
按照上述1.5优化的LAMP反应条件和体系,首先试剂盒提取中间气单胞菌ATCC33907、豚鼠气单孢菌ATCC15468、杀鲑气单胞菌ATCC27013的DNA作为模板,检测LAMP引物的特异性,设置ddH2O为模板空白对照,产物用2%琼脂糖凝胶电泳检测。
1.7 LAMP 灵敏度分析
以10倍稀释法倍比稀释DNA模板进行LAMP灵敏性试验。
2 结果与分析
2.1 细菌分离
患病鱼体内分离得到1株菌株,命名为AS,革兰染色反应为红色杆菌,两端钝圆。在麦康凯和普通LB培养基上均生长良好。
2.2 细菌鉴定
生理生化特性分析结果见表2,菌株AS的特性与温和气单胞菌一致。图1显示使用16S rRNA引物扩增出1 500 bp左右条带,应用MegAlign 和MEGA6等软件对进行序列比对和系统进化分析,分离菌AS的16S rRNA基因序列与温和气单胞菌JCM2139相应序列(NR112837.1)同源性达 100%,且与温和气单胞菌菌株208和菌珠JCM2139位于同一进化分枝(图2)。综合如上鉴定结果,确定本次分离菌为温和气单胞菌。

表2 分离菌株的生化结果

M. DL2000 DNA Marker; 1. 空白对照;2. 菌株AS图1 分离菌 16S rRNA基因PCR扩增结果

注:●为本试验分离菌株图2 分离菌株与参考菌株16S rRNA基因的系统发育树
2.3 LAMP引物的筛选
LAMP扩增后,首先用肉眼观察浑浊沉淀,发现反应管2和3中均有浑浊,其余管中无浑浊(图3A);添加1 μL SYBER Green I核酸染料,反应管2和3颜色由橙色变为黄绿色,其余管不变色(图3B)。经过琼脂糖凝胶电泳后,尽管第2套引物有浑浊也有颜色反应,但条带不是很清晰(见图3C)。综合三项的结果选择第1套引物1ZF3~1ZLF。
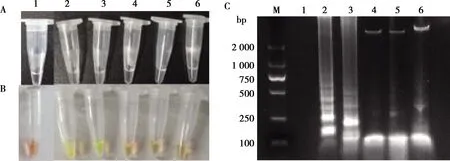
A:浊度;B:加入SYBER Green I核酸染料颜色变化;C:琼脂糖凝胶电泳M. DL2000 DNA Marker;1.空白对照;2.第1套引物(1ZF3~1ZLF);3.第2套引物(2ZF3~2ZLB);4.第3套引物(3ZF3~3ZLB);5.第4套引物(4ZF3~4ZLF);6.第5套引物(2ZF3~2ZBIP)图3 LAMP扩增引物筛选
2.4 LAMP反应体系的优化
对内外引物浓度比例、dNTPs体积、Mg2+体积、反应温度和扩增时间进行优化,确定最佳扩增温度是:63.5 ℃,最佳体系内外引物比例3∶1,dNTPs体积为3.5 μL,Mg2+体积2 μL。
2.5 LAMP特异性试验
温和气单胞菌DNA反应结果为阳性,肉眼观察反应物呈黄绿色,杀鲑气单胞菌等对照菌株反应物呈橙色(染料本身的颜色)且无条带,反应为阴性,说明LAMP方法的特异性良好(见图4)。
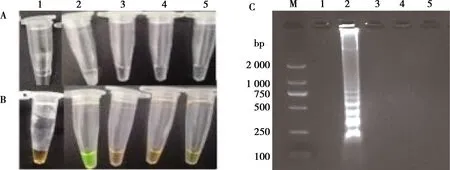
A:浊度;B:加入SYBER Green I核酸染料颜色变化;C:琼脂糖凝胶电泳M. DL2000 DNA Marker;1.无菌水;2. 温和气单胞菌AS;3. 杀鲑气单胞菌ATCC27013;4. 豚鼠气单胞菌ATCC15468;5. 中间气单胞菌ATCC33907图4 温和气单胞菌基因组LAMP方法的特异性
2.6 LAMP灵敏性试验
用分光光度计测得温和气单胞菌DNA的浓度为166.3 ng/μL,对DNA进行10倍倍比稀释后,分别用10-13至10-2倍DNA为模板,进行LAMP反应,可以看到在1.663×10-9ng/μL时梯形条带足够清晰(见图5),确定最低检出浓度是1.663×10-9ng/μL。
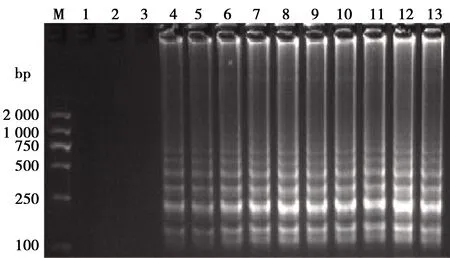
M. DL2000 DNA Marker;1.空白对照;2~13.10-13~10-2连续10倍倍比稀释的核酸图5 LAMP方法检测核酸的灵敏度
3 讨论
温和气单胞菌在水生生态系统中无处不在,存在于污水、地表水、动物和人类粪便、食品、健康或患病鱼中,能够引起鱼类和人类感染[17-18]。目前,检测菌种的方法有鉴别培养基、聚合酶链反应-单链构象多态性(PCR-SSCP)方法等[19-21],这些检测方法所需时间至少2 d;在食品检测中,该菌还未列入常规的致病菌检测范围,实验室的分离鉴定还没有国家标准[22]。LAMP是2000年由日本学者Notomi发明的一种扩增DNA的检测技术,可在1 h之内通过链置换得到109倍的基因[23],缩短了反应时间。2018年张新艳[24]根据温和气单胞菌、嗜水气单胞菌的上游序列不同,设计出可扩增该上游特异性片段的引物,将温和气单胞菌与其他的近似菌种分开,结果证明建立的检测方法灵敏度高,特异性好。
本试验筛选zipA基因设计特异性LAMP引物。zipA基因作为气单胞菌属细菌的管家基因,主要呈现分裂细菌的功能,该基因特定编码序列和内含子未翻译区较短,短基因重复序列数高于长基因重复序列数,具有在任何细胞表达不受影响和连续被转录的功能。表达均数是1 200,是其他基因的8倍,保守性高、表达量高,在做系统发育树时,可用来弥补16S rRNA基因的信息量少局限性,能更好地区分属内物种[25]。依靠BstDNA 聚合酶作反应的动力,结果采用肉眼观察浑浊度、颜色变化、梯形条带这3种判断方式互相印证,具有较高可信度,建立的该方法在实验室保存的几种细菌间具有良好特异性。LAMP检测技术在引物筛选、优化方式和结果判定上已有深入的研究[26-27],与实时荧光定量 PCR 方法[28]相比,克服了重复的热变性并缩短了反应时间。
综上,本试验分离鉴定了细鳞鱼温和气单胞菌,在此基础建立了环介导恒温扩增快速检测方法,为细鳞鱼温和气单胞菌感染的诊断提供了参考。

