2019年上海地区H9N2禽流感病毒分子特征及演化分析
葛杰,徐志远,李鑫,刘健,杨德全,鞠厚斌,葛菲菲*
(1. 上海市动物疫病预防控制中心,上海 201103;2. 扬州大学生物科学与技术学院,江苏 扬州 225009)
禽流感病毒(avian influenza virus,AIV)H9亚型在全球野生鸟类中传播,并且在亚洲、中东和非洲国家的许多家禽中呈地方流行[1-2]。尽管它们是低致病性禽流感病毒(LPAIV),受感染的鸡会有轻微的呼吸道疾病,死亡率一般低于20%[3-4],但仍然令农业和卫生部门担忧。H9亚型流感会影响肉鸡体重、蛋鸡的产蛋量和育种鸡的质量[5-6]。另外,受感染的家禽更容易继发感染[7],群体死亡率最高能达到65%[8]。
家禽中的H9禽流感病毒会对人类构成人畜共患病风险。自从1998年第1次正式报告人感染H9N2,孟加拉国、中国、埃及、巴基斯坦和阿曼共有59例人的病例[9]。人感染一般无症状或表现为轻度呼吸道疾病,只有1例相关死亡报告,可能是由于共感染导致[10]。在人群中检测到的所有H9N2病毒与同期的家禽病毒基因上是相似的[9]。H9禽流感病毒通常通过重组,将内部基因组片段供应给非H9病毒,产生可能对畜牧业和人类健康构成威胁的禽流感基因型[11]。2013年以来在中国发现的最普遍的AIV是H9基因型[1,11]。本研究对上海市某活禽市场2019年11月分离到的4株H9N2亚型AIV进行全基因进化分析,以期为了解上海地区H9N2 AIV 流行情况及其防控和疫苗选择提供依据和参考。
1 材料与方法
1.1 病毒株
4株H9N2亚型AIV毒株由本实验室参照文献[12]分离保存,其详细背景见表1。

表1 4株H9N2禽流感病毒毒株的信息
1.2 SPF鸡胚及主要试剂
SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。H9荧光RT-PCR试剂盒由深圳匹基提供。新城疫阳性血清、禽流感血凝素分型血清(H5、H9)由哈尔滨兽医研究所提供。AMV反转录酶等试剂均购自宝生物(大连)工程公司;特异引物由宝生物(大连)工程公司合成。
1.3 8个基因的扩增及序列分析
按照文献[13]的方法进行病毒RNA的提取和8个基因的全长扩增,测序由上海桑尼生物科技有限公司完成。参照GenBank中相关参考毒株, 用 MEGA3.1构建邻近树,自展值设为1 000次,自展值≥60%显示在主要的节点上,本研究中的4株病毒用实心三角标记。
1.4 序列分析比较
采用DNAStar软件包(Madison, WI, USA)的EditSeq和MegAlign,对增加病毒适应性的分子特征进行分析以及抗原位点相关的氨基酸变化进行比较。
2 结果
2.1 全基因组同源性分析
4株病毒全基因节段的NCBI登录号为MN918119~918150。分离株HA基因ORF全长为1 683 bp,编码560个氨基酸,核苷酸同源性为91.8%~99.9%,氨基酸序列同源性为93.6%~99.8%。分离株的HA基因与A/Duck/Y280/1997的HA基因核苷酸同源性为88.5%~89.0%,氨基酸同源性为89.3%~92.0%。分离株NA基因ORF全长为1 401 bp,编码466个氨基酸,核苷酸同源性为97.4%~98.9%,氨基酸序列同源性为97.2%~98.9%。4株病毒内部基因M、NP、NS、PA、PB1和PB2核苷酸同源性分别为98.7%~99.5%, 93.1%~94.1%, 98.8%~99.8%,95.7%~96.2%,97.8%~98.4%和96.7%~96.8%。
2.2 8个基因遗传演化分析
利用Mega3.1软件对分离毒株和参考毒株8个基因的遗传演化关系进行分析,绘制遗传演化树(图1至图8)。结果显示,所有分离株均为Y280系。根据绘制的8个基因节段的遗传演化树进行分析,4株分离株重组模式完全相同,均为四重重组体,由Y280亚系、Unknown、G1以及F98重组而成,根据已发表的文献[14],这4株病毒均属于G57基因型。
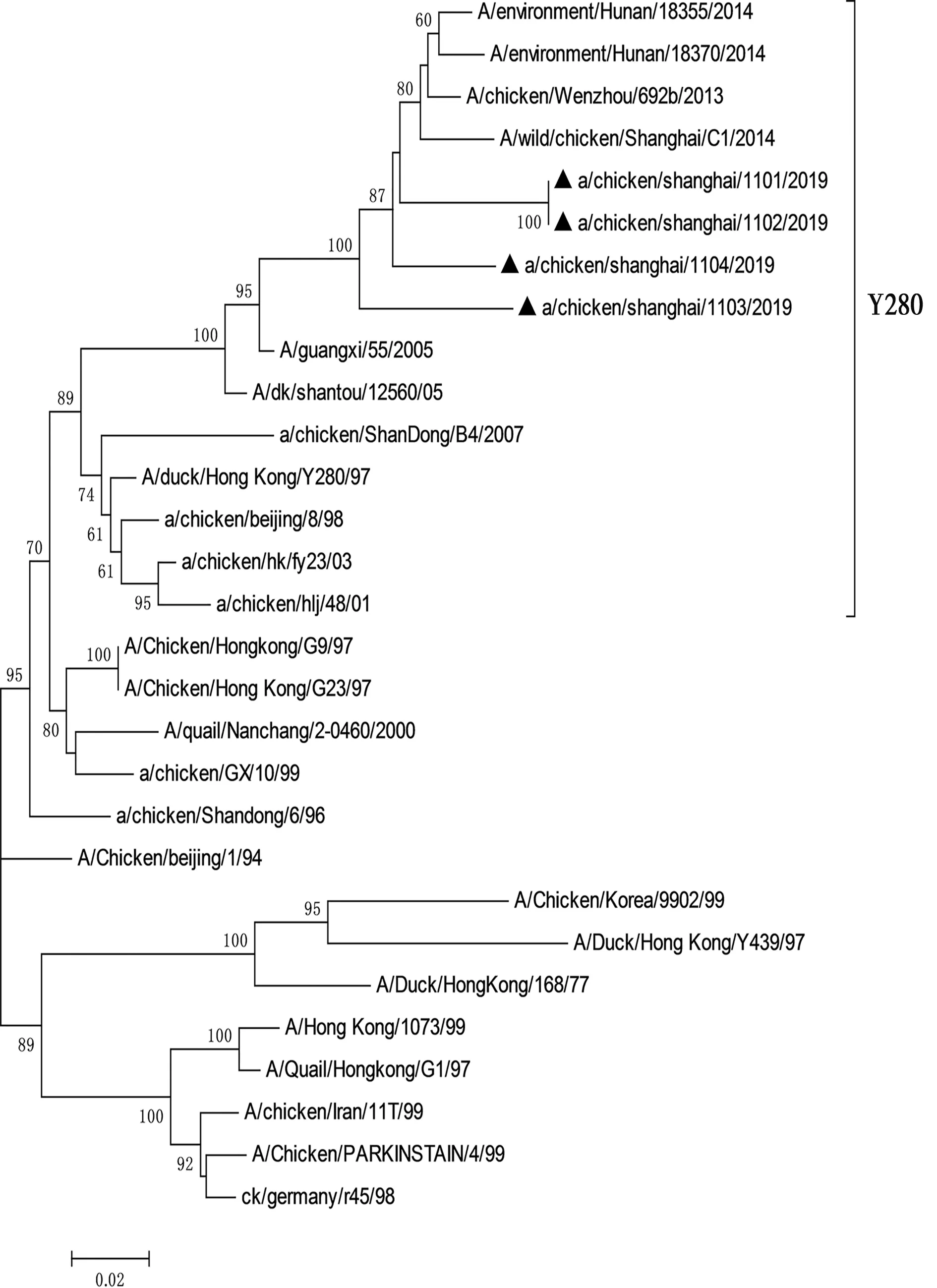
图1 4株H9N2亚型禽流感病毒HA基因节段的基因进化树
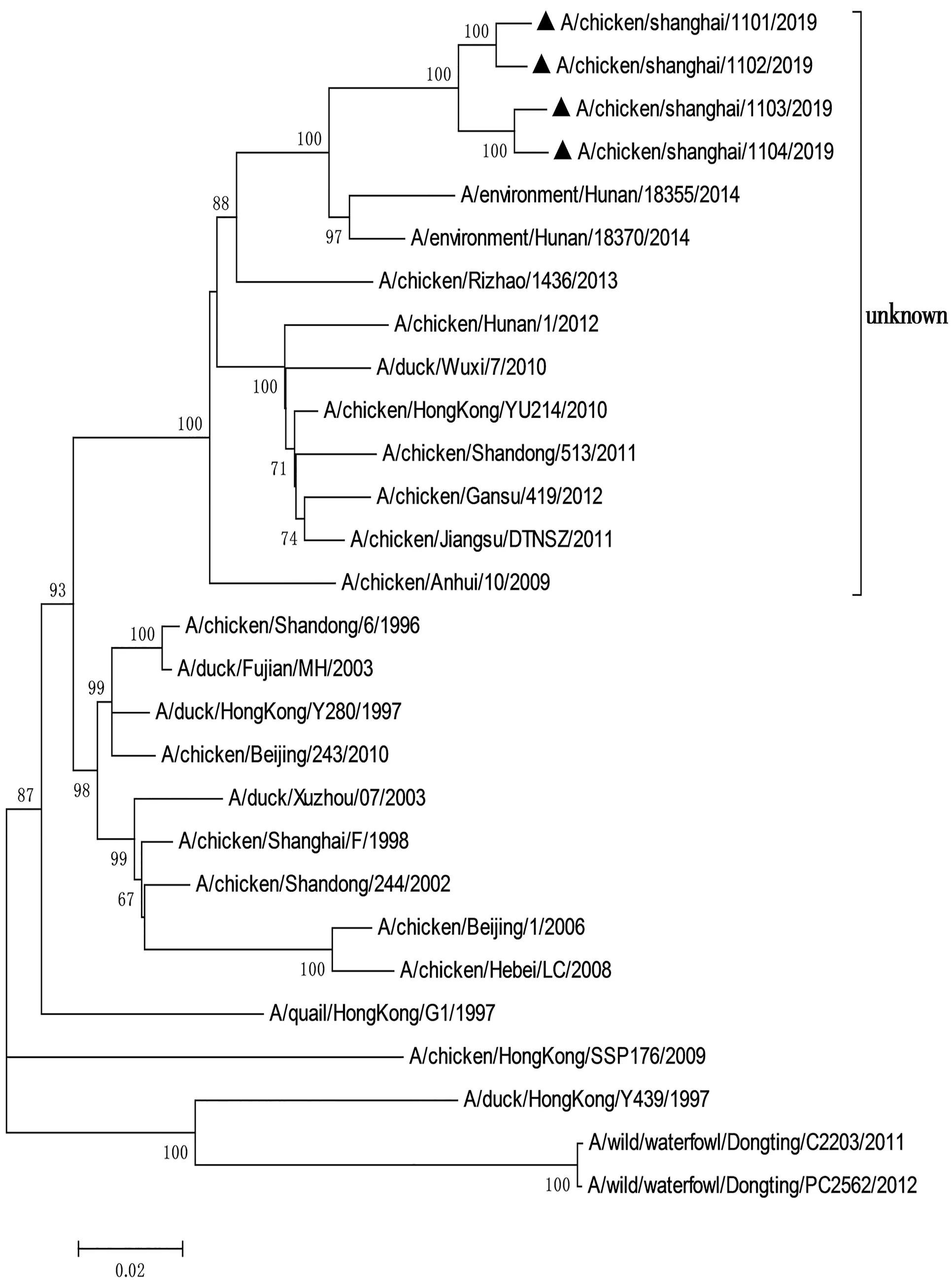
图2 4株H9N2亚型禽流感病毒NA基因节段的基因进化树
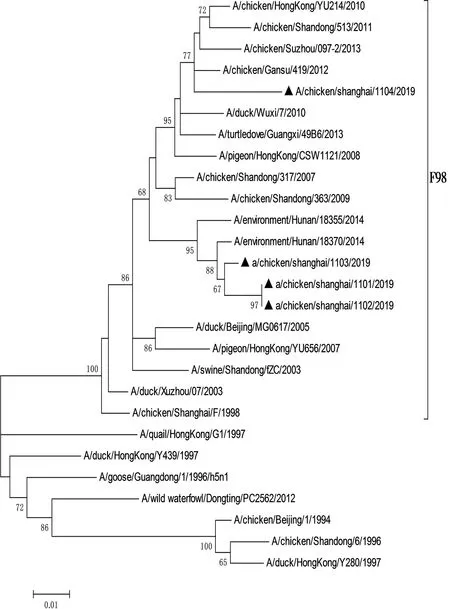
图3 4株H9N2亚型禽流感病毒NP基因节段的基因进化树

图4 4株H9N2亚型禽流感病毒PA基因节段的基因进化树

图5 4株H9N2亚型禽流感病毒M基因节段的基因进化树

图6 4株H9N2亚型禽流感病毒NS基因节段的基因进化树

图7 4株H9N2亚型禽流感病毒PB1基因节段的基因进化树
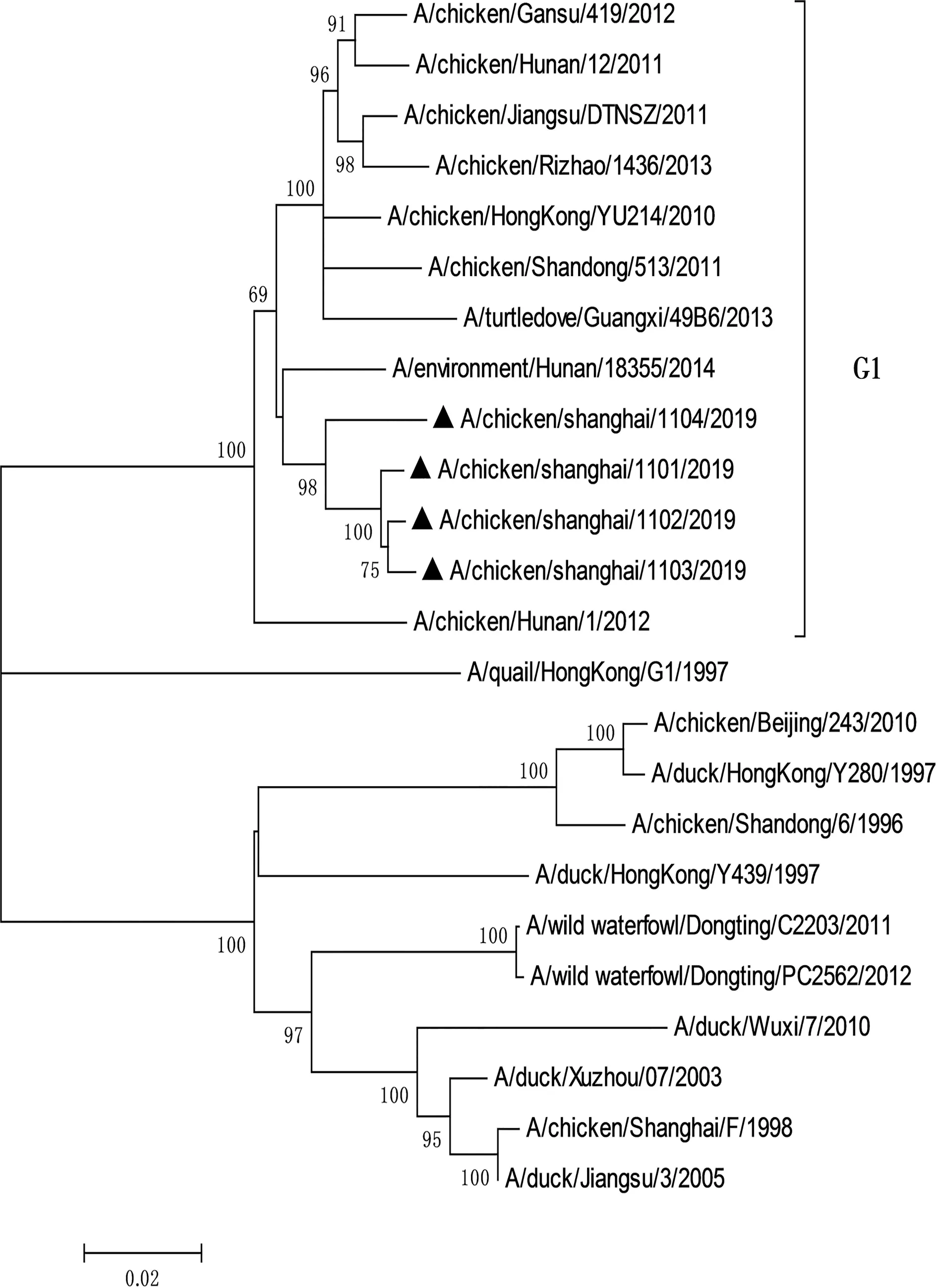
图8 4株H9N2亚型禽流感病毒PB2基因节段的基因进化树
2.3 4株H9N2禽流感病毒适应性增强的分子特征分析
表2显示了已知的影响禽流感病毒致病性的氨基酸突变,这4个毒株的HA裂解位点均为PSRSSR/GLF。这4株HA基因含有3个共同的氨基酸突变和1个只有A/Chicken/ Shanghai/1103/2019发生的突变,3个共同的突变分别为:155位为T,248位为D以及226位为L,A/Chicken/ Shanghai/1103/2019毒株在158位突变为N;这4株病毒分别为 PB2基因上588位为V,在PB1-F2缩短为90 aa以及622位突变为G;PA基因的63位和356位突变为I和R,均为全长PA-X;NP基因上105位氨基酸突变为V;M1基因上43位氨基酸突变为M;M2的31位突变为N;在NS1的42位突变为S,在NS1的149位突变为A。

表2 4株H9N2流感病毒基因上与增强病毒适应性相关的氨基酸突变
2.4 H9N2流感病毒与目前使用的疫苗株同源性比较
根据已报道的33个抗原位点[15],这4株病毒与2株疫苗株(A/Chicken/Shandong/6/96和A/Chicken/Shanghai/F/98)最多有18个抗原位点的差异(表3)。这4株病毒和目前国内使用的疫苗A/chicken/Shandong/6/96 (6/96)和A/chicken/Shanghai/F/98 (F/98)核苷酸和氨基酸同源性分别为88.4%~89.1%和88.9%~92.0%。

表3 4株H9N2流感病毒与2株疫苗株HA上抗原位点比较
3 讨论
近年来发现,H9N2亚型AIV是可以感染人的新型H7N9亚型AIV内部基因的供体,这一发现使得H9N2亚型AIV 成为公共安全的潜在威胁。因此,探究病毒演化过程中基因的变化对掌握病毒流行规律具有重要意义。目前国内流行的H9N2亚型AIV的HA、NA虽然以CK/Bei-like分支基因型为主,但其内部基因经常被其他分支的基因节段所取代,出现越来越多的重组基因型。Pu等[11]研究表明,G57在2007年出现,其流行率在2009年剧增,并自2010年后在中国占主导地位。本研究分离的4株H9N2亚型AIV均属于G57。G57在鸡群中适应性增强部分是由于获得了G1系的M和PB2基因,这些基因增加了禽流感病毒的聚合酶活性、复制能力以及毒力[15]。分子分析表明这4株病毒含有多个适应哺乳动物的氨基酸位点,这4株病毒均含有Q226L的突变,从而明显增加H9流感病毒与人Sia-α-2,6-唾液酸受体的结合,增强禽流感病毒在豚鼠间的传播[15]。H9N2流感病毒的6个内部基因也存在一些突变,导致在哺乳动物中复制能力和毒力增强,虽然PB2基因上并未发现流感病毒适应哺乳动物的2个位点E627K和D701N,但是4个毒株均含有A588V,该位点能增强哺乳动物和禽细胞系上H7N9和H9N2聚合酶活性和复制能力,从而增强AIV在哺乳动物上的毒力。自从2013年以来,全球范围内携有A588V的H9N2以及H7N9病毒已经明显增加[15]。禽群的免疫以及生物安全程序能有效减少AIV的传播,从而减少了人群暴露感染的风险。目前我国使用的2种疫苗株A/chicken/Shandong/6/96(6/96)和A/chicken/Shanghai/F/98(F/98)均为90年代的毒株,由于抗原漂移,H9亚型禽流感疫苗的有效性持续降低。本试验中的4株病毒与上述2种疫苗株最多有18个抗原位点差异,这种变异与疫苗有效性的降低是否有关还需进一步评估。总之,H9N2流感病毒在上海市活禽市场的持续流行提示,应进一步加强流感病毒的监测和预警。

