利用优化DNA质粒制备大鼠CD138单克隆抗体
罗芳芳,钱峰,梅芹
(1.上海药明生物技术有限公司,上海 200131;2.复旦大学 生命科学学院,上海 200438)
DNA免疫于1990年由Wolff等人首次发现,将编码蛋白的DNA质粒注射入小鼠骨骼肌内[1],在肌肉细胞内表达基因产物蛋白质,从而奠定了DNA免疫的基础。通过DNA免疫技术,目的基因在体内合成蛋白质抗原,刺激机体产生特异性免疫反应[2],获得高亲和力抗体。因此DNA免疫技术应用范围从疫苗研究、医学免疫学研究扩展至单克隆抗体药物研发。
虽然DNA免疫有多方面的优势,但免疫原性弱,免疫周期较长,因此提高其免疫原性是制备杂交瘤单克隆抗体的关键因素。
本研究选择大鼠CD138作为测试蛋白,在血液细胞中,CD138分子是浆细胞表面特异性标志[3-4]。传统杂交瘤单克隆抗体是由淋巴、脾脏细胞与骨髓瘤细胞融合产生的,但淋巴、脾脏细胞成分复杂、细胞量大,而浆细胞含量仅占1%~5%[5],所以特异性CD138抗体对评估淋巴和脾脏细胞中浆细胞含量特别重要。但尚无市售的抗大鼠CD138特异性单克隆抗体,而CD138大小鼠种属同源性高达90.4%,免疫原性低、动物免疫反应较弱。
DNA免疫效果是由质粒本身、抗原基因、分子佐剂、递送方式等因素相互作用所决定。本研究通过对DNA质粒转录后调控元件和分子佐剂进行优化增强DNA免疫反应。通过将luciferase和大鼠CD138基 因 克 隆 入 pCAGGS-HPRE、pCAGGS-WPRE、pCAGGS-HTLV-1R和pCAGGS-FliC载体,构建重组质粒。通过细胞瞬时转染表达系统、小鼠动物模型对目的基因体外表达水平、抗原特异性免疫反应进行系统比较。
鼠伤寒沙门菌鞭毛蛋白作为一种新型免疫佐剂,其佐剂效应受到科学家的广泛关注。目前,关于FliC佐剂研究主要是通过细菌表达鞭毛蛋白。本研究将鼠沙门菌鞭毛蛋白克隆入pCAGGS表达载体进行抗原融合表达,利用鞭毛蛋白的佐剂效应增强DNA免疫原性,从而诱导更强的特异性免疫反应。
1 材料与方法
1.1 材料
实验动物:BALB/C小鼠购于北京维通利华实验动物技术有限公司。
质粒:pCAGGS、pNL3.2.NF-κB-RE[NlucP]由本实验室保存。
分子实验试剂:PrimeSTAR Max Premix(2x) DNA聚合酶和DNA分子量Marker购于Takara Bio公司;限制性内切酶购于赛默飞世尔科技(中国)有限公司。T4 DNA连接酶购于新英格兰生物实验室(英国)有限公司;重组克隆试剂盒购于南京诺唯赞生物科技股份有限公司;琼脂糖购于美国英杰生命技术有限公司;DNA回收试剂盒、质粒中抽和大抽试剂盒购于德国Macherey Nagel公司;无内毒素质粒小提中量试剂盒购于天根生化科技(北京)有限公司。
菌株和细胞系:F-TOP10感受态细胞购于上海唯地生物技术有限公司;293F细胞由本实验室保存。
一抗和二抗:小鼠抗大鼠CD138血清由本实验室制备并保存,兔抗大鼠CD138多克隆抗体购于北京义翘神州科技股份有限公司。HRP标记羊抗小鼠IgG二抗购于BD公司,PE标记羊抗兔IgG购于艾博抗(上海)贸易有限公司,Alexae647标记羊抗小鼠IgG购于Bethyl Laboratories。
1.2 目的基因扩增
1.2.1 Luciferase和大鼠CD138基因PCR扩增
以 pNL3.2.NF-κB-RE[NlucP]质 粒 为 模 板,luc-F、luc-R为引物,PCR扩增出luciferase基因片段。以合成的大鼠CD138基因为模板,CD138-F、CD138-R为引物,PCR扩增出大鼠CD138基因片段。
1.2.2 4个元件PCR扩增
以合成的基因为模板,利用各自引物分别PCR扩增出WPER、HPRE、HTLV-1R & FliC DNA片段。
1.3 载体的构建及鉴定
1.3.1 各元件载体构建及鉴定
用XhoⅠ、NheⅠ酶切WPRE和HPRE PCR扩增片段、用EcolRⅠ、NotⅠ酶切HTLV-1R PCR扩增片段、用XhoⅠ、BglⅡ酶切FliC PCR扩增片段,分别克隆入pCAGGS质粒中。将转化菌种送到铂尚生物技术(上海)有限公司测序验证,并酶切验证。
五是做好流域水功能区纳污红线考核支撑。从2014年开始,国家对重要水功能区进行考核。长江流域水资源保护局负责组织流域水功能区考核的技术工作,组织制定流域水功能区水质达标评价技术细则,每年与地方协调制定年度水功能区考核名录和监测方案,并对各省区监测的水功能区评价结果进行复核,形成复核报告上报水利部。在最严格水资源管理制度考核中,长江流域水资源保护局也按照国务院考核组的统一部署,参与部分省区的考核,并提供长江流域的水功能区考核基础信息,有力的支撑了流域水功能区纳污红线考核工作[7]。
1.3.2 大鼠CD138和Luciferase表达载体构建及鉴定
大鼠CD138和Luciferase DNA片段通过PCR扩增,两端分别引入NotⅠ和XhoⅠ酶切位点。酶切后将其克隆入pCAGGS、pCAGGS-WPRE、pCAGGSHPRE、pCAGGS-HTLV-1R和pCAGGS-FliC,构建重组质粒 pCD138、pWCD138、pHCD138、pHTCD138、pFCD138、pluc、pWluc、pHluc、pHTluc。将转化菌种送到铂尚生物技术(上海)有限公司测序验证,并用NotⅠ和XhoⅠ分别酶切验证重组质粒。
1.4 Luciferase和大鼠CD138基因瞬转表达检测
用Lipofectamine2000转染试剂对pCD138、pWCD138、pHCD138、pHTCD138、pFCD138、pluc、pWluc、pHluc、pHTluc质粒进行细胞瞬时转染表达,设置2个重复孔,未转染293F细胞为阴性对照。在37 ℃、5% CO2和200 r/min振荡速度条件下培养转染细胞,48 h后检测大鼠CD138和luciferase表达水平。
1.5 BALB/C小鼠DNA免疫
用 3个 DNA质 粒(pCD138、pHCD138、pFCD138)分别免疫BALB/C小鼠,其中pCD138为对照组,pHCD138和pFCD138为实验组,每组4只小鼠。免疫剂量:200 μg/只,免疫途径:肌肉和皮下注射,每两周免疫一次。
1.6 抗大鼠CD138抗体血清效价检测
用0.5 μg/mL大鼠CD138蛋白包被酶标板,4 ℃过夜。PBST洗涤1次,2%BSA孵育2 h,PBST洗涤3次。小鼠血清以1∶100为起始浓度进行3倍稀释,共11个稀释度。将稀释小鼠血清加入ELISA酶标板中,室温孵育1 h。PBST洗涤3次,加入HPR标记羊抗小鼠抗体,室温孵育1 h。TMB显色10 min,HCl终止反应。酶标仪测定OD450值。
1.7 抗大鼠CD138杂交瘤单克隆抗体制备与筛选
从pFCD138质粒组和对照组中分别选取一只高抗体效价BALB/C小鼠,用于杂交瘤单克隆抗体制备。按照标准的细胞电融合操作程序处理淋巴细胞,并与骨髓瘤细胞进行电融合。在HAT筛选培养基中培养融合杂交瘤细胞,在37 ℃和5% CO2下进行定期监测。培养7~10 d后,用ELISA和FACS方法鉴定阳性杂交瘤细胞。经亚克隆后,筛选出能够稳定分泌抗体的杂交瘤单克隆细胞。培养7~10 d,收获细胞上清液,用Protein A进行抗体亲和力纯化,并评估抗体特异性。
1.8 抗大鼠CD138单克隆抗体特异性检测
抗大鼠CD138抗体以10 μg/mL为起始浓度进行5倍稀释,共12个稀释度,用抗大鼠CD138抗体血清效价相同的方法进行ELISA检测。
2 结果与分析
2.1 目的基因和各元件的PCR扩增
以质粒pNL3.2.NF-κB-RE[NlucP]为模板,PCR扩增出luciferase基因,获得639 bp DNA片段(图1)。以合成的大鼠CD138基因为模板,PCR扩增出大鼠CD138基因,获得942 bp片段(图2)。
以合成的基因为模板,PCR方法扩增WPRE、HPRE、HTLV-1R、FliC基因,分别得到598 bp、542 bp、227 bp、1 485 bp DNA片段(图3)。
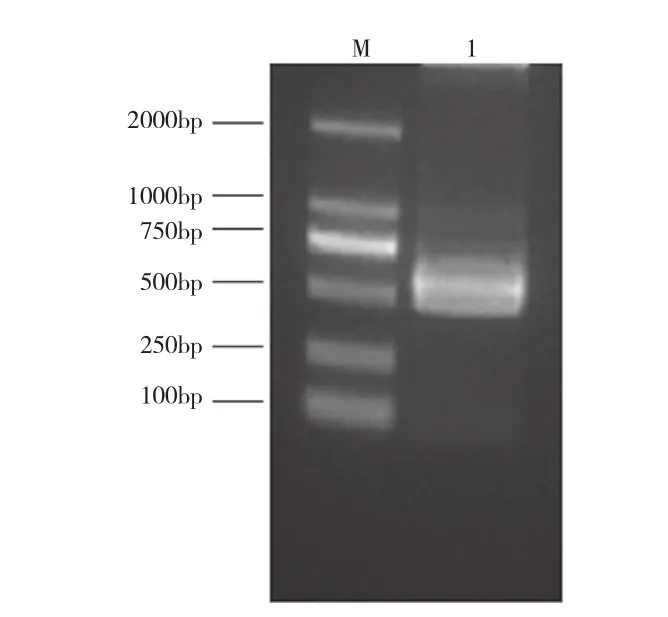
图1 Luciferase PCR扩增
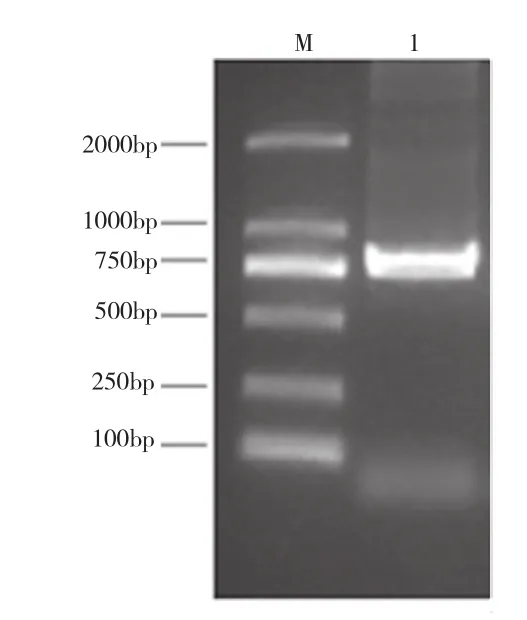
图2 Rat CD138 PCR扩增
2.2 质粒载体酶切验证
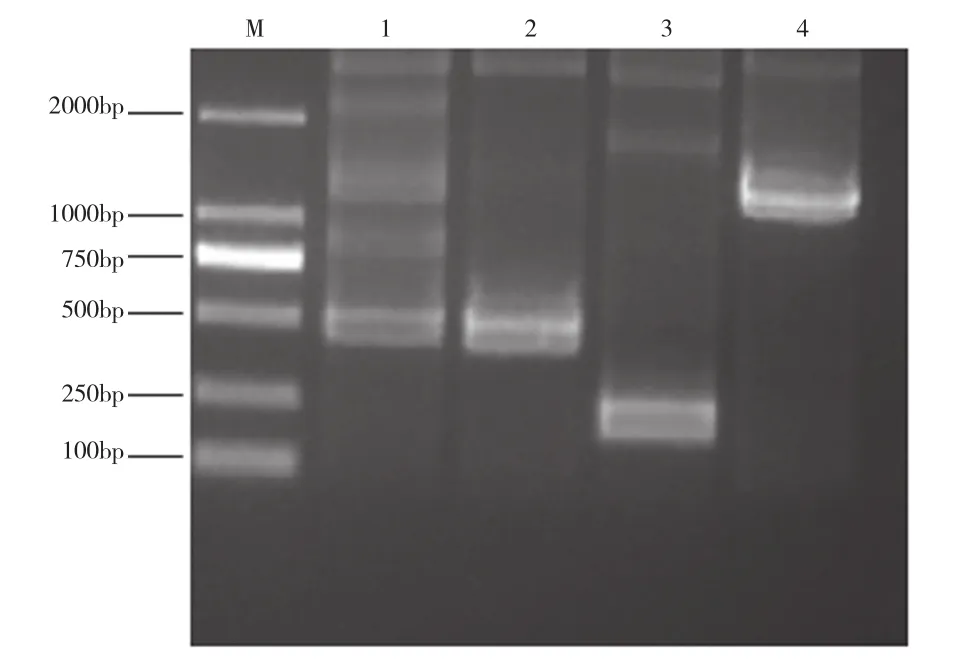
图3 各个元件扩增
Luciferase和大鼠CD138基因片段分别为663 bp和 942 bp,pCD138、pWCD138、pHCD138、pHTCD138、pFCD138、pluc、pWluc、pHluc、pHTluc、pFluc重组表达质粒分别经NotⅠ、XhoⅠ酶切验证(图4)和测序验证均完全正确。
WPRE、HPRE、HTLV-1R和Flic基因片段分别为598 bp、574 bp、227 bp和1 485 bp,构建的重组质粒经XhoⅠ和NheⅠ酶切验证和测序验证均完全正确。
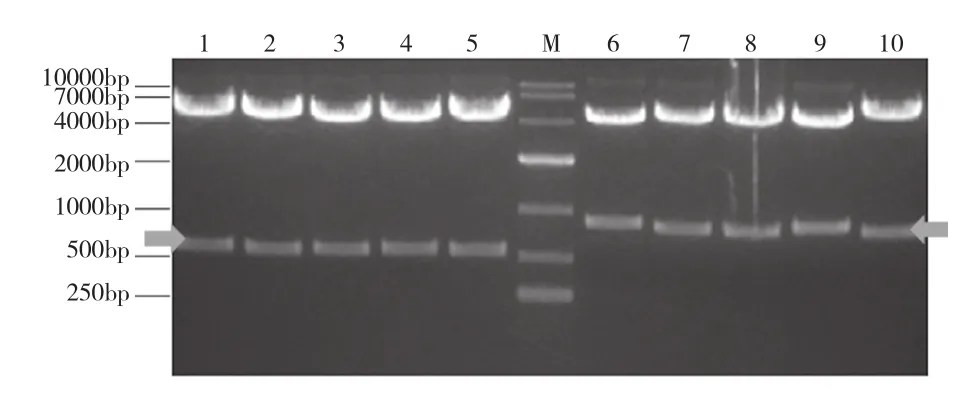
图4 载体经NotⅠ和XhoⅠ酶切鉴定
2.3 大鼠CD138和luciferase基因瞬转表达分析
如图5 Luciferase瞬时转染表达结果表明:pluc质粒为对照组,其Luciferase平均活性为789250 RLU。与对照组相比,含HPRE元件pHluc质粒显著地提高Luciferase表达水平(P<0.05);pWluc、pHTluc质粒luciferase表达水平无显著差异(P>0.05)。
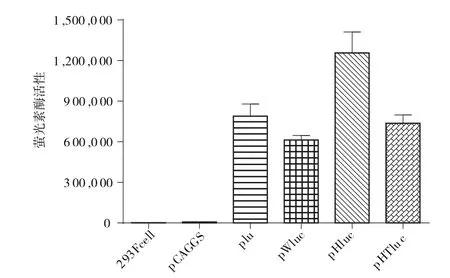
图5 3个转录后调节元件对luciferase表达水平的影响
如图6大鼠CD138瞬时转染表达检测结果表明:与对照组pCD138质粒相比,含HPRE元件pHCD138质粒大鼠CD138表达水平相似,无显著差异(P>0.05);pWCD138、pHTCD138质粒大鼠CD138表达降低,但无显著差异(P>0.05);pFCD138质粒大鼠CD138表达水平显著降低(P<0.05)。
2.4 抗大鼠CD138特异性血清效价检测
如图7小鼠血清效价结果表明:与对照组(pCD138)相比,pFCD138质粒明显提高 BALB/C小鼠的动物免疫反应,其他质粒相对较弱;而且pFCD138质粒组动物免疫反应更快,明显缩短免疫周期。
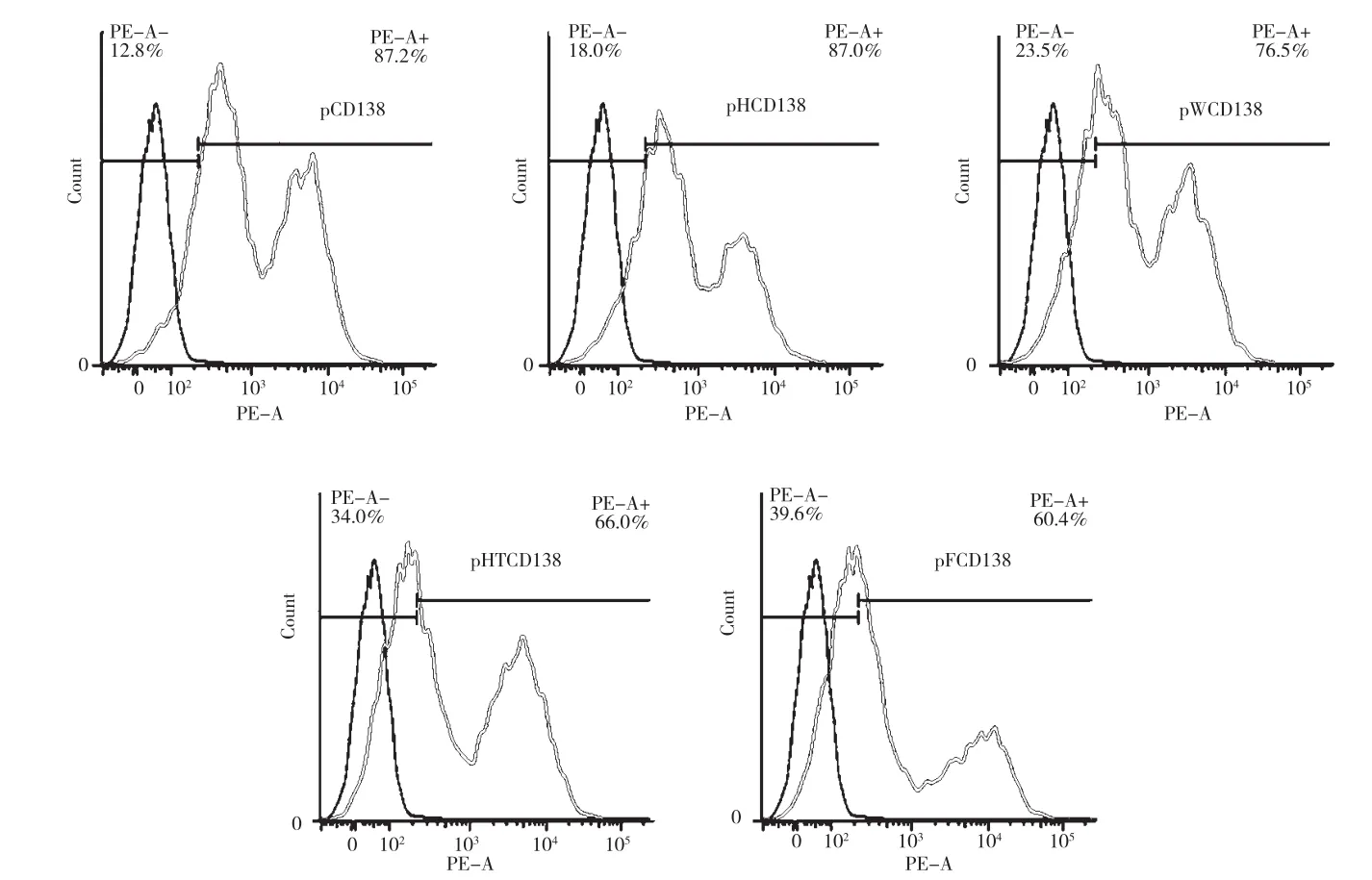
图6 4个元件对大鼠CD138表达的影响
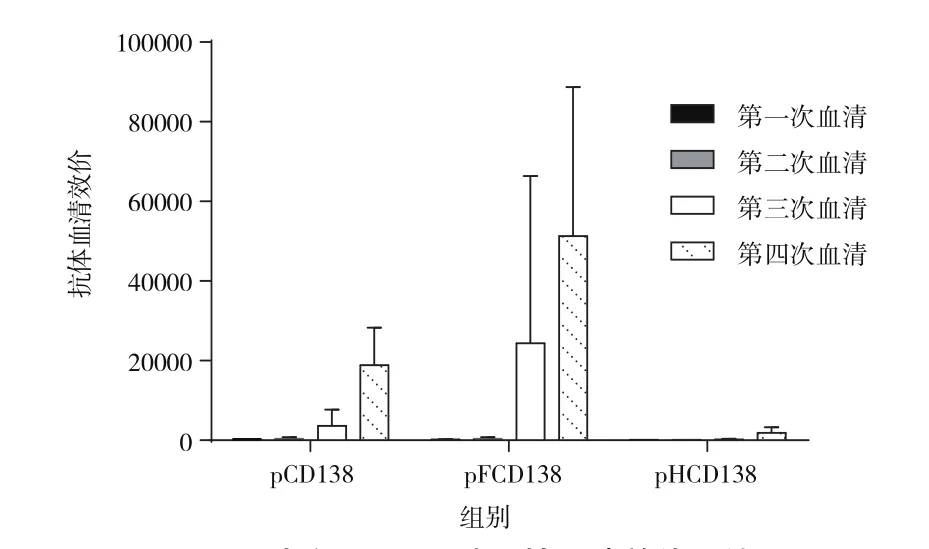
图7 大鼠CD138特异性血清效价总结
2.5 抗大鼠CD138杂交瘤单克隆抗体制备与筛选
用ELISA和FACS方法鉴定阳性杂交瘤细胞,获得5株阳性杂交瘤细胞:1株阳性杂交瘤细胞(clone 8-C2)来自对照组质粒,4株阳性杂交瘤细胞(clone 35-G11、39-D2、42-G8和 44-A9) 来 自 pFCD138质粒组。经过亚克隆,最终获得4个阳性杂交瘤单克隆细胞(clone 8-C2、35-G11、39-D2和44-A9)。
2.6 抗大鼠CD138纯化单克隆抗体评估与鉴定
图8所示,从pFCD138质粒获得35-G11和39-D2两株单克隆抗体均与大鼠CD138特异性结合,而且具有高亲和力。35-G11抗体ELISA EC50 0.03 μg/mL,FACS EC50 0.33 μg/mL;39-D2 抗 体ELISA EC50 0.03 μg/mL,FACS EC50 0.39 μg/mL。但8-C2和44-A9抗体与大鼠CD138结合力弱,均无法计算EC50。其中8-C2抗体来自pCD138质粒免疫、44-A9抗体来自pFCD138质粒免疫。
鞭毛蛋白FliC作为一种新型分子佐剂,通过TLR5介导多种信号通路的免疫刺激反应。鞭毛蛋白以多种形式佐剂诱导强烈先天性免疫和适应性免疫反应,因此鞭毛蛋白具有非常广泛的适应性[7]。鞭毛蛋白作为免疫佐剂具有很多优越性:(1)鞭毛蛋白对宿主不会产生超敏反应;(2)活化抗原呈递细胞的功能显著,且可同时增强抗原呈递细胞对外来抗原的摄取、加工和递呈功能。本研究表明将鞭毛蛋白克隆入哺乳动物表达载体,与抗原基因融合表达,不仅显著增强小鼠特异性免疫反应,而且获得更多高质量的特异性抗体。
3 结论
HPRE质粒能显著增强luciferase表达水平,WPRE、HTLV-1R元件对目的基因表达无增强作用。FliC质粒会降低大鼠CD138表达,与预期结果相符。因为FliC作为免疫佐剂,并不具有调控基因表达的作用,但与抗原基因融合表达,大分子量蛋白质会影响其表达量。最终选择HPRE元件及FliC质粒进行小鼠免疫反应效果评价。FliC质粒显著提高 BALB/C小鼠免疫反应,而且动物免疫反应更快,明显缩短免疫周期。HPRE反而会降低动物免疫反应,可能是HPRE与pCAGGS质粒AG内含子并没有协同作用。FliC作为新型分子佐剂,与抗原基因融合表达,能共同激活抗原呈递细胞,促进抗原在细胞内提呈、加工,诱导促炎症性因子以及细胞因子的分泌,从而激活T细胞和B细胞应答。与对照组(pCD138质粒)相比,含FliC质粒获得35-G11和39-D2杂交瘤单克隆抗体具有更高的亲和力。
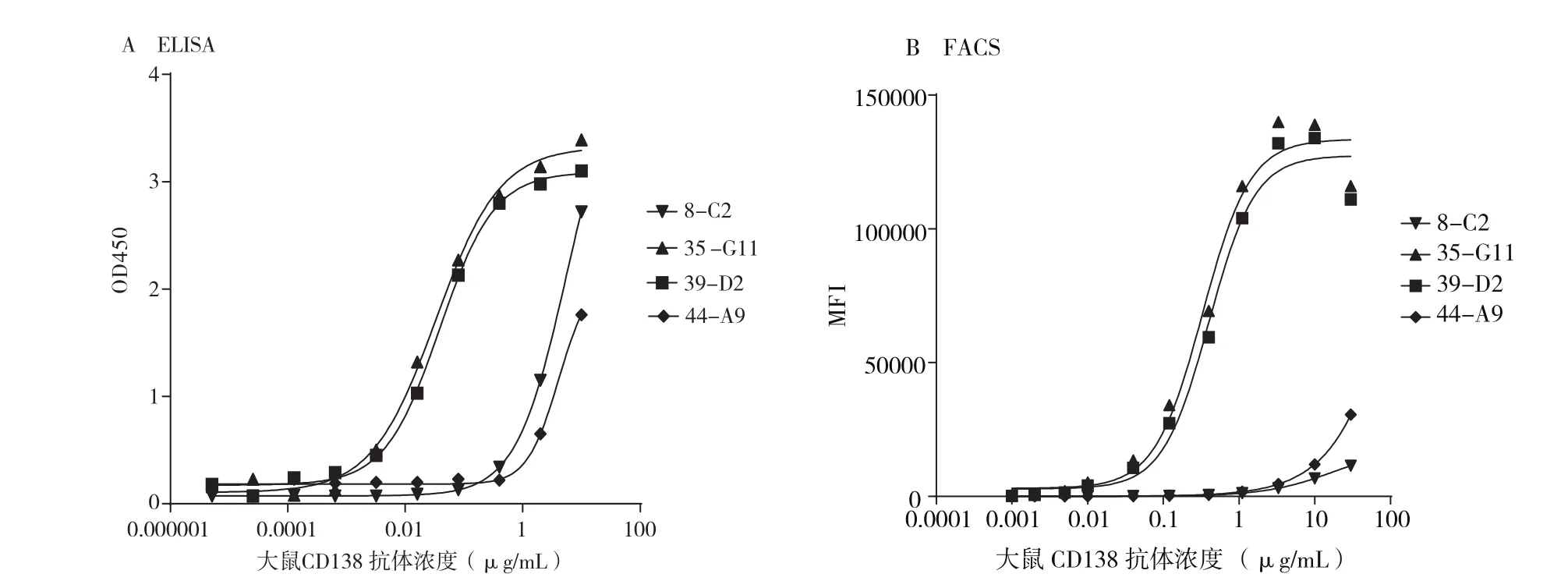
图8 大鼠CD138抗体特异性结合鉴定

