睾丸精原细胞瘤与非精原生殖细胞瘤的临床特点与超声表现比较
游小慧,薛 敏
(1.江苏省苏州市立医院东区超声科,江苏 苏州 215000;2.江苏省苏州大学附属第二医院超声科,江苏 苏州 215000)
睾丸生殖细胞肿瘤(germ cell tumors,GCT)可分为精原细胞瘤和非精原生殖细胞瘤(nonseminomatous germ cell tumor,NSGCT)两大类[1],临床少见,多为恶性肿瘤,生育期年龄好发,严重影响患者生育能力和生活质量。精原细胞瘤对放疗敏感,而NSGCT治疗以手术和化疗为主[2,3]。因此术前诊断和鉴别诊断对于临床治疗具有重要价值。超声检查是睾丸肿瘤的首选检查技术,GCT 种类较多,超声声像特征多种多样。基于此,本研究结合苏州大学附属第二医院经手术病理证实的18 例睾丸精原细胞瘤患者与18例NSGCT 患者的临床病史资料和超声声像图,比较二者的临床表现和超声声像特征,现报道如下。
1 资料与方法
1.1 一般资料 选取2010 年1 月~2019 年12 月苏州大学附属第二医院经手术病理证实的18 例睾丸精原细胞瘤患者设为精原细胞瘤组,18 例非精原生殖细胞瘤(NSGCT)患者设为NSGCT 组。NSGCT 组包括胚胎性癌5 例,绒毛膜癌4 例,混合性生殖细胞瘤9 例。精原细胞瘤组中16 例接受血清肿瘤标志物甲胎蛋白(AFP)检测,15 例接受血清人绒毛膜促性腺激素(β-HCG)检测;NSGCT 组中12 例接受血清肿瘤标志物AFP 检测,13 例接受血清β-HCG 检测。
1.2 仪器与方法 采用GE Healthcare、ESAOTE My-Lab、Siemens Acuson2000 型彩超仪,常规高频探头,频率8~14 MHZ;对于明显肿大的阴囊,选用频率3~6 MHZ 低频探头。患者水平仰卧位,阴茎上提,充分暴露阴囊。双侧睾丸对比、多切面扫查,规范测量睾丸及肿块,同时扫查腹股沟区、肾门区、腹膜后、观察是否有肿大的淋巴结。
1.3 图像分析 由2 名高年资长期从事泌尿系超声检查的超声科医师结合两组患者临床资料,分析病理结果及超声声像特征,包括睾丸内肿块数目、位置、大小、形态、边界、内部回声、有无钙化、有无囊变、微结石、肿块内部血流丰富程度等。
1.4 统计学方法 采用SPSS 17.0 统计学软件进行数据分析。计量资料以()表示,符合正态分布、方差齐者采用独立样本的t检验,非正态分布或方差不齐采用秩和检验;计数资料以[n(%)]表示,组间比较采用卡方检验或Fisher 确切概率法。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床资料比较 精原细胞瘤组与NSGCT 组发病年龄,初诊原因为隐睾占比、远处器官转移、血清肿瘤标志物AFP 和β-HCG 比较,差异有统计学意义(P<0.05);两组发生部位,初诊原因为睾丸肿大、阴囊肿块、疼痛占比、腹股沟淋巴结肿大比较,差异无统计学意义(P>0.05),见表1。
2.2 两组超声声像特征比较 精原细胞瘤组与NSGCT 组低回声、回声均匀超声声像特征比较,差异有统计学意义(P<0.05);两组肿块大小、多发结节、钙化、囊变、微结石、肿块内部血流丰富超声声像特征比较,差异无统计学意义(P>0.05),见表2。
表1 精原细胞瘤和非精原生殖细胞瘤患者临床资料比较[,n(%)]
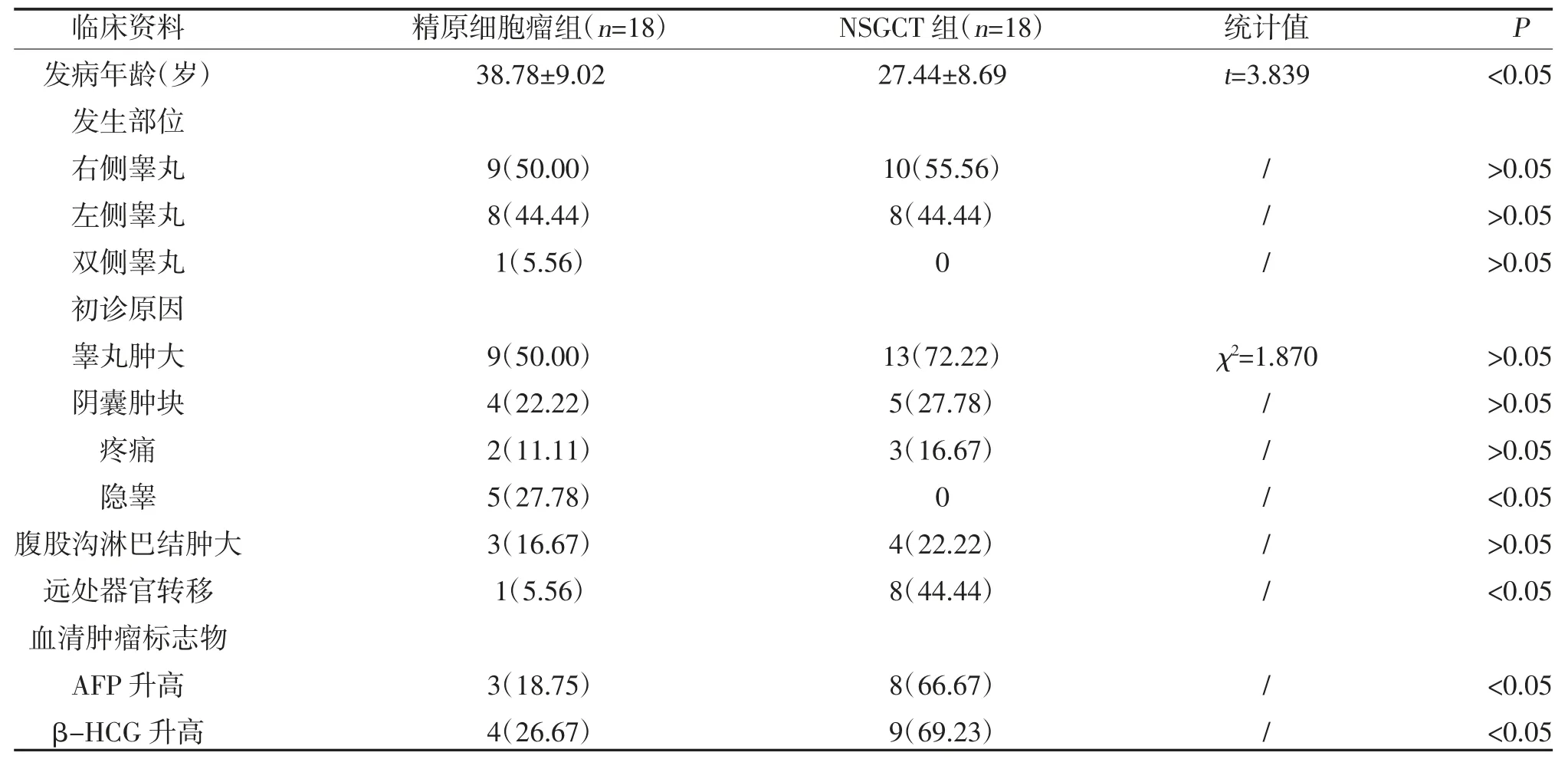
表1 精原细胞瘤和非精原生殖细胞瘤患者临床资料比较[,n(%)]
注:“/”为Fisher 确切概率法检验
表2 精原细胞瘤与非精原生殖细胞瘤患者超声声像特征比较[,n(%)]
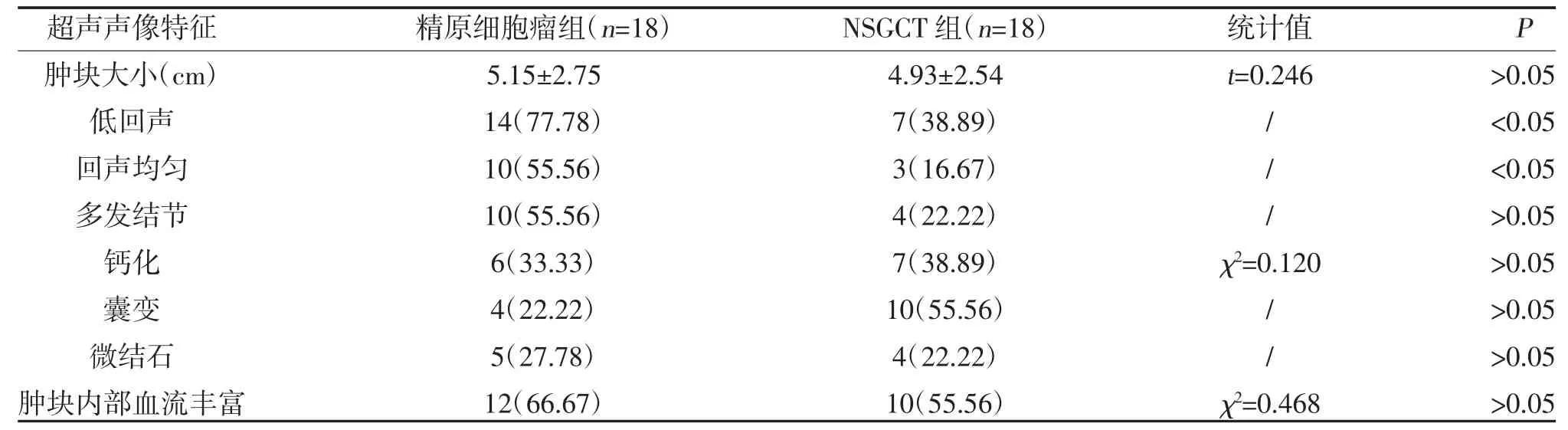
表2 精原细胞瘤与非精原生殖细胞瘤患者超声声像特征比较[,n(%)]
注:“/”为Fisher 确切概率法检验
3 讨论
精原细胞瘤与NSGCT 都是生殖细胞起源的肿瘤,约占睾丸肿瘤的90%~95%,我国睾丸肿瘤的发生率约为1/10 万,比西方国家发生率要低[4,5]。虽然睾丸肿瘤只占男性肿瘤的1%,临床上少见,但95%都是恶性肿瘤,且近年来睾丸生殖肿瘤发生率有逐渐上升的趋势[6],严重影响患者的生育能力和生活质量。
研究显示[7,8],精原细胞瘤通常发生于40~50岁,很少在青春期前发生;而NSGCT 发病年龄多在30 岁左右,发病年龄较精原细胞瘤晚。本研究结果显示,两组发病年龄比较,差异有统计学意义(P<0.05),提示年龄可以作为精原细胞瘤与NSGCT 鉴别的一个参考因素。风险因素会促进GCT 的发生、发展,其中包括遗传性疾病(如唐氏综合征和睾丸发育不良综合征)、隐睾症、睾丸微结石、睾丸肿瘤家族遗传病史、之前有过睾丸肿瘤病史等[9]。研究报道[10],约15%的精原细胞瘤患者有隐睾病史,精原细胞瘤与隐睾关系最密切。本研究中精原细胞瘤组中隐睾的比例高达27.78%(5/18),而NSGCT 组中未出现隐睾患者,可能与病例数较少有关,但在某种程度上说明如果隐睾合并睾丸肿瘤,精原细胞瘤可能性较NSGCT 大,对于两类肿瘤的鉴别诊断也有一定帮助。精原细胞瘤与NSGCT 的诊断与血清肿瘤标志物甲胎蛋白(AFP)和人绒毛膜促性腺激素(β-HCG)关系密切。AFP 主要是由卵黄囊成分合成,在含有卵黄囊成分的肿瘤中AFP 升高,如卵黄囊瘤或者是含有卵黄囊成分的混合型生殖细胞瘤。β-HCG 主要由滋养层细胞合成,如绒毛膜癌及含有该成分的混合性生殖细胞瘤。在“纯”的精原细胞瘤中,AFP 和β-HCG 值都在正常范围,但临床中少见,如果升高,说明精原细胞瘤中含有以上两种不同的成分。NSGCT中40%~60%的病例中可见多种不同的组织学形式,因此AFP 和β-HCG 值往往升高[7]。本研究中血清肿瘤标志物AFP 和β-HCG 值升高在NSGCT 中多见。精原细胞瘤是预后最好的GCT,很少发生远处器官转移。本研究组中NSGCT 发生远处器官转移高达44.44%(8/18),高于精原细胞瘤的5.56%(1/18)。Woodward PJ 等[11]研究表明,约有75%的精原细胞瘤局限在睾丸内,20%发生淋巴结转移,5%发生远处器官的转移。而NSGCT 更容易发生远处转移,尤其是绒毛膜癌,血性转移早,预后差[12]。
本研究组中精原细胞瘤声像特征表现为睾丸内均质、低回声肿块,部分呈分叶状,肿瘤标本通常表现为中等大小、实性、均匀一致、淡黄色,镜下瘤细胞特征性呈巢状排列,排列紧密,外部有纤维带。而NSGCT 声像特征表现为睾丸内不均质肿块,NSGCT由于组织学构成复杂,而且比例不同,因此对应超声声像特征多种多样,畸胎瘤声像特征表现为不均质肿块、钙化、囊变多见。有文献报道[7],约89%的畸胎癌含有囊性成分。绒毛膜癌容易发生出血,中心部位可出现广泛的出血坏死,形成囊实性肿块;胚胎性癌声像特征表现为肿块体积较小,边界不清,不均质,通常与畸胎瘤并存,多见于混合型生殖细胞瘤中;卵黄囊瘤声像特征表现为不均质肿块,儿童多见,成人混合型生殖细胞瘤中含有卵黄囊成分,常常提示预后差。睾丸精原细胞瘤可以单发,也可以多发,呈数个大小不等的肿块,肿块间有正常的睾丸实质回声或有稍高回声分隔。有研究认为[13],精原细胞瘤的这些结节通常是相连的,真正多发结节较少见;其原因可能为精原细胞瘤起源于精曲小管内瘤样病变,精曲小管构成的睾丸小叶被睾丸分隔分开,当肿瘤体积较小时,正常睾丸组织较多,表现为结节间有正常的睾丸实质回声;当肿瘤体积增大,正常的睾丸实质越来越少,睾丸分隔也被挤压,失去原有的形态,表现为结节间不规则的稍高回声分隔。体积较大的精原细胞瘤声像特征表现为囊实性混合回声,这与肿瘤生长速度过快,血供不足,内部可出现缺血坏死改变有关,声像图特征表现为睾丸肿块内部数处不规则无回声区,对应大体标本表现为境界清楚的坏死灶;患者也会突然感觉阴囊疼痛不适。
综上所述,睾丸精原细胞瘤发病年龄较NSGCT晚,常伴有隐睾病史。超声声像特征表现为睾丸内均质低回声肿块;NGGCT 更容易发生远处器官转移,AFP和β-HCG 更容易升高。超声声像特征表现为睾丸内不均质混合性肿块。掌握这些特征,有利于两者术前的诊断和鉴别诊断,对临床治疗具有一定的意义。

