腹泻型肠易激综合征大鼠肠道树突细胞对Th1/Th2免疫平衡以及内脏高敏感的影响*
庄肇朦 谢 敏 张益光 吕 宾
温州市中西医结合医院消化内科1(325000) 浙江中医药大学附属第一医院消化内科2
背景:肠易激综合征(IBS)的发病原因和机制尚未完全明确,临床上缺乏有效的预防和诊治手段。近年越来越多的研究认为肠道局部黏膜免疫功能异常在IBS发病中起有重要作用。目的:探讨肠道树突细胞(DC)在腹泻型IBS(IBS-D)大鼠结肠黏膜Th1/Th2免疫应答途径失衡中的作用及其对内脏高敏感的影响。方法:将45只成年SD大鼠随机分为空白对照组、NS对照组和模型组,每组各15只。以乙酸灌肠联合束缚应激制备大鼠内脏高敏感模型,以腹壁回撤反射(AWR)实验和大鼠粪便性状评估内脏敏感性。采用流式细胞分选技术分离经相应特异性抗体标记的肠系膜淋巴结DC以及脾脏初始CD4+T细胞并体外进行共培养,以MTT法检测CD4+T细胞的增殖能力,ELISA法检测Th1途径细胞因子IL-12、IFN-γ和Th2途径细胞因子IL-4、IL-9的分泌能力。结果:与NS对照组和空白对照组相比,模型组大鼠内脏敏感性明显增高(P<0.05),肠道淋巴结来源的DC促进脾脏CD4+T细胞增殖的能力增强(P<0.05),IL-4和IL-9分泌量明显升高(P<0.05),IL-12分泌量明显减少(P<0.05)。结论:IBS-D内脏高敏感大鼠肠道DC的抗原呈递能力增强,诱导Th2途径免疫应答能力亢进,进而导致局部肠道黏膜Th1/Th2免疫应答途径失衡。
肠易激综合征(IBS)的发病原因和发病机制尚未完全明确,近年越来越多的研究认为肠道和全身免疫应答的失调以及免疫调节功能异常与IBS发病密切相关,其中肠道局部黏膜免疫功能异常在IBS发病中起有重要作用。
抗原呈递细胞(antigen presenting cells, APC)在肠黏膜免疫功能方面发挥关键作用[1]。树突细胞(dendritic cell, DC)属APC,具有强大的诱导T细胞初次免疫应答的能力,是诱导初始T细胞(Th0细胞)活化的主要APC[2]。有研究[3-4]发现腹泻型IBS(IBS-D)大鼠和患者结肠黏膜组织中DC数量增多,CD4+Th2免疫应答途径相关细胞因子分泌增多,肥大细胞过度活化脱颗粒,且与后期的内脏高敏感症状持续时间、肠道继发性感染风险相关。本研究通过观察IBS-D大鼠肠黏膜CD4+T细胞Th1/Th2途径免疫应答失衡的现象,旨在探讨DC对IBS-D大鼠内脏高敏感和Th1/Th2免疫平衡的影响。
材料与方法
一、实验动物
45只雄性Sprague-Dawley(SD)大鼠由第三军医大动物医学中心提供,无畸形,无外伤,皮肤无感染,体质量(250±10)g,常规饲养,适应性饲养一周。环境设置:室温22~24 ℃,湿度<60%,噪音<50 db。
二、主要仪器与试剂
IgG isotype matehed antibodies、CD4荧光抗体(美国eBioscience公司),MHCⅡ、CD11b、CD80、CD86荧光抗体(美国BD公司);流式细胞检测仪(FACSVantage SE),每100个细胞中加入80 μL缓冲液和20 μL 抗CD4荧光抗体,每110个细胞中加入80 μL缓冲液和25 μL 抗CD11b荧光抗体,调节流式细胞仪使目标细胞通过样品室的浓度为100~300个/s;8F导尿管(直径2 mm,球囊最大容量3 mL,最大直径2 cm),用于结直肠内球囊扩张导管(浙江康康医疗器械有限公司生产);冰乙酸、MTT(北京康为世纪生物科技有限公司);IL-12、IL-4 ELISA试剂盒(美国eBioscience公司);IFN-γ、IL-9 ELISA试剂盒(Cusabio公司)。
三、研究方法
1.实验分组和模型建立:采用随机数字表法将大鼠随机分为空白对照组、0.9% NaCl溶液对照组(NS对照组)和模型组,每组各15只。模型组采用乙酸灌肠联合束缚应激建立内脏高敏感模型[5-6];NS对照组给予相应0.9% NaCl溶液灌肠处理;空白对照组不予处理。
2.内脏敏感性评估:实验第10天,以大鼠在下午2~5时之间的排便情况以及结直肠扩张时腹壁回撤反射(AWR)评分为3分时所需的气囊压力作为评价内脏敏感性的指标[7]。
3.标本采集:于乙酸灌肠后第2天随机选取空白对照组和模型组大鼠各2只,给予3%戊巴比妥(40 mg/kg)麻醉后取距离肛门6 cm处的结肠组织1 cm。在模型建立成功后的实验第10天,各组大鼠经3%戊巴比妥(40 mg/kg)麻醉后处死,70%乙醇浸泡10 min,无菌条件下剖开大鼠腹腔取脾脏和肠系膜淋巴结,碾磨后收集细胞悬液。
4.HE染色:取距肛门6 cm处的结肠组织,多聚甲醛溶液固定,脱水,石蜡包埋,连续切片,行HE染色,观察大鼠黏膜损伤修复情况。
5.流式细胞术:调整细胞浓度为8×106~10×106/mL,用荧光标记目标抗体染色细胞,过滤,将滤液移入流式管,上流式细胞仪进行分选,离心浓缩,重悬,培养,从肠系膜淋巴结细胞中筛选出DC,从脾脏淋巴细胞中筛选出CD4+T细胞。
6.MTT法:将分离得到的DC调整浓度至5×105/mL,与1.5×106/mL CD4+或CD8+T细胞共培养,收集上清液,使用MTT法检测DC促进CD4+T细胞增殖的效果。
7.ELISA法:将分离得到的DC调整浓度至5×105/mL,与1.5×106/mL CD4+或CD8+T细胞共培养,仔细收集上清液,严格根据ELISA试剂盒说明书要求,检测Th1途径细胞因子IL-12、IFN-γ以及Th2途径细胞因子IL-4、IL-9的分泌能力。
四、统计学分析
结 果
一、一般情况
造模后,三组大鼠在第1~2天均表现出焦躁不安,大便稀水样,肛周污染,有粪便残留,饮水增多,进食量明显减少。第4~5天开始,空白对照组和NS对照组大鼠粪便水分减少,以软便为主,偶可见稀便;模型组大鼠粪便水分亦较前减少,排便量和稀便发生率较其余两组多见。第7天开始行束缚应激时,空白对照组和NS对照组大鼠粪便以软便为主,偶可见颗粒样粪便,无稀便;模型组大鼠以软便为主,偶可见颗粒样粪便和稀便,排便量较其余两组增加。在乙酸灌肠联合束缚应激实验完成后,NS对照组大鼠偶可见解稀便,肛周毛发粪便残留,伴易激怒,耸毛现象;空白对照组大鼠肛周毛发清洁度良好,无明显粪便污染,两组大鼠进食量和饮水量未见明显异常,活动量无特殊改变,体质量处于正常增长范围;模型组大鼠出现反应迟钝,易激怒,耸毛,解稀便,软便,肛周毛发粪便污染残留,进食量和饮水量减少,活动明显减少,体质量下降等表现。肉眼观察和HE染色均未见大鼠结肠黏膜存在糜烂和溃疡性病变。实验第10天,模型组大鼠软便数和总便数明显高于NS对照组和空白对照组(P<0.05;表1)。
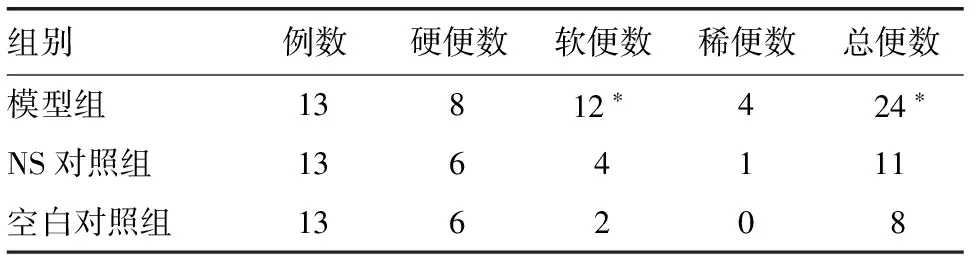
表1 三组大鼠排便情况差异(实验第10天14时-17时排便情况)(n)
二、内脏敏感性
AWR评分为3分时,模型组大鼠结直肠球囊扩张的压力明显低于空白对照组和NS对照组(P<0.05),而空白对照组与NS对照组相比差异无统计学意义(P>0.05;表2)。说明模型组内脏敏感性明显增高。
三、DC和脾脏CD4+T细胞分离结果
1.分离细胞表型测定结果:流式细胞术检测显示CD4+T细胞阳性率为92.46%±6.87%,台盼蓝染色显示细胞活性>90%;DC由PE标记OX62后流式分选所得,阳性率为97.46%±1.87%,台盼蓝染色显示细胞活性>90%。
2.分离DC细胞预培养:流式分选后所获取的DC在体外常规培养后可见细胞表面典型树枝状凸起(图1)。
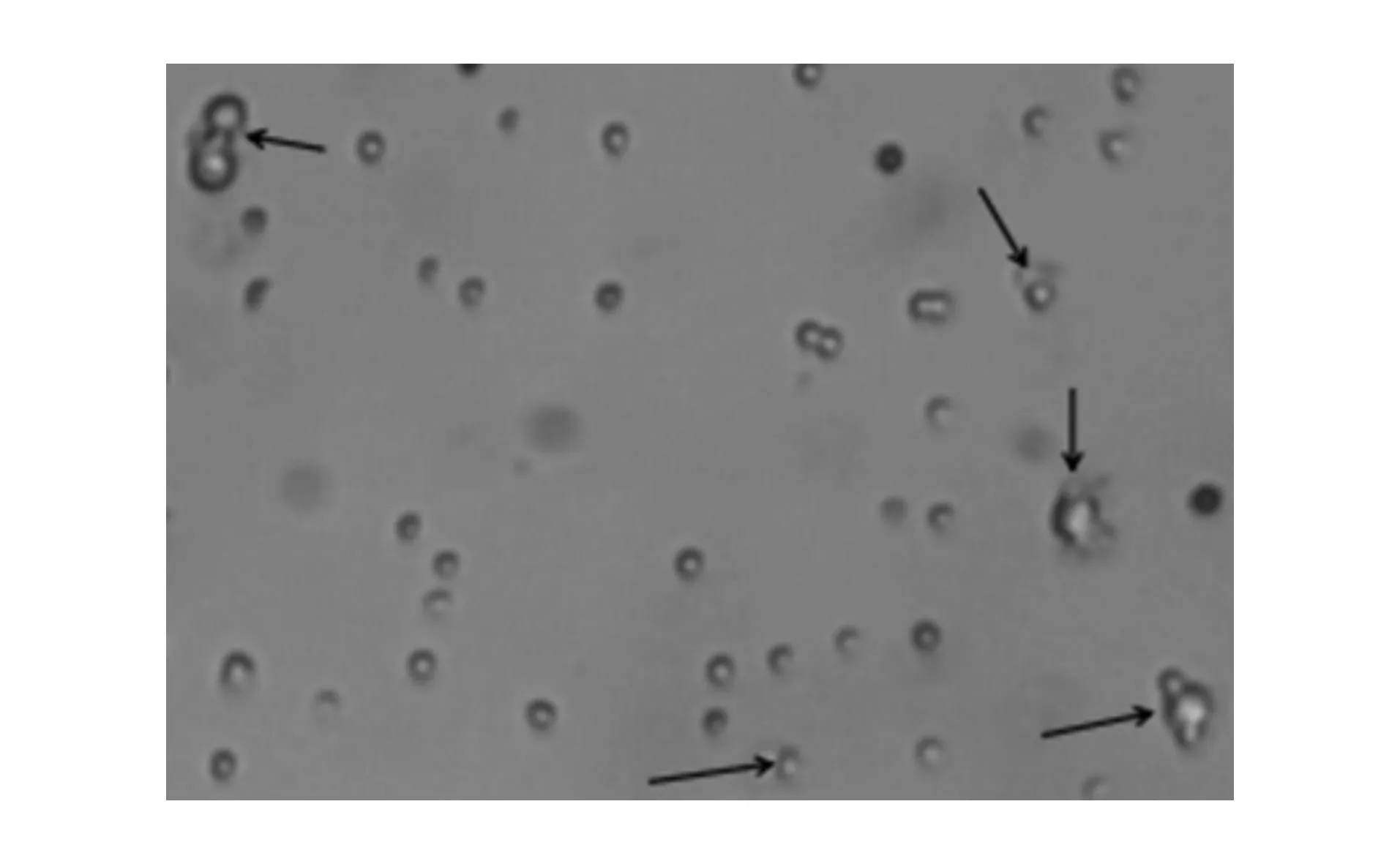
图1 流式分选所得DC和CD4+T细胞(箭头所示为DC,其余为CD4+T细胞)
四、DC和脾脏CD4+T细胞共培养结果
1.DC促进CD4+T细胞增殖效果:模型组CD4+T细胞的增殖能力显著高于NS对照组和空白对照组(P<0.05),而后两组之间相比无明显差异(表2)。说明模型组DC促进CD4+T细胞增殖的作用增强。
2.DC促CD4+Th0细胞分泌细胞因子的情况:当DC与CD4+Th0细胞共培养时,模型组IL-4、IL-9分泌显著高于NS对照组和空白对照组,IL-12分泌显著减少(P<0.05),而NS对照组与空白对照组之间无明显差异。三组IFN-γ分泌水平无明显差异,可能与实验结果不稳定存在一定关系(表2)。
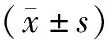
表2 三组大鼠内脏敏感性、CD4+T细胞增殖和细胞因子比较
讨 论
近年来相关研究发现肠道黏膜免疫功能异常对IBS-D的发病和内脏高敏感的严重程度起有重要作用。IBS患者结肠黏膜中免疫细胞(DC、肥大细胞、CD4+T细胞)数量增多,同时伴有相应细胞因子(IL-4、IL-6、IL-9、TNF-α等)表达增加[1,8]。前期实验亦发现IBS-D患者和大鼠血清、肠道黏膜DC数量明显增多,黏膜肥大细胞浸润增加,且其活化脱颗粒增强,同时伴有CD4+T细胞Th2免疫应答途径相关细胞因子IL-4、IL-9分泌明显增加等现象[9]。然而IBS-D大鼠肠黏膜CD4+T细胞Th1/Th2途径免疫应答失衡现象及其与肠道DC之间的关系,以及对IBS-D大鼠内脏高敏感的影响尚需行进一步实验阐明。
APC在肠道黏膜免疫应答中起有关键作用。在异常情况下,APC对抗原的敏感性增加,引起肠黏膜免疫反应的异常激活和持续应答[10],从而在IBS的发病中起有重要作用。DC广泛分布于黏膜固有层、肠道Peyer淋巴结、肠系膜淋巴结以及全身血液、其他组织器官中,具有诱导Th0细胞活化的功能[2],故在全身和黏膜免疫应答过程中起极其重要的作用。DC通过向Th0细胞提供活化的第一、第二信号,诱导其向Th1和Th2亚群分化。在此过程中分别产生相应的细胞因子辅助免疫应答,包括Th1途径的IL-2、IL-12、IFN-γ以及Th2途径的IL-4、IL-9。
Th1免疫反应表现为IFN-γ、IL-2和淋巴毒素-α分泌的增加,参与细胞免疫,可抵御细胞内病原体如病毒、细菌、原虫、真菌等[2]。Th2免疫反应表现为IL-4分泌增加,辅助B细胞的激活和增殖,参与体液免疫,或促进B细胞分泌大量IgE参与变态反应,在抵御细胞外病原体的过程中起主要作用。在正常机体内,当外来病原体(如寄生虫、细菌、病毒等)入侵肠道时,肠黏膜固有层的免疫细胞和细胞因子通过Th1途径和Th2途径相辅相成,共同维持肠道黏膜免疫环境的稳定,但Th1/Th2比例失衡时,容易诱发黏膜免疫功能的紊乱,从而导致疾病的发生[11]。
Long等[12]的研究发现感染后肠易激综合征小鼠肠道固有层DC在急性期与脾脏Th0细胞共培养后可产生Th2途径免疫应答,然而其未对IBS-D模型动物肠道Th1/Th2途径免疫应答失衡现象行进一步研究和探讨。
结合前期研究结果,本研究发现模型组大鼠经提取的成熟DC促进自体初始CD4+T细胞增殖的能力增强,两者共培养时Th2途径细胞因子IL-4和IL-9分泌量较NS对照组和空白对照组明显增多,而Th1途径细胞因子IL-12分泌量较两组对照组减少。提示IBS-D大鼠肠道DC可能通过亢进的抗原呈递能力,介导脾脏CD4+Th0细胞活化,诱导Th0细胞向Th2细胞分化,从而导致黏膜Th2免疫应答占绝对优势,Th1/Th2免疫应答途径失衡,产生明显多于生理量的细胞因子IL-4、IL-9。
肠黏膜肥大细胞浸润,活化、脱颗粒,以及相应介质的释放是IBS-D患者产生内脏高敏感的主要机制之一[13-14]。Th1/Th2免疫应答途径失衡,分泌亢进的细胞因子IL-4、IL-9通过作用于肥大细胞在IBS-D的发病过程中扮演重要角色。IL-4是特异性促IgE生成的细胞因子,与肥大细胞的活化密切相关[15-16]。IL-9能增加肥大细胞表面FceRIα的表达,使肥大细胞处于更易被激活的状态[17-18]。因此,细胞因子可能作为T细胞与肥大细胞之间的媒介,介导黏膜异常免疫应答的发生。
综上所述,本研究发现IBS-D内脏高敏感大鼠肠道黏膜DC数量增多,抗原呈递功能亢进,从而促进自体CD4+T细胞过度增殖,并诱导Th0细胞主要向Th2细胞亚型分化,从而导致黏膜Th2免疫应答占绝对优势,Th1/Th2免疫应答途径失衡,产生大量细胞因子IL-4、IL-9。进一步引发了后续肥大细胞过度增殖、活化、脱颗粒的现象,从而导致内脏高敏感的发生。
同时,IBS-D大鼠肠道黏膜Th2免疫反应异常亢进,使肠道黏膜抗外来病原体感染免疫过度应答,黏膜维稳修复功能可能下降。因此,Th1/Th2免疫平衡紊乱为IBS-D大鼠继发肠道感染性疾病提供了免疫学基础。未来将对IBS-D大鼠肠黏膜Th1/Th2免疫应答途径失衡所造成的抗病原微生物感染免疫失调现象行进一步实验,通过观察正常大鼠、IBS-D大鼠与IBS-D继发肠道感染大鼠肠道黏膜免疫细胞功能和数量以及相应细胞因子的分泌量、各组大鼠内脏敏感性等指标,进一步明确IBS-D大鼠在黏膜Th1/Th2免疫应答途径失衡基础上所面临的继发肠道大肠埃希菌感染高风险,以及继发感染后进一步加重的免疫应答紊乱现象,从而深入研究IBS患者继发肠道大肠埃希菌感染性疾病的风险以及对内脏高敏感症状的影响。

