SNHG14在Alzheimer’s病患者血清中表达及其与神经细胞自噬相关性研究
潘鹏,李兵,彭鲁
Alzheimer’s病(AD)是最常见的神经退行性病变,起病早期多隐匿,患者除记忆力下降外无任何临床表现,但此时患者脑组织已出现β淀粉样变等病理变化,随着病情进展患者出现认知功能障碍、执行功能障碍以及人格和行为改变等全面性痴呆表现[1-2]。AD的发病原因目前尚不确定,主要可能有β淀粉样蛋白堆积、tau蛋白过度磷酸化、神经炎症和氧化应激等[3]。近年来,多数报道证明神经元细胞自噬功能损伤可引发AD,但引起神经元细胞自噬功能损伤的机制尚未明确[4-5]。同时,AD早期诊断,特别是在其尚未涉及神经元凋亡时诊断对AD预防及治疗具有重要意义,但目前尚无AD早期诊断标准,多种蛋白及非编码RNA可能参与AD发病过程[6]。
长链非编码RNA(lncRNA)是一类不翻译产生蛋白质的RNA总称,其可通过对mRNA的调节作用参与多种生理或病理过程[7]。研究表明肿瘤、糖尿病、免疫系统病变、神经系统病变等多种疾病发生时,患者体内lncRNA谱可发生改变[8-10]。长链非编码RNA SNHG14最早发现于肿瘤组织,其功能主要在于促进肿瘤细胞增殖、转移等[11]。近年来SNHG14在神经系统疾病中作用越来越引起研究者关注,但其在AD发生发展中的作用目前尚无报道。本研究在前期研究的基础上,通过对AD患者和相似年龄段正常对照者血清中SNHG14的表达量进行实时荧光定量PCR(RT-qPCR)验证,为确定其作为新的AD早期诊断及判断预后的分子标志物提供客观依据。
1 对象与方法
1.1 对象 (1)AD组:系2019年1月至2019年10月在南京医科大学附属脑科医院就诊的50例AD患者,其中男27例和女23例,年龄55~72岁,中位年龄59岁。(2)正常对照组:系2019年1月至2019年10月在南京医科大学附属脑科医院的健康体检人群,其中男25名、女25名,年龄50~70岁,中位年龄57岁。研究得到南京医科大学附属脑科医院医学伦理委员会的批准,研究对象均签署知情同意书。
1.2 细胞系、试剂及仪器 小鼠神经元细胞系HT-22(编号为MZ-0661) 购自宁波明舟生物公司;高糖DMEM培养基及胎牛血清(美国Gibco公司);总RNA提取分离试剂盒(Total RNA Isolation Kit,郑州贝贝生物公司); RIPA裂解液(RIPA Lysis Buffer,碧云天公司);逆转录试剂盒(miScriptRT Kit,德国Qiagen公司);PCR扩增试剂盒(miScript SYBR Green PCR Kit,德国Qiagen公司) ; Light Cycler 480荧光定量PCR仪(美国Roche公司)。
1.3 方法
1.3.1 临床资料收集 收集AD患者的一般资料,包括性别、年龄、吸烟史,并按此分组。每日吸烟≥10支或吸烟持续时间≥1年,无论是否戒烟,均视为有吸烟史。
1.3.2 血清采集、RNA提取及逆转录 采集AD患者及正常人空腹血清5 ml,置于预装促凝剂的采血管中。使用贝贝生物科技血清总RNA提取试剂盒。按说明书步骤,取100 μl血清于1.5 ml离心管中,加入500 μl RL Solution 充分混匀,再加入40 μl氯仿,12 000 g,4 ℃离心10 min;取200 μl上清,加入等体积无水乙醇,充分混匀,将混匀液加入Spin column管中,12 000 g,4 ℃离心1 min;弃滤液,加入600 μl Wash Buffer, 12 000 g,4 ℃离心1 min,弃滤液;取出Spin column 放入新的离心管中,再加入50 μl无RNA酶水,室温放置1 min,4 ℃离心1 min收集滤液,获得总RNA。 根据miScript RT Kit 说明书的步骤,取1 μg总RNA 加入10 μl 反应体系(包括Bulge-LoopTM miRNA RT Primer 1 μl、5X Reverse Transcription Buffer 2 μl、RTase Mix,最后加ddH2O至10 μl),在普通PCR 仪上进行逆转录。接着在37 ℃ 60 min、95 ℃ 5 min 的反应条件下合成cDNA,最后将其稀释10倍,放置于-80 ℃的冰箱保存备用。
1.3.3 细胞培养和转染 将HT-22细胞培养于DMEM完全培养基(含10%胎牛血清),置37 ℃、5% CO2的细胞培养箱培养,将处于对数生长期的细胞胰酶消化,制作细胞悬液加入6孔板,每孔加入2 ml培养基,再加入含有细胞数为2×105个的细胞悬液,孵育12 h后进行转染。SNHG14 siRNA由上海吉玛制药技术有限公司设计合成,序列为(5′→3′): si-SNHG14 #1 sense,GCA AAU GAA AGC UAC CAA U和anti-sense,AUU GGU AGC UUU CAU UUG C; si-SNHG14 #2 sense, GCA CAA UAU CUU UGA ACU A 和antisense, UAG UUC AAA GAU AUU GUG C; si-SNHG14 #3 sense, UAG AAU CCU AAA GGC AAA 和antisense, UUU GCC UUU AGG AUU CUA G。阴性对照sense,UUC UUC GAA CGU GUC ACU TT,antisense ACG UGA CAC GUU CGG AGA ATT。
1.3.4 自噬相关蛋白5(ATG5)表达水平检测 蛋白提取和Western Blotting细胞转染48 h后采用Western Blotting法检测ATG5蛋白表达水平。RIPA蛋白裂解液提取蛋白,BCA试剂盒测定蛋白浓度。取40 μg蛋白,加至10% SDS-聚丙烯酸胺凝胶电泳,转膜至PVDF膜。5%BSA封闭,加入一抗anti-ATG5(1∶1 000)4 ℃孵育过夜,TBST洗膜,加入相应的二抗。室温封闭2 h,洗膜显影。实验重复三次,将蛋白电泳条带使用Image J软件分析灰度值。
1.3.5 RT-qPCR检测 根据miScript SYBR Green PCR Kit 说明书中的步骤,以逆转录合成的cDNA 作为模板,在罗氏荧光定量PCR 仪上进行qPCR反应。反应体系为2×Quanti Tect SYBR Green PCR Master Mix 10 μl,cDNA 1 μl,上下游引物各1 μl,RNasefree water 6 μl。SNHG14 上游引物为5′-GGG TGT TTA CGT AGA CCA GAA CC-3′,下游引物为5′-CTT CCA AAA GCC TTC TGC CTT AG-3′。以U6 snRNA 作为内参基因,U6上游引物为5′-CTC GCT TCG GCA GCA CA-3′,下游引物为5′-CTT CCA AAA GCC TTC TGC CTT AG-3′。在95 ℃ 10 min, 95 ℃ 2 s,55 ℃ 20 s,72 ℃ 10 s,40个循环。重复3次实验。
1.3.6 统计学方法 使用SPSS 23.0进行统计学分析,以U6为内参,进行标准化处理,使用ΔCT法分析RT-qPCR 所得数据(ΔCT= CTSNHG14-CTU6)。将得到的ΔCT 值以2-ΔCT表示为SNHG14 的相对表达量。采用t检验确定正常人与AD患者血清中SNHG14表达量的差异,使用Fisher确切概率检验分析AD患者血清中SNHG14的表达量水平与AD患者的临床特征的关系,使用t检验检测SNHG14敲低前后细胞ATG5蛋白表达差异,P<0.05为差异有统计学意义。
2 结 果
2.1 两组血清中SNHG14表达的比较 见图1。AD组血清中SNHG14[(45.33±7.04)×10-4]明显低于正常对照组[(74.07±9.63)×10-4](t=2.410,P=0.0178)]。
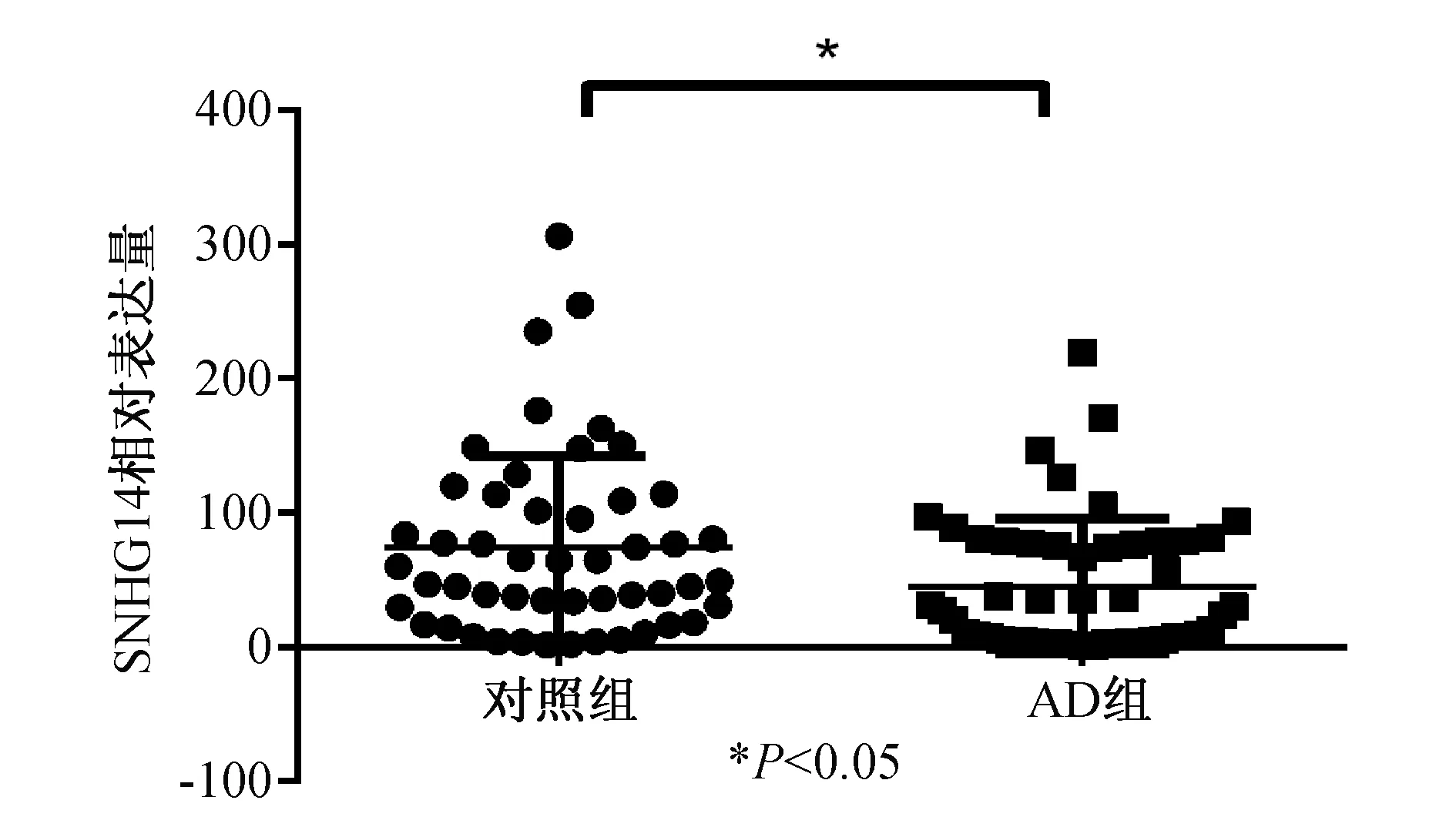
图1 两组血清中SNHG14表达量
2.2 AD组SNHG14水平与患者临床特征之间的相关性 见表1。以对照组平均SNHG14表达量等于74.07×10-4为界,将研究对象分为高表达组(≥对照组表达均数)及低表达组(<对照组表达均数),其中低表达33例,高表达17例;按性别分为男性组及女性组;以患者年龄中位数59岁为界将患者分为≥59岁组和<59岁组;以是否吸烟分为吸烟组和非吸烟组。进行四格表χ2检验分析。结果显示,AD患者血清中SNHG14表达水平与患者年龄、吸烟、性别均无明显相关性(均P>0.05)。
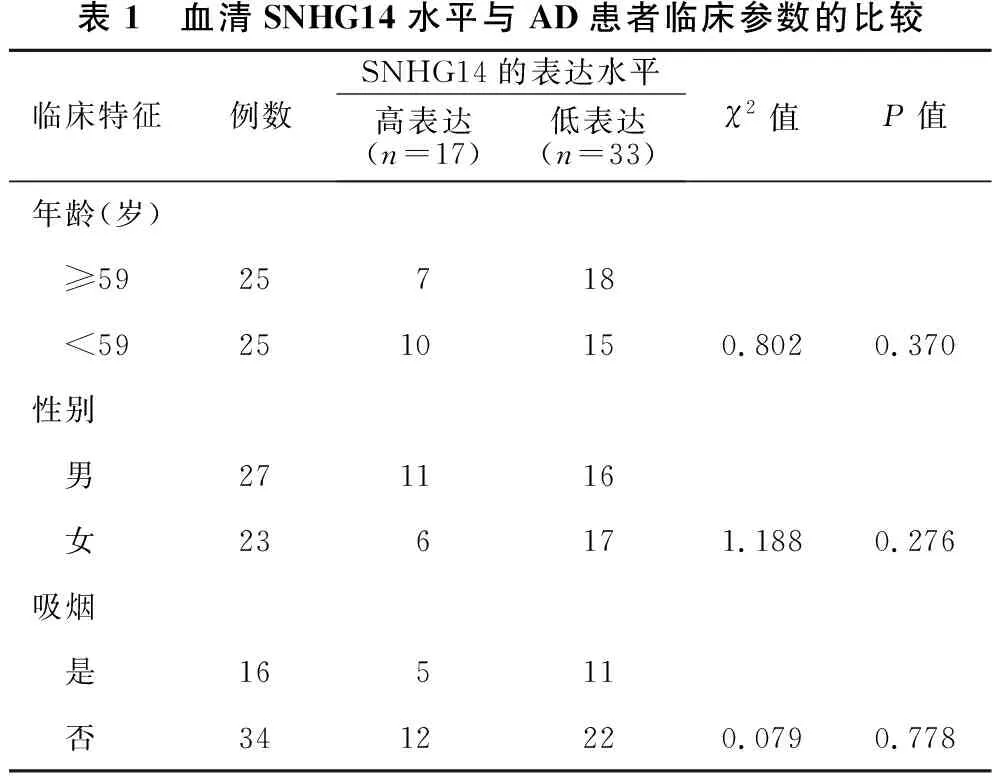
表1 血清SNHG14水平与AD患者临床参数的比较临床特征例数SNHG14的表达水平高表达(n=17)低表达(n=33)χ2值P值年龄(岁) ≥5925718 <592510150.8020.370性别 男271116 女236171.1880.276吸烟 是16511 否3412220.0790.778
2.3 HT-22细胞中敲低SNHG14后ATG5表达的比较 见图2。小鼠神经元细胞HT-22中敲低SNHG14后,ATG5表达较正常对照组明显下降,对照组ATG蛋白灰度值为(307 882±3 832),SNHG14敲低组ATG蛋白灰度值为(268 420±670),差异具有统计学意义(t=10.15,P=0.0005)。

图2 HT-22细胞中敲低SNHG14后对ATG5蛋白表达量的影响
3 讨 论
SNHG14是近年来在肿瘤组织中发现的,在肿瘤发生发展过程中起促进作用的长链非编码RNA[11],近年来多项研究关注于其在神经系统疾病中作用。Carmel等[12]发现SNHG14参与神经发育,其表达下降可能与精神分裂症发病相关;缺血性脑卒中发病过程中SNHG14可通过调控miR-145-5p和PLA2G4A蛋白来促进小胶质细胞的活化;在帕金森病中SNHG14表达降低,解除其对miRNA133b表达水平的抑制作用,最终导致多巴胺能神经元细胞损伤[13-14]。但其在AD发病过程中的作用尚无相关研究报道。本研究使用RT-qPCR技术检测AD患者血清中SNHG14含量,并与年龄相配的正常人群相对比,发现AD患者血清中SNHG14水平明显下降,说明SNHG14可能参与AD发生发展过程。同时本研究将SNHG14相对表达量与AD患者的性别、年龄、是否吸烟等对比后发现,AD患者的SNHG14表达量与性别、年龄、生活习性等均无相关性,SNHG14表达量降低只发生于AD患者中,说明SNHG14具有不受其他因素影响而独立作为AD诊断标志物的潜力。
为了进一步研究SNHG14在AD疾病发展过程中作用,本研究使用小鼠神经元细胞系HT-22细胞,敲低SNHG14表达模拟AD发病时SNHG14表达下降状态后发现,SNHG14敲低后HT-22细胞中细胞ATG5表达下降,提示SNHG14可能通过参与神经元细胞自噬调节AD发生发展过程。有前期研究[13]表明,SNHG14可参与细胞自噬过程:在胰腺癌细胞中其作为小非编码RNA miR101的竞争性内源RNA,通过抑制miR101表达,刺激细胞自噬来增强吉西他滨耐药性,这与本研究结果相符,进一步证明SNHG14表达下降可能通过抑制神经元细胞自噬而导致AD发病,但其中SNHG14影响神经元细胞自噬过程具体机制尚需进行深入研究。
总之,本研究发现,与正常对照组人群相比,AD患者血清中SNHG14的表达量明显下调,且SNHG14的表达与年龄、性别、是否吸烟均无相关性,具有作为AD诊断分子生物学标志的潜力;小鼠神经元细胞中敲低SNHG14后发现细胞ATG5的表达下降,说明SNHG14可能是通过调节神经元细胞自噬而参与AD的发生发展,但其具体调节机制尚需进一步深入研究。

