1种新型冠状病毒核酸检测试剂的性能验证
张云丽,王鑫,邵玲,曲波,赵鸿梅(辽宁省人民医院 中国医科大学人民医院检验医学科,沈阳 110016)
新型冠状病毒(2019-nCoV)是β属单股正链RNA病毒,巢病毒目,冠状病毒科[1],国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》中指出新型冠状病毒肺炎确诊病例的诊断标准为有流行病学史和临床表现的疑似病例同时具备病原学或血清学证据之一者。常用的病原学检测证据即为实时荧光RT-PCR检测2019-nCoV核酸阳性[2]。目前,大部分医疗机构建立了符合生物安全二级及以上标准的临床实验室均已相继开展新型冠状病毒核酸检测项目。
根据中国合格评定国家认可委员会(China National Accreditation Service,CNAS)《医学实验室质量和能力认可准则及其在分子诊断领域的应用说明(CNAS-CL02-A009)文件要求,临床实验室开展分子诊断检验项目前必须进行检测系统的性能验证,分子诊断领域中定性检测项目验证内容至少应包括测定下限、特异性、准确度、抗干扰能力等[3-4]。本研究按照CNAS-GL039《分子诊断检验程序性能验证指南》[5],对中山大学达安公司生产的2019-nCoV核酸检测试剂盒进行性能验证,评价结果如下。
1 材料与方法
1.1样本来源 2019-nCoV RNA液体性能验证参考品(广州邦德盛公司)。浓度为2.0×106copies/mL及2.0×105copies/mL的2019-nCoV RNA假病毒核酸标准物质编号分别为GBW(E)091133及GBW(E)091132。
1.2试剂和仪器 核酸提取试剂、2019-nCoV核酸检测试剂(中山大学达安公司);DA3200核酸提取仪(中山大学达安公司),ABI 7500实时荧光PCR 仪(美国Applied Biosystems公司)。
1.3方法 按照核酸提取试剂盒说明书进行核酸提取,实时荧光RT-PCR测定按照2019-nCoV核酸检测试剂说明书操作,用ORF1ab基因和N基因作为检测靶标基因。实验条件:50 ℃ 15 min;95 ℃ 15 min;94 ℃ 15 s,55 ℃ 45 s,40个循环。使用PCR扩增设备配套软件(Real-Time PCR软件v2.4)进行数据分析。根据扩增曲线,规定合适基线(一般起始设定为3,终止设定为15)和荧光阈值,得到不同通道循环阈值(cycle threshold,Ct)。阳性标准为FAM和VIC通道有明显扩增曲线,且Ct≤40;阴性标准为FAM和VIC通道无扩增曲线或Ct值>40,且Cy5通道有扩增曲线;如仅在FAM或VIC单一通道Ct值≤40,另一条通道无扩增曲线,则结果需复检,复检结果一致可判为阳性,复检均为阴性则为阴性。
1.4性能验证方法及指标
1.4.1符合率 使用相同检测方法的ISO15189认可实验室作为参比实验室,选取阴性样本10例、阳性样本10例。按照患者样本检测程序与参比实验室进行比对,以参比实验室结果为准,计算本实验室与参比实验室的总符合率、阳性符合率和阴性符合率[5]。
1.4.2检出限 待验证试剂盒说明书中声明的检出限为500 copies/mL。使用2019-nCoV RNA假病毒核酸标准物质与用于稀释的不含有2019-nCoV RNA、无基质效应的核酸保养液共同制备的2019-nCoV RNA阳性样本,浓度分别在2.0×106copies/mL、2.0×105copies/mL、2.0×104copies/mL、2.0×103copies/mL、5.0×102copies/mL、2.5×102copies/mL和1.25×102copies/mL 7个水平,在定性结果为阳性、浓度水平最低的标本所对应的浓度值即为该试剂的检出限,该检出限符合试剂说明书标准且每份样本重复测定5次,100%检出靶核酸,则检出限验证合格。
1.4.3交叉反应 验证与检测对象可能存在交叉反应的核酸物质对检测的影响,主要指检测对象核酸序列具有同源性、易引起相同或相似临床症状的病原体核酸。本实验使用的分析特异性参考品来自广州邦德盛公司生产的标准物质。每份分析特异性参考品重复测定3次,结果都为阴性则交叉反应验证合格。
1.4.4精密度 检测浓度水平分别为2.0×103copies/mL和2.0×105copies/mL的精密度参考品,添加空白对照,每份样本重复测定2次,连续测定5 d,计算各靶基因Ct值的变异系数(CV),评价批间不精密度;同一份样本重复测定10次,计算Ct值的CV,评价重复性(批内不精密度)。精密度符合说明书声明范围则验证合格[6]。
1.4.5抗干扰能力 检测含有内源性干扰物质血红蛋白30 g/dL和清蛋白6 g/dL、外源性干扰物质利巴韦林+阿奇霉素100 μg/mL的浓度为2.0×103copies/mL的弱阳性样本,样本来源于广州邦德盛公司生产的标准物质,与常规样本一样处理,重复测定3次,检测结果为弱阳性,则抗干扰能力验证合格。
2 结果
2.1符合率 本试剂检测结果与参比实验室检测结果进行比对,发现10例阳性标本(P1、P2、P3、P4、P5、P6、P7、P8、P9、P10)ORF1ab基因和N基因Ct值均<37,10例阴性标本(P11、P12、P13、P14、P15、P16、P17、P18、P19、P20)均未检出Ct值,总符合率、阳性符合率和阴性符合率均为100%,符合率验证合格。
2.2检出限 在检测下限验证中,本试剂盒对2.0×106copies/mL、2.0×105copies/mL、2.0×104copies/mL、2.0×103copies/mL、5.0×102copies/mL、2.5×102copies/mL和1.25×102copies/mL 7种浓度的2019-nCoV RNA阳性样本的检出率均为100%,见图1。结果符合试剂说明书声明标准,检出限验证合格。
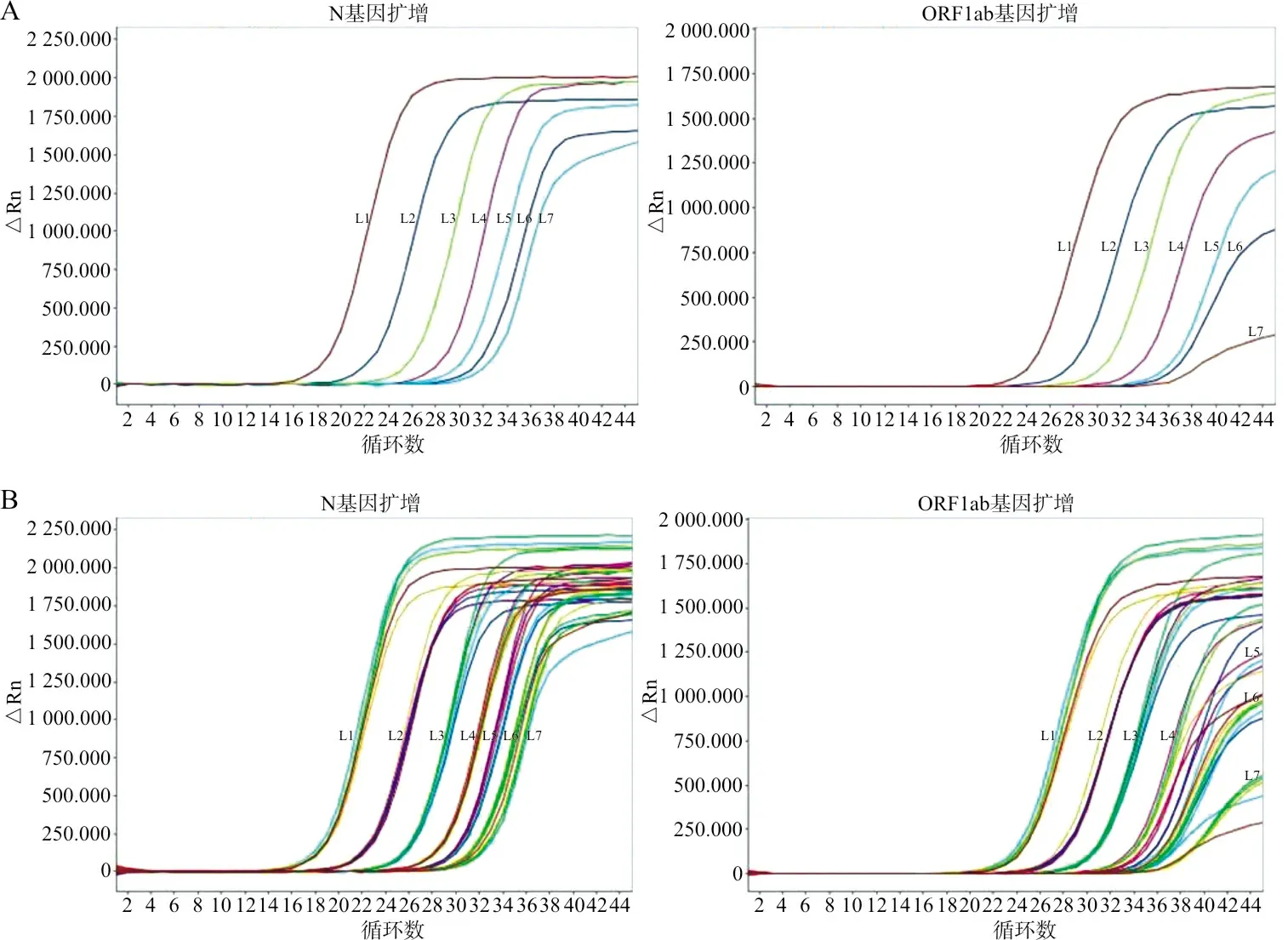
注:A,单个样本的检出限验证;B,所有样本的检出限验证。从左至右分别为:L1,2.0×106 copies/mL;L2,2.0×105 copies/mL;L3,2.0×104 copies/mL;L4,2.0×103 copies/mL;L5,5.0×102 copies/mL;L6,2.5×102 copies/mL;L7,1.25×102 copies/mL。
2.3交叉反应 交叉反应验证中,检测含有人冠状病毒HCoV-OC43 RNA假病毒、人冠状病毒HCoV-HKU1 RNA假病毒、人冠状病毒HCoV-229E RNA假病毒、人冠状病毒HCoV-NL63 RNA假病毒、SARS冠状病毒RNA假病毒、中东呼吸综合征(MERS)冠状病毒RNA假病毒、甲型流感病毒RNA阳性、乙型流感病毒RNA阳性、呼吸道合胞病毒A+B型阳性、人副流感病毒阳性、腺病毒阳性、肠道病毒阳性、肺炎支原体阳性、EB病毒阳性、人巨细胞病毒阳性、结核分枝杆菌阳性的2019-nCoV阴性样本,重复3次的N基因及ORF1ab基因检测结果均为未检出。
2.4精密度 重复性验证中,2.0×103copies/mL浓度水平的N基因CV为0.70%,ORF1ab基因CV为0.48%;2.0×105copies/mL浓度水平的N基因CV为1.36%,ORF1ab基因CV为0.52%。批间不精密度验证中,2.0×103copies/mL浓度水平的N基因CV为1.17%,ORF1ab基因CV为1.36%;2.0×105copies/mL浓度水平的N基因CV为1.72%,ORF1ab基因CV为2.39%。CV符合试剂说明书要求标准(<5%),精密度验证合格。
2.5抗干扰能力 加入内源性干扰物质、外源性干扰物质的浓度为2.0×103copies/mL的弱阳性样本重复测定3次的检测结果均为阳性,抗干扰能力验证合格。
3 讨论
2019-nCoV核酸检测作为新型冠状病毒肺炎的确诊手段,在快速诊断、疗效评估、疫情防控中发挥重要作用[7]。疫情突发初期,很多核酸检测试剂一经研发出来就投入临床,没有进行足够的性能验证,可能导致的假阴性结果使得核酸检测在新型冠状病毒肺炎诊治中的意义被临床医生所质疑[7]。而性能验证是保证检测结果稳定可靠的重要基础,是临床应用的前提,对检测标准化和质量控制有重要的意义[8]。
本研究所验证的核酸检测试剂基于一步法实时荧光RT-PCR技术,选取2019-nCoV ORF1ab和N基因作为扩增靶区域,设计特异性引物及荧光探针(N基因探针采用FAM标记,ORF1ab探针采用Yellow标记)用于标本中2019-nCoV RNA的检测,同时包括内源性内标检测系统(内标基因探针采用Cy5标记),用于对标本采集、核酸提取过程及PCR扩增过程的监控。与两步法相比,一步法检测技术不仅可缩短检测时间,更可减少实验过程中样品交叉污染的可能性,尤其适合大批量样本操作[9]。使用的性能验证参考品是以新型冠状病毒假病毒培养液为原料,包含新型冠状病毒重要特征基因核壳蛋白N基因(全长)、包膜蛋白E基因(全长)和ORF1ab(1)(全长),用稀释液稀释制备成所需系列性能评价参考品盘,具有均匀、稳定、与临床样本具有良好的互通性的特点。
在符合率评价中,本实验室与另外一家通过ISO15189认可实验室的符合率为100%。在交叉反应的评价中,结果显示该试剂盒检测结果与2019-nCoV种属相近或引起症状相似的其他病原体(人冠状病毒HCoV-OC43、人冠状病毒HCoV-HKU1、人冠状病毒HCoV-229E、人冠状病毒HCoV-NL63、SARS冠状病毒、MERS冠状病毒、甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、人副流感病毒、腺病毒、肠道病毒、肺炎支原体、EB病毒、人巨细胞病毒、结核分枝杆菌)以及人基因组DNA无交叉反应。在精密度评价中,不同浓度水平的N基因重复性为0.70%及1.36%,批间不精密度为1.17%及1.72%;ORF1ab基因重复性为0.48%及0.52%,批间不精密度为1.36%及2.39%,符合说明书要求标准(<5%)。在抗干扰能力评价中,样本中内源性干扰物血红蛋白及清蛋白、外源性干扰物利巴韦林及阿奇霉素对试剂盒的检测结果无干扰。在检出限评价中,结果显示该试剂盒检出限为125 copies/mL,虽达到厂商声明的标准,但是仍不足以达到理想的检出限,如果临床医护人员在采样过程中未采集到足量的病毒或感染初期人口咽部病毒含量低时,都可能会导致结果假阴性[10]。在与临床的沟通中,建议为多次复查核酸结果阴性却有明显临床症状的患者采集深咳痰液或肺泡灌洗液来提高阳性检出率[11],因此,后续试剂盒优化的重点应是如何在不降低特异性的情况下不断提高检出限。

