不同检测系统对新型冠状病毒核酸的检测结果分析
崔蕾蕾,夏爱华,王伟,邵可可(盐城市第一人民医院检验科,江苏盐城 224001)
核酸检测是新型冠状病毒肺炎(corona virus disease 2019,COVID-19)确诊的重要手段。常用的核酸检测方法有实时荧光RT-PCR、转录介导的恒温扩增、高通量测序、PCR-飞行时间质谱、PCR-基因芯片[1-2]。为了解我国新型冠状病毒(2019 novel coronavirus,2019-nCoV;国际病毒分类委员会将2019-nCoV命名为SARS-CoV-2)核酸检测的开展现状及质量状况,帮助临床实验室发现检测中存在的问题并进行改进,使得核酸检测在疾病防控工作中更好地得到应用,国家卫生健康委临床检验中心于2020年3月16日—24日开展了2019-nCoV核酸检测室间质量评价活动,本实验室参加了此次室间质评活动,并用本实验室使用的2种品牌提取仪、2种扩增试剂及2台扩增仪组合出的8个检测系统对质评标本进行检测,以了解不同检测系统的检测能力差异,为实验室选择检测试剂提供指导。
1 材料与方法
1.1标本来源 国家卫生健康委临床检验中心于2020年3月16日—24日发放的12个2019-nCoV核酸检测室间质量评价样本,编号分别为202001、202002、202003、202004、202005、202006、202007、202008、202009、202010、202011、202012。本次室间质评样本均为国家卫生健康委临床检验中心制备,为基因工程方法制备的噬菌体病毒样颗粒模拟样本,无生物传染危险性。
1.2仪器与试剂 32通道全自动核酸提取仪AU1001及磁珠法核酸提取试剂盒(无锡百泰克公司)(a),全自动核酸提取仪SSNP-3000A及磁珠法核酸快速提取试剂盒(江苏硕世公司)(b),实时荧光定量PCR仪7300 Plus(美国ABI公司)(c),实时荧光定量PCR仪CFX96(美国Bio-Rad公司)(d),2019-nCoV核酸检测试剂盒(荧光PCR法,上海伯杰公司)(e),新型冠状病毒(2019)核酸检测试剂盒(荧光PCR法,江苏硕世公司)(f)。
1.3方法
1.3.1RNA提取 用全自动核酸提取仪a及b及配套试剂分别提取12个质评样本,严格按照说明书进行提取。
1.3.2核酸扩增 分别用2019-nCoV核酸检测试剂盒e及f,对2种提取仪提取的核酸,分别在扩增仪c及d上进行扩增,按照试剂盒说明书设置上机的扩增检测参数和程序。由此分成下列检测系统,A:b+f+d;B:b+e+d;C:b+f+c;D:b+e+c;E:a+f+d;F:a+e+d;G:a+f+c;H:a+d+c。
1.3.3质量控制 每批次检测设立1份弱阳性质控及3份阴性质控,阴性质控随机放在临床样本中。弱阳性质控测定为阳性,3个阴性质控结果全部为阴性,视为在控,否则为失控,不可发出报告,应立即分析原因,必要时需重新检测。
1.3.4结果分析与报告
1.3.4.1基线与阈值设定 根据分析后的荧光曲线进行参数的微调,基线取6~15个循环的荧光信号(每个检测批次最先起跳的荧光曲线起跳前1~2个循环处),阈值设定以阈值线刚好超过阴性质控检测荧光曲线的最高点。
1.3.4.2结果分析 有内标的试剂盒,先分析内标通道是否有扩增曲线,若有,表示本次检测结果有效,可进行结果的分析;若待检靶基因通道检测到典型S型扩增曲线,且Ct≤设定阈值,表示该靶基因“检出”;若“待测靶基因”通道未检测到典型S型扩增曲线,或Ct>设定阈值,表示该靶基因“未检出”。若内标通道未检出Ct或Ct>设定值,表示本次检测样本浓度太低或者有干扰抑制反应,须重新检测。
1.3.4.3结果判断 要确认某病例为阳性,须满足以下条件:同一份标本中2019-nCoV至少2个靶标(ORF1ab/N/E)实时荧光RT-PCR检测结果均为阳性。如1个靶基因阳性或检测结果落在设置的灰区内,标本需进行复测或选用另1种试剂再测,如结果仍然可疑则须重新采样(不同部位或不同样本类型)进行检测。2种试剂结果判断标准见表1。
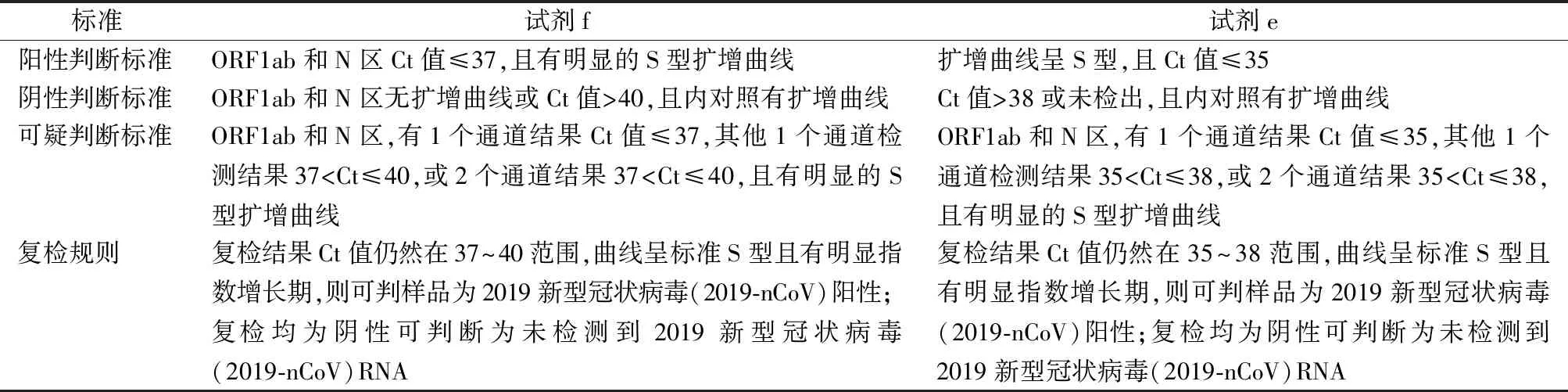
表1 不同核酸检测试剂结果判断标准
2 结果
2.1提取试剂b提取核酸的检测结果 提取试剂b提取的核酸分别用扩增试剂e和f,在扩增仪c及d上进行扩增,检测结果Ct值见表2。
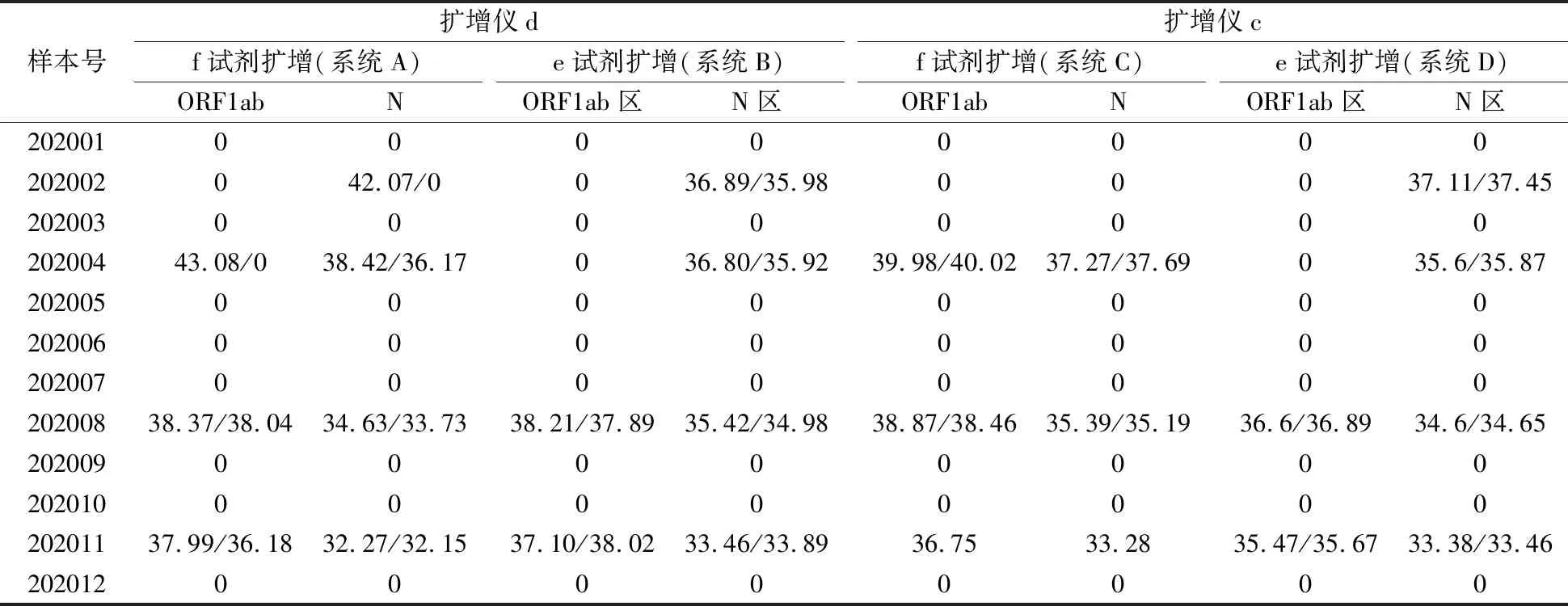
表2 快速提取试剂b提取核酸的Ct值
2.2提取试剂a提取核酸的检测结果 提取试剂a提取的核酸分别用扩增试剂e和f,在扩增仪c及d上进行扩增,检测结果Ct值见表3。

表3 提取试剂a提取核酸的Ct值
2.3各检测系统实际检测结果 12个室间质评样本中,202003及202009未纳入统计指标,其余10个样本的预期检测结果为5份2019-nCoV阳性,5份2019-nCoV阴性。8个检测系统实际检测结果见表4。8个检测系统均检测出202004、202008、202011,均未检出202010(128 copies/mL);对202002(640 copies/mL),只有B及D 2个检测系统检出,其余均未检出。
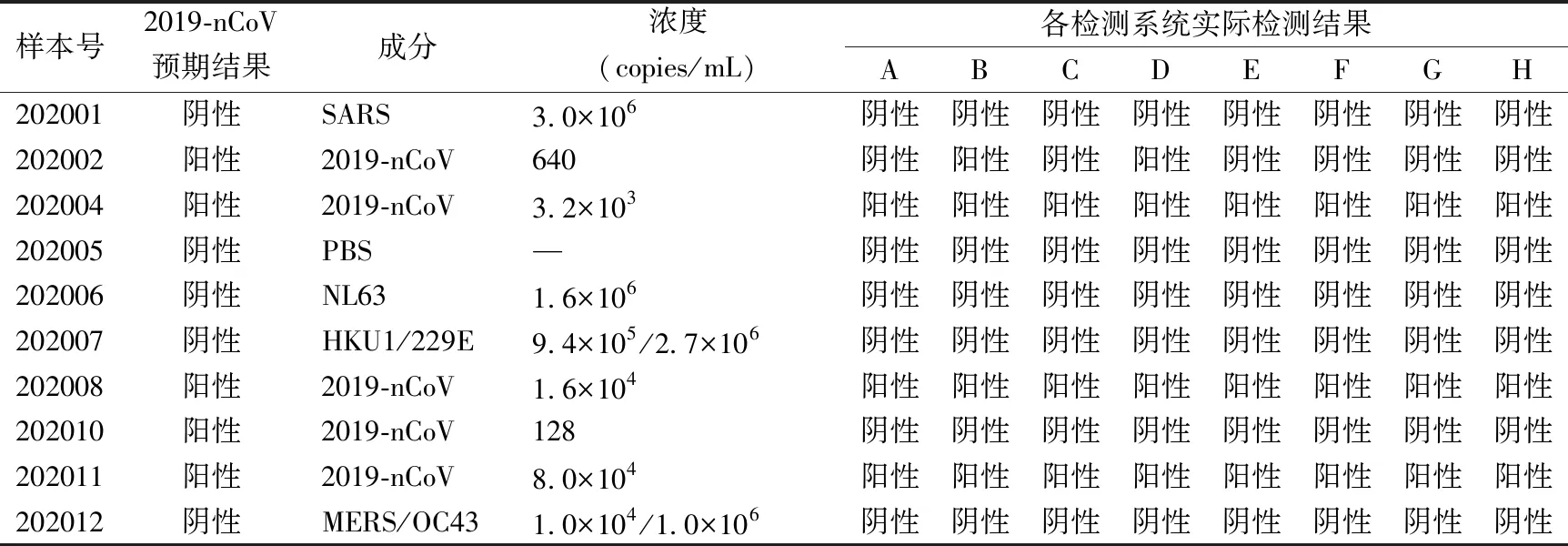
表4 各检测系统实际检测结果与预期检测结果比较
2.4不同检测系统对阳性结果各靶区域的检测情况 2种扩增试剂扩增的靶区域相同,均为ORF1ab及N基因,8个检测系统对2个靶区域的检测结果见表5、表6。N基因的检测发现,8个检测系统对于病毒载量高的样本的检测能力相同,主要区别在于对病毒拷贝数低的样本的检测能力存在差异,B及D检测系统优于其他检测系统,起主导作用的主要是B及D 2个检测系统所使用的e扩增试剂的检测能力优于A及C检测系统所使用的f扩增试剂。对于ORF1ab基因检测发现,A-D检测系统检测到的ORF1ab基因的阳性率高于E-H检测系统,A-D检测系统均使用的是b快速提取试剂,而E-H检测系统使用的是a提取试剂,提取试剂的提取效率对检测结果影响较大。
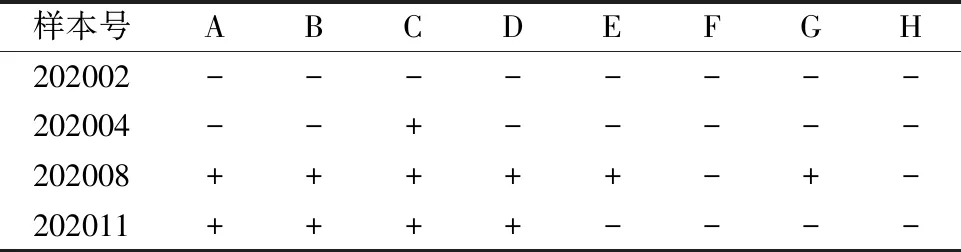
表5 不同检测系统阳性结果的ORF1ab靶区域检测情况

表6 不同检测系统阳性结果的N靶区域检测情况
3 讨论
本次室内质评的5份阳性样本中,要求实验室能够检出202011(8×104copies/mL)、202008(1.6×104copies/mL)、202004(3.2×103copies/mL)、202002(640 copies/mL)4个浓度水平的样本。8个检测系统均检测出202004、202008、202011;主要的问题存在于对640 copies/mL弱阳性样本检出能力。由于202002(640 copies/mL)病毒拷贝数均低于f扩增试剂及e扩增试剂的检测下限,8个检测系统中,只有B及D 2个检测系统检出,其余均未检出。B及D检测系统中,提取试剂均为b快速提取试剂,扩增试剂均为e扩增试剂,扩增仪分别为c及d,提取试剂及扩增仪相同的A及C检测系统却未检出,说明其差别主要在于扩增试剂不同,2种扩增试剂均使用实时荧光RT-PCR 法,虽然2种检测试剂声称的分析灵敏度均为1 000 copies/mL ,但从实验结果来看,2种试剂的分析灵敏度存在差异。扩增试剂e各阳性样本检测的符合率总体优于f扩增试剂。导致检测假阴性的原因涉及核酸提取和检测2个过程。
本实验室使用的核酸提取方法为自动化仪器+磁珠提取法,使用的核酸提取试剂种类为2种。2种核酸提取试剂的磁珠吸附效率、用于核酸提取的样本量、洗脱体积也各有不同,因此,即使2种提取试剂磁珠吸附效率相同,提取核酸浓度亦不相同。本实验结果发现,阳性标本经提取试剂b提取的靶基因检出率高于提取试剂a,同时其Ct值亦较a低。
目前,多数试剂厂家选择2019-nCoV核酸序列的2个或2个以上的区域进行检测,ORF1ab、N区和E区是常见的检测区域[3]。本实验室使用的2种扩增试剂都是检测ORF1ab、N区,不同靶区域的敏感性也存在差异。本次室间质评样本为ORF区和N区连接在一起的病毒样颗粒,因此ORF和N区的数量完全一致,但是2种扩增试剂对2个区域检测的阳性率差异明显。总的来说,N区的阳性率高于ORF区,病毒拷贝数越低,这一现象越显著。
本次室间质评含有5份2019-nCoV阴性样本,主要考核检测的特异性以及是否存在实验室污染。从实验结果来看,8个检测系统对5份阴性样本均为未检出,与预期结果相符,未发现假阳性,说明本室使用的2种扩增试剂与其他冠状病毒无交叉反应。
本研究使用的样本为基因工程方法制备的噬菌体病毒样颗粒模拟样本,与人体标本基质不同,可能导致不同核酸提取试剂对其处理能力的不同而使得结果产生差异,结果不能完全代表实际检测结果。另外,本研究仅仅对各试剂某一批号的检测能力作了简要比较分析,并且由于样本数量有限,也不能完全代表试剂的总体检测性能。因缺乏2019-nCoV核酸阳性样本,如有条件,应使用阳性样本代替室间质评样本,同时扩大样本数量,进一步对核酸提取试剂的提取质量、检测试剂性能等指标进行有效评价。
实验室应尽量选用配套检测系统,如选用非配套系统,应该对配套系统与非配套系统进行比对,确保所选用的检测系统检测结果的准确性。同时,实验室应使用参与核酸提取过程的弱阳性样本和多份(如 3 份)阴性样本,进行室内质量控制,以有效监测实验室对弱阳性样本的检测能力和实验室污染;还应加强人员实验操作和结果解读能力的培训。

