过敏原特异性IgE抗体定量检测试剂的性能验证
杜文胜,朱杰华,潘丽,黎兵,何应中,陈莉,黄俊琼(. 遵义医科大学附属医院医学检验科,贵州遵义 563003;. 玉溪市人民医院检验科,云南玉溪 65300)
临床常见的过敏性疾病以Ⅰ型变态反应为主,即由IgE抗体所介导,多表现为过敏性鼻炎、特异性皮炎、过敏性哮喘等症状,发病率逐年上升[1-2]。过敏原IgE抗体检测对于反映病情、协助诊断、预测疾病的发生和预后具有重要作用,已被纳入多项过敏性疾病的临床诊疗指南[3-7],其试剂的性能直接影响过敏性疾病的临床诊疗,定量检测数据有助于减少实验室偏差[8]。国内临床检验领域尚缺乏过敏原试剂定量检测试剂性能验证的统一标准。本研究对一种国产过敏原特异性IgE抗体定量检测试剂盒进行性能验证,参考美国临床和实验室标准协会(clinical and laboratory standards institute, CLSI)2016年文件(I/LA 20, 3rd ed. October 2016)[9]及中华人民共和国医药行业标准YY/T 1581-2018[10]进行,验证指标覆盖试剂说明书描述的性能指标。同时,对6个重点项目(屋尘螨、粉尘螨、屋尘、艾蒿、鸡蛋、牛奶)与ImmunoCAP系统的定性与定量一致性进行比较,数据汇总如下。
1 材料与方法
1.1临床样本 验证试验样本取自遵义医科大学附属医院2019年1月1日至2020年1月1日门诊患者的临床常规检测剩余血清,所有样本排除溶血、脂血,并免除知情同意。其中,特异性验证样本4份,分别为总IgE浓度>60 IU/mL且特异性IgE为阴性的样本、IgA浓度>700 μg/mL的样本、IgM浓度>500 μg/mL的样本、IgG 浓度>7 000 μg/mL的样本;一致性比较样本639份,均用江苏浩欧博公司试剂检测过敏原IgE抗体,过敏原为屋尘螨150例(阳性99例,阴性51例),粉尘螨150例(阳性98例,阴性52例),屋尘75例(阳性35例,阴性40例),艾蒿65例(阳性36例,阴性29例),鸡蛋105例(阳性77例,阴性32例),牛奶共94例(阳性61例,阴性33例)。根据过敏原诊断试剂国际分级标准进行特异性IgE分级:0.35 U/mL≤1级<0.7 U/mL,0.7 U/mL≤2级<3.5 U/mL,3.5 U/mL≤3级<17.5 U/mL,17.5 U/mL≤4级<50 U/mL,50 U/mL≤5级<100 U/mL为5级,≥100 U/mL为6级。
1.2仪器与试剂 URANUS AE-95型全自动酶免仪(深圳爱康公司),Phadia 250全自动体外荧光免疫分析系统(瑞典Phadia AB公司);待验证试剂:符博克TM过敏原特异性IgE抗体定量检测试剂(免疫捕获法,过敏原共21项:总IgE、屋尘螨、粉尘螨、艾蒿、普通豚草、蟑螂、猫上皮、狗上皮、屋尘、交链孢霉、柳树、花生、鸡蛋、牛奶、鳕鱼、小麦面粉、虾、大豆、蟹、牛肉、羊肉,江苏浩欧博公司);比对试剂: ImmunoCAP特异性IgE定量检测试剂(瑞典Phadia AB公司);参考物质:血清IgE的第3代国际标准品WHO 11/234(英国国家生物标准和控制研究所,相对偏差试验用)。
1.3方法
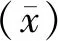
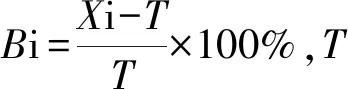
1.3.3检出限 (1)行标推荐做法:选择6个过敏原(屋尘螨、粉尘螨、屋尘、艾蒿、牛奶、鸡蛋)特异性抗体项目进行检测。对5份浓度近似试剂说明书中声称的检出限0.35 IU/mL(浓度值介于0.30~0.35 IU/mL,吸光度范围0.050~0.085)的样本进行检测,每份样本检测5次,共计25次,对检测值进行统计。
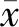
1.3.4线性 选择6个过敏原(屋尘螨、粉尘螨、屋尘、艾蒿、牛奶、鸡蛋)特异性抗体项目进行检测。用体检血清样本(6项检测结果均为阴性)稀释接近试剂说明书中声称的线性区间上限的高浓度样本(80~100 IU/mL以内),混合成5个稀释浓度(Xi),用待验证试剂分别检测以上样本,每个稀释浓度检测3次,分别求出每个稀释浓度检测结果的均值(Yi)。以稀释浓度(Xi)为自变量,检测结果均值(Yi)为因变量,绘制散点图,以最小二乘法进行线性拟合,求出线性回归方程,计算相关系数(r)。
1.3.5特异性 用URANUS AE-95型全自动酶免仪操作,对20个项目用总IgE浓度>60 IU/mL且特异性IgE为阴性的样本、IgA浓度>700 μg/mL的样本、IgM浓度>500 μg/mL的样本、IgG浓度>7 000 μg/mL的样本进行检测,对测定结果进行统计。
1.3.6一致性比较 重点考察待验证试剂与ImmunoCAP试剂在屋尘螨(D1)、粉尘螨(D2)、屋尘(H1)、艾蒿(W6)、牛奶(F2)、鸡蛋(F252)6个项目中的一致性,其余项目因阳性样本过少不构成统计学意义而未纳入比对研究。所有一致性比较样本全部送贵阳金域医学检验所有限公司用Phadia 250全自动体外荧光免疫分析系统进行平行检测,按其试剂盒说明书进行操作。计算2种方法检测结果的定性一致性(阴阳性符合率、总符合率、Kappa系数)和定量相关性。
2 结果
2.1精密度
2.1.1重复性 20种过敏原特异性IgE抗体2个浓度的CV均<10%,低于试剂说明书要求的不精密度(<15%),符合行业标准要求中重复性的CV仪器操作应≤10%的要求。见表1。
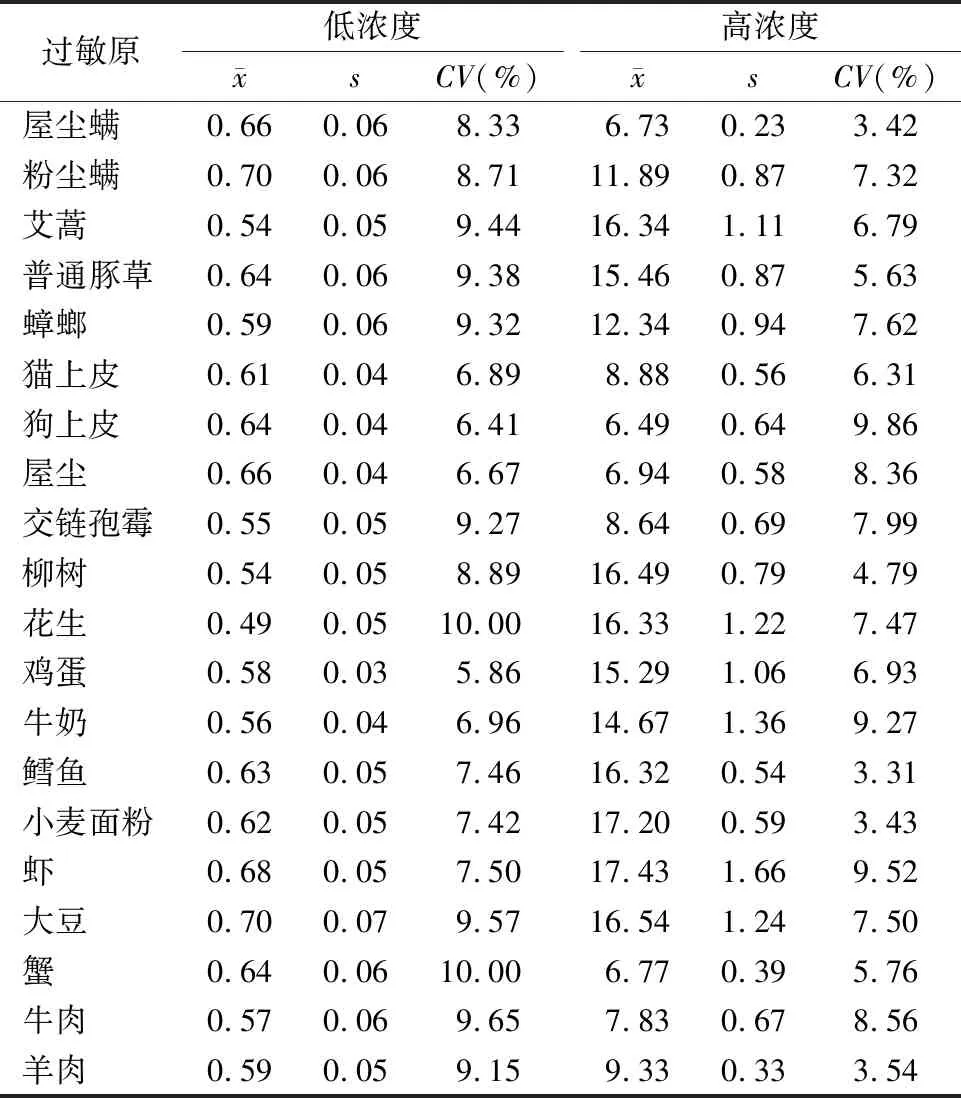
表1 20种过敏原项目的精密度
2.1.2批间不精密度 6个重点项目(屋尘螨、粉尘螨、屋尘、艾蒿、牛奶、鸡蛋)使用3个批号试剂盒(20190909、20191012、20191113)进行检测,批间CV均<20%。其中低浓度样本(浓度值介于0.51~0.71 IU/mL)6个项目的CV依次为13.82%、13.10%、13.33%、9.61%、15.27%、19.64%;高浓度样本(浓度值介于7.22~17.36 IU/mL)6个项目的CV依次为17.40%、6.86%、9.56%、13.19%、11.10%、12.43%。均符合行业标准要求(≤20%)。
2.2准确度
2.2.1准确度——相对偏差试验 对定值浓度为5 IU/mL、50 IU/mL、500 IU/mL的WHO 11/234低、中、高3个浓度的样本用待验证试剂进行总IgE项目检测,重复3次,每次的Bi均在±15%以内,符合要求,见表2。

表2 WHO IgE参考物质相对偏差试验结果
2.2.2准确度——添加回收试验 对20个过敏原项目进行添加回收试验,回收率均在85%~115%之间,符合行业标准要求,见表3。
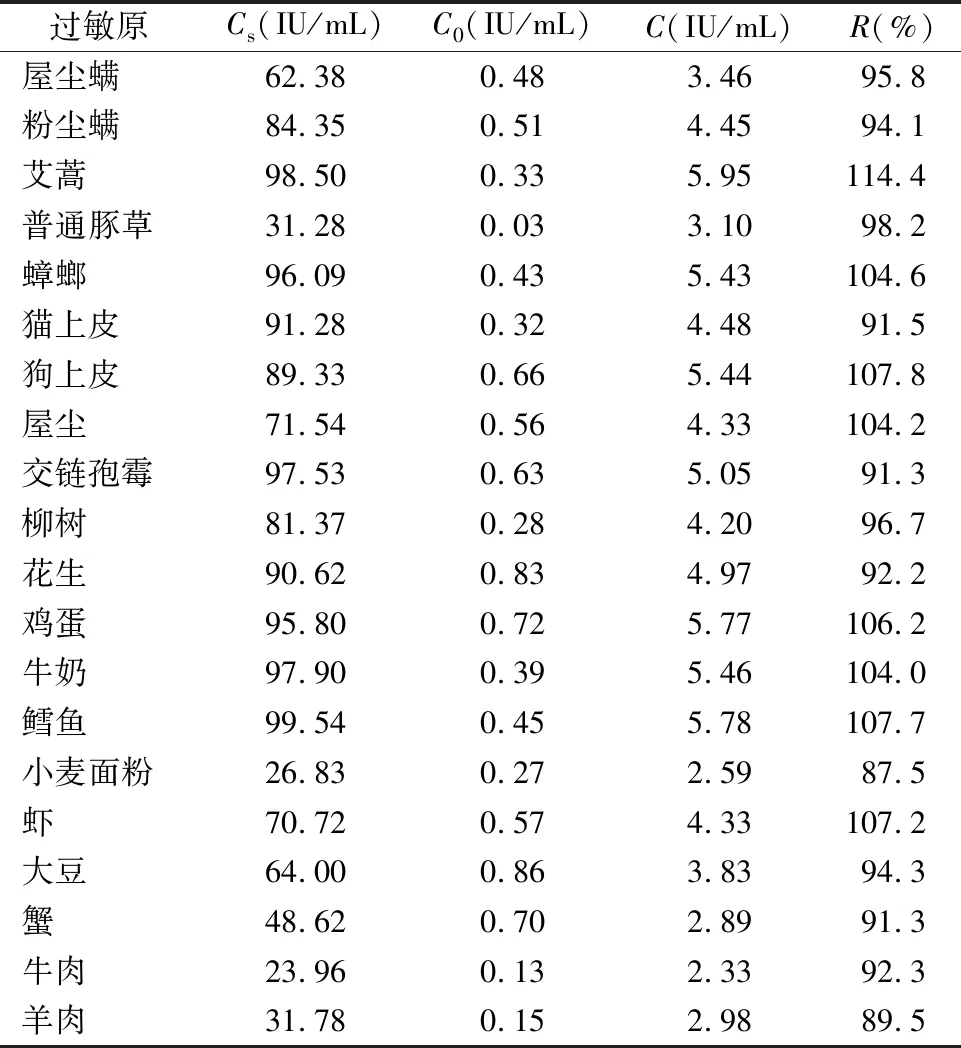
表3 20种过敏原项目添加回收试验结果
2.3检出限
2.3.1检出限——行标方法 对6个项目各25次检测结果进行统计。对屋尘螨、粉尘螨、屋尘3个项目,25次中分别都有2次检测值超过参考区间下限(0.35 IU/mL),未能符合行标要求;而艾蒿、鸡蛋、牛奶25次中均没有高于参考区间下限(0.35 IU/mL)的检测结果,符合行标要求,故该性能指标部分通过。
2.3.2检出限——CLSI方法 6种过敏原的LOB均在0.10 IU/mL以内,LOD均在0.20 IU/mL以内,不高于说明书声明的0.35 IU/mL,符合要求,见表4。
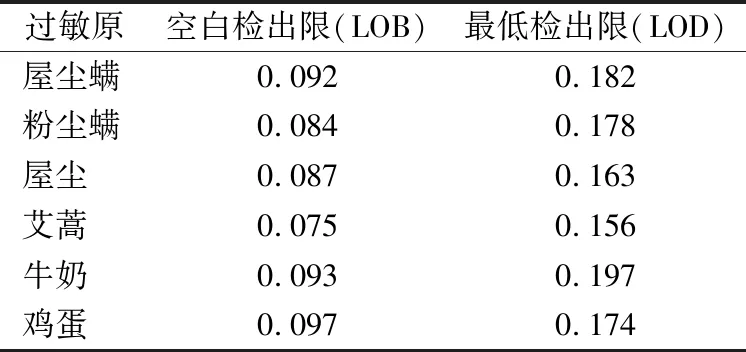
表4 6种过敏原项目的检出限结果(CLSI方法)
2.4线性 6种过敏原项目均有较好的线性关系,相关系数均>0.990,符合要求,见表5。

表5 6种过敏原特异性IgE抗体的线性关系
2.5特异性 对20个项目使用总IgE>60 IU/mL、IgA>700 μg/mL、IgM>500 μg/mL、IgG>7 000 μg/mL多种干扰物质样本进行检测,测定结果均不高于检出限(0.35 IU/mL),符合行业标准要求。
2.6一致性比较 6个过敏原项目与ImmunoCAP方法学比对的阴阳性符合率、Kappa值见表6,Kappa值均>0.75,说明2种方法学具有较好的一致性。
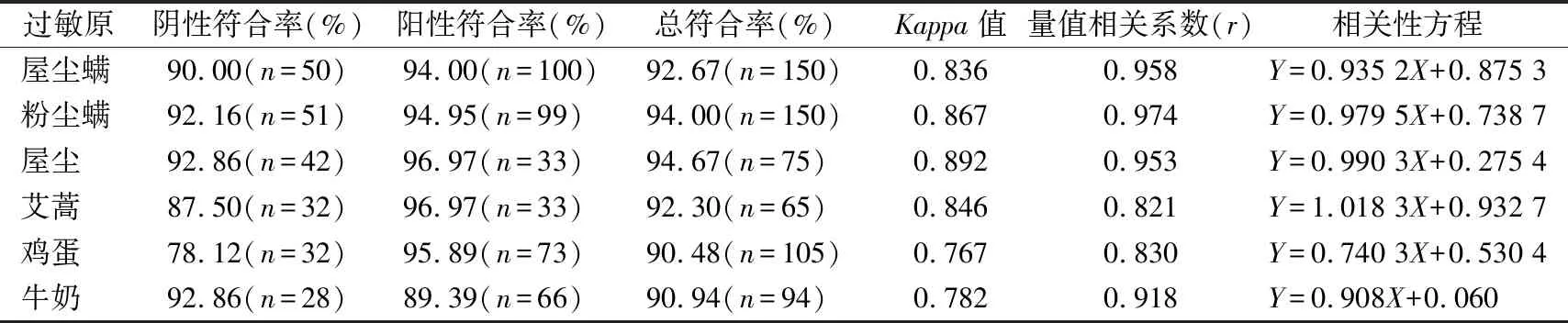
表6 6种过敏原项目的一致性比较结果
3 讨论
过敏原特异性IgE的临床检测分为定性和定量2种,目前国内使用的试剂仍以定性为主,远落后于国外。近年来定量检测正逐渐成为一种趋势[8]。本研究对该定量试剂的准确度进行检测,使用WHO IgE标准品对总IgE项目进行检测,低、中、高3个浓度的偏差均在15%以内,其中中浓度的偏差最小,在5%以内,低浓度和高浓度偏差稍大,有个别超过10%,可能与该系统采用的方法学有关。酶联免疫捕获法是ELISA的改进,使用的仍然是聚苯乙烯固相载体和四甲基联苯胺底物[11],由于线性范围受限,标准曲线在低端和高端受到压缩,当吸光度值稍有波动时,就会对标准曲线拟合换算后浓度产生较大影响,因此低端和高端波动稍大。在准确度的添加回收实验结果中,20项过敏原的回收率均在85%~115%之间,满足标准,说明回收率较高,准确度验证通过。
本研究验证的“检出限、线性、批间差、一致性比较”项目由于需要较大样本体积和高值过敏原阳性样本,本院仅收集获得6个常见项目的阳性样本可以满足需求,因此未能全部验证。在检出限实验中,2018年行标与2016年美国CLSI操作方法有较大的不同,因此2种验证方法均进行验证。行标要求使用的5份浓度近似检出限(0.35 IU/mL)的低值样本,均通过阳性血清样本稀释获得,屋尘螨、粉尘螨、屋尘3个项目分别都有1个样本的2次检测数值超过参考区间下限(0.35 IU/mL),未能符合行标要求,可能原因是这些样本稀释后得到的浓度过于接近临界值,因而稍有波动就会高于检出限。而使用CLSI推荐方法验证后,LOB均<0.10 IU/mL,LOD均<0.35 IU/mL,满足说明书标准和行业标准。由于行业标准中“浓度近似检出限样本”的概念过于模糊,样本配制的主观影响因素大,因此CLSI方案更适合用于检出限的性能验证。另外,该系统的重复性<10%、批间差<20%、线性r>0.99,均符合相关标准,验证通过。
在一致性比较中,对该系统和ImmunoCAP系统进行了6个项目的比对验证。ImmunoCAP系统被欧洲过敏反应与临床免疫学会视为体外诊断过敏性疾病的“参考方法”[12],该法在国际上应用最为广泛,可实现全自动逐项定量检测单种过敏原,敏感性、特异性均较佳。但由于每检测一项过敏原约需耗费1~2 μg的过敏原原料,导致成本和收费高昂、使用客户有限[13]。6个项目Kappa系数均>0.75,说明2种方法学在定性结果上一致性较好,符合国家ISO15189标准;屋尘螨、粉尘螨、屋尘、艾蒿项目Kappa值均>0.80,说明定性结果几乎完全一致,而牛奶和鸡蛋项目的Kappa系数<0.80,则在定性结果上差异稍大。从量值结果来看,屋尘螨、粉尘螨、屋尘、牛奶4个项目量值相关系数r均>0.9,说明量值具有很高的相关性,而鸡蛋和艾蒿项目r<0.9,量值相关性稍差。过敏原原材料是决定过敏原检测结果的重要因素[14],原料成分复杂,每种过敏原的致敏组分均不止一种,不同生物物种亚型不同,也使得原材料产生差异[15]。有些过敏原若使用天然过敏原提取物,可能会缺少过敏原组分或仅存在少量过敏组分而产生假阴性结果,试剂会通过向过敏原提取物内掺加少量过敏组分来解决此问题[13]。该国产检测试剂大多数原料来源于国内及自主研发,而ImmunoCAP系统的试剂原料主要来自瑞典,不同地域的物种来源可能存在差异,这或许是艾蒿项目量值一致性稍差的原因;另一方面,鸡蛋项目一致性稍差的原因是该试剂检测的是全蛋(包括蛋清和蛋黄),而ImmunoCAP系统检测的是蛋白(仅蛋清),因此阴性符合率较低,不排除是蛋黄致敏的可能。鸡蛋分为鸡蛋黄和鸡蛋白,蛋黄中过敏原种类相对较少,最主要为α-卵黄蛋白(Gal d 5),而鸡蛋白含有20多种过敏原,致敏能力最强的是卵粘蛋白(OVM, Gal d 1),蛋白是鸡蛋过敏的主要致敏物质[16]。牛奶过敏原也含有多种致敏组分,主要致敏组分是酪蛋白(αs1-、αs2-、β-和κ-酪蛋白)和乳清蛋白(α-乳白蛋白和β-乳球蛋白)[15],不同厂家的原材料中各种致敏组分配比不同也影响最终的检测结果及定量数值,这是2种方法学牛奶项目也存在差异的原因。
本研究不足之处在于,未能获得全部过敏原的阳性样本,部分性能验证项目仅针对6种过敏原进行验证。但与先前类似文章相比[16],本研究验证维度更全面,所依据的方法标准更新,对检出限的验证首次采用2种方式进行。免疫捕获法应用于过敏原检测的优势在于所有微孔板包被物相同,可实现不同过敏原项目灵活组合,满足过敏原套餐自由定制需求和医保改革的大趋势,有一定的临床推广价值。

