红松籽油中皮诺敛酸富集纯化工艺
包三三, 王希清, 杨雨春, 武晓丹, 赵春建, 付玉杰,3*
(1.东北林业大学 化学化工与资源利用学院,黑龙江 哈尔滨 150040; 2.吉林省林业科学研究院,吉林 长春 130031; 3.北京林业大学 林学院,北京 100083)
红松(PinuskoraiensisSieb. et Zucc.),又名海松、果松,其松籽油中富含人体所需的Δ5-多不饱和脂肪酸(Δ5-UPIFAs),如亚麻酸、亚油酸、皮诺敛酸、棕榈酸、二十碳五烯酸、二十碳六烯酸等[1-4]。其中皮诺敛酸是红松籽油中特有的十八碳三烯酸,其质量约占总脂肪酸的14%~19%[5],具有降血脂、降胆固醇和减肥等功效[6]。皮诺敛酸与其他十八碳三烯酸相比,生物活性更突出,应用前景更广阔。但因皮诺敛酸是高度不饱和脂肪酸,稳定性较差,而皮诺敛酸乙酯的功能与皮诺敛酸相近,且稳定性更好、更安全,无不良气味,更容易被人体吸收[7],因此可通过制备皮诺敛酸乙酯作为皮诺敛酸前体物发挥其在医药及食品领域的应用。国内外最常用的脂肪酸乙酯的制备方法有脂肪酸乙醇酯化法和油脂乙醇醇解法。考虑到环境影响以及能源消耗等因素,在催化作用下工艺流程较短、成本较低廉、产物易于分离且收率高[8]的油脂乙醇醇解法更适于红松籽油脂肪酸乙酯的制备。常用的脂肪酸富集纯化方法主要有超临界流体萃取法、专一性酶法、分子蒸馏法、银离子络合法和尿素包合法等[9-12],其中尿素包合法因具有结构稳定、操作简单、溶剂和尿素都可回收再利用、环境友好等优点,具有较强的实用性[13]。目前,已报道的尿素包合法单次富集纯化红松籽油中皮诺敛酸的纯度最高只能达到45.8%~53.36%,回收率仅为27.3%[6]。本研究采用一种新型高效的油脂乙醇醇解法制备脂肪酸乙酯,并结合尿素包合法对红松籽油中皮诺敛酸乙酯进行富集纯化,通过单因素和响应面优化试验确定了尿素包合的最佳工艺并获得了高纯度皮诺敛酸乙酯,以期为皮诺敛酸在食品和医药行业中的应用研究提供基础数据。
1 实 验
1.1 原料、试剂与仪器
红松籽油由东北林业大学森林植物生态学教育部重点实验室提供。正己烷,色谱级;KOH、尿素、无水乙醇、氯化钠、无水硫酸钠,天津市天力化学试剂有限公司。
VP2002型分析天平;78HW-1型恒温加热磁力搅拌器;MAS-Ⅱ型微波辅助提取仪,上海新仪微波化学科技有限公司;RE-52AA旋转蒸发仪,巩义市予华仪器有限责任公司;Varian 450-GC/240-MS气相色谱-质谱(GC-MS)仪,安捷伦科技(中国)有限公司。
1.2 实验方法
1.2.1红松籽油脂肪酸乙酯的制备 称取10 g红松籽油放入250 mL三颈烧瓶中,当油浴装置加热到反应所需温度75 ℃时,分3次加入配置好的氢氧化钠/无水乙醇溶液,其中氢氧化钠的质量为红松籽油质量的1.0%,无水乙醇与红松籽油的物质的量之比为8 ∶1。启动油浴搅拌加热装置并开始计时,反应全程在氮气保护下进行,2 h后立即结束反应。将反应后的混合物倒入分液漏斗中进行萃取,首先向混合物中加入适量的正己烷,接着用5%氯化钠溶液洗涤2次,重复3次以上操作后静置分层。将静置分层后的溶液放出下层水相,上层有机相用无水硫酸钠干燥12 h后过滤,利用旋转蒸发仪在45 ℃下旋蒸出滤液中剩余的乙醇和正己烷,最终得到红松籽油脂肪酸乙酯。
1.2.2皮诺敛酸乙酯的分离及纯化 打开微波反应器预热30 min,将尿素和乙醇按一定比例混合在500 mL三口烧瓶中,在80 ℃下搅拌混合溶液直至澄清,反应全程在在氮气保护下进行。然后向三口烧瓶中加入适量红松籽油脂肪酸乙酯,反应温度始终保持在75~80 ℃,在氮气保护下继续搅拌60 min直到溶液透明为止。将三颈烧瓶中的澄清溶液置于设定温度下冷冻并结晶至设定时间后,立即将冷冻晶体抽滤。抽滤后的母液用热的饱和盐水和蒸馏水洗涤至中性,然后用正己烷萃取,以上操作重复3次。合并萃取后的上层溶液并用无水硫酸钠干燥12 h,干燥后过滤除去无水硫酸钠,通过减压旋转蒸发除去过量的有机溶剂,从而获得高纯度的皮诺敛酸乙酯。
1.2.3尿素回收再利用评价 尿素包合后混合物固液分离,将抽滤后得到的冷冻结晶加入一定量的蒸馏水,在100 ℃下搅拌1 h,释放包合的脂肪酸乙酯[14]。然后向得到的混合溶液中加入正己烷萃取脂肪酸乙酯,上层为脂肪酸乙酯和正己烷,下层为尿素水溶液。将下层尿素溶液在100 ℃下继续浓缩至几乎无水,低温下结晶,即可回收得到尿素晶体。
1.3 分析方法
1.3.1红松籽油脂肪酸乙酯的成分分析 将1.2.1节制备的红松籽油脂肪酸乙酯样品经进样前处理后,采用气相色谱法分析其脂肪酸乙酯的组成。采用VF-5ms硅胶毛细管色谱柱(30 m×0.25 mm×0.25 μm);升温程序:150 ℃下启动升温程序,以10 ℃/min升至180 ℃(保持2 min),接着以2 ℃/min升至188 ℃(保持2min),紧接着以0.2 ℃/min升至190 ℃(保持2 min),再以5 ℃/min升至220 ℃(保持2min),最后以10 ℃/min升至260 ℃。进样器温度240 ℃;检测器温度290 ℃;载气为高纯度氦气,分流比1 ∶40;燃气为高纯氢气,助燃气为压缩空气;样品进样量1 μL。
1.3.2皮诺敛酸乙酯纯度及回收率的测定 将1.2.2节得到的皮诺敛酸乙酯样品经过进样前处理后,采用气相色谱测定皮诺敛酸乙酯的纯度。采用VF-5ms硅胶毛细管色谱柱(30 m×0.25 mm×0.25 μm);烘箱升温程序:150 ℃下启动升温程序,然后以5 ℃/min升至185 ℃后恒温保持2 min,接着以0.2 ℃/min升温至192 ℃后恒温保持2min,最后以10 ℃/min升温至280 ℃。氢火焰离子检测器;进样口温度和检测器温度分别为240 ℃和290 ℃;载气为高纯度氦气,分流比为1 ∶40;燃气为高纯氢气,助燃气为压缩空气;样品进样量1 μL。皮诺敛酸乙酯GC含量(ω,%)及回收率(η,%)按式(1)~式(2)计算:
ω=A0/As×100%
(1)
η=m0/m1×100%
(2)
式中:A0—皮诺敛酸乙酯峰面积;As—红松籽油脂肪酸乙酯峰面积;m0—包合后皮诺敛酸乙酯质量,g;m1—包合前皮诺敛酸乙酯质量,g。
2 结果与讨论
2.1 红松籽油脂肪酸乙酯成分分析
通过GC-MS分析酯化反应后红松籽油中的脂肪酸乙酯成分,将分析结果与NIST05标准谱库检索比对,确定出红松籽油脂肪酸乙酯成分及GC含量见表1。由表1可知,红松籽油混合脂肪酸乙酯中不饱和脂肪酸乙酯的GC含量约为97.67%,其中皮诺敛酸乙酯GC含量约为15.57%。

表1 红松籽油脂肪酸乙酯组成及含量
2.2 不同条件对皮诺敛酸乙酯纯化效果的影响
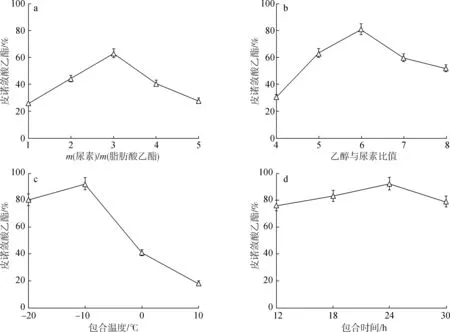
2.2.1尿素与混合脂肪酸乙酯质量比 在乙醇与尿素比例5 ∶1(mL ∶g,下同)、结晶温度为-20 ℃、结晶时间为24 h条件下,考察尿素与红松籽油脂肪酸乙酯质量比对纯化效果的影响(每组实验重复3次),结果见图1(a)。由图可知,尿素用量对富集效果影响显著,当尿素与脂肪酸乙酯质量比为3 ∶1时,皮诺敛酸乙酯GC含量达到最大值。这是因为尿素用量过少时,形成尿素包合物的框架少,不能最大程度地包合饱和或单不饱和脂肪酸乙酯,富集效果差;用量增加时,更多的饱和或单不饱和脂肪酸乙酯被尿素包合,使得多不饱和脂肪酸乙酯即皮诺敛酸乙酯GC含量相应提高;但是当尿素用量达到一定程度后继续增加尿素用量,会造成尿素过量而皮诺敛酸乙酯GC含量相对减少。综含考虑皮诺敛酸乙酯的含量及溶剂消耗,尿素与脂肪酸乙酯质量比宜选择3 ∶1。
2.2.2乙醇与尿素比例 乙醇与尿素比例是影响尿素包合效果的重要因素之一。在尿素与脂肪酸乙酯质量比3 ∶1、结晶温度-20 ℃、结晶时间24 h条件下,考察乙醇与尿素比例对皮诺敛酸乙酯纯化效果的影响(每组实验重复3次),结果见图1(b)。由图可知,乙醇与尿素比例从4 ∶1(mL ∶g,下同)增加到6 ∶1 时,皮诺敛酸乙酯GC含量逐渐升高;当乙醇与尿素比例超过6 ∶1时,皮诺敛酸乙酯的含量却逐渐下降。在前期实验中发现溶剂量少时,很难完全溶解尿素,溶液的分子运动阻力增大;当溶剂过量时,尿素包合反应沿逆方向进行,这也会导致皮诺敛酸乙酯的含量逐渐降低,同时还将增加溶剂回收的难度。因此,在接下来实验中乙醇与尿素比例宜选择6 ∶1。
2.2.3包合温度 合适的包合温度在尿素包合过程中起着至关重要的作用。在乙醇与尿素比例6 ∶1、尿素与脂肪酸乙酯质量比3 ∶1、结晶时间24h条件下,考察包合温度对纯化效果的影响(每组实验重复3次),结果见图1(c)。由图可知,当包合温度为-10 ℃时,皮诺敛酸乙酯GC含量达到最大值;而当温度升高到0 ℃以上时,含量急剧下降。该现象归因于尿素包合反应是放热过程,温度升高则尿素包合物逐渐分解,导致尿素包合效果差;当温度低时反应朝着尿素包合物形成的方向进行。但是,温度过低,过滤困难,脂肪酸损失大,这也会导致尿素包合效果变差。因此,综合考虑反应能耗和皮诺敛酸乙酯GC含量,合适的包合温度为-10 ℃。
a.m(尿素)/m(脂肪酸乙酯)m(urea)/m(fatty acid ethyl esters); b.乙醇与尿素比 ratio of ethanol to urea;
2.2.4包合时间 反应时间在反应过程中也起着重要的作用。在乙醇与尿素比例6 ∶1、尿素与脂肪酸乙酯质量比3 ∶1、包合温度-10 ℃的条件下,考察包合时间对纯化效果的影响(每组实验重复3次),结果见图1(d)。由图可知,包合时间总体上对皮诺敛酸乙酯GC含量的影响不显著。皮诺敛酸乙酯GC含量在包合时间为24 h达到最大值,继续延长包合时间,皮诺敛酸乙酯的GC含量降低。这是因为包合反应在24 h达到平衡,继续延长包合时间,反应向相反方向进行。故最佳反应时间为24 h。
2.3 皮诺敛酸乙酯纯化的响应面优化
在单因素试验基础上,根据Box-Behnken实验设计原理,以皮诺敛酸乙酯GC含量(Y)为响应值,影响较为显著的3个因素:尿素与脂肪酸乙酯质量比(X1)、乙醇与尿素比例(X2)、包合温度(X3)为自变量进行响应面优化试验,试验设计及结果见表2。
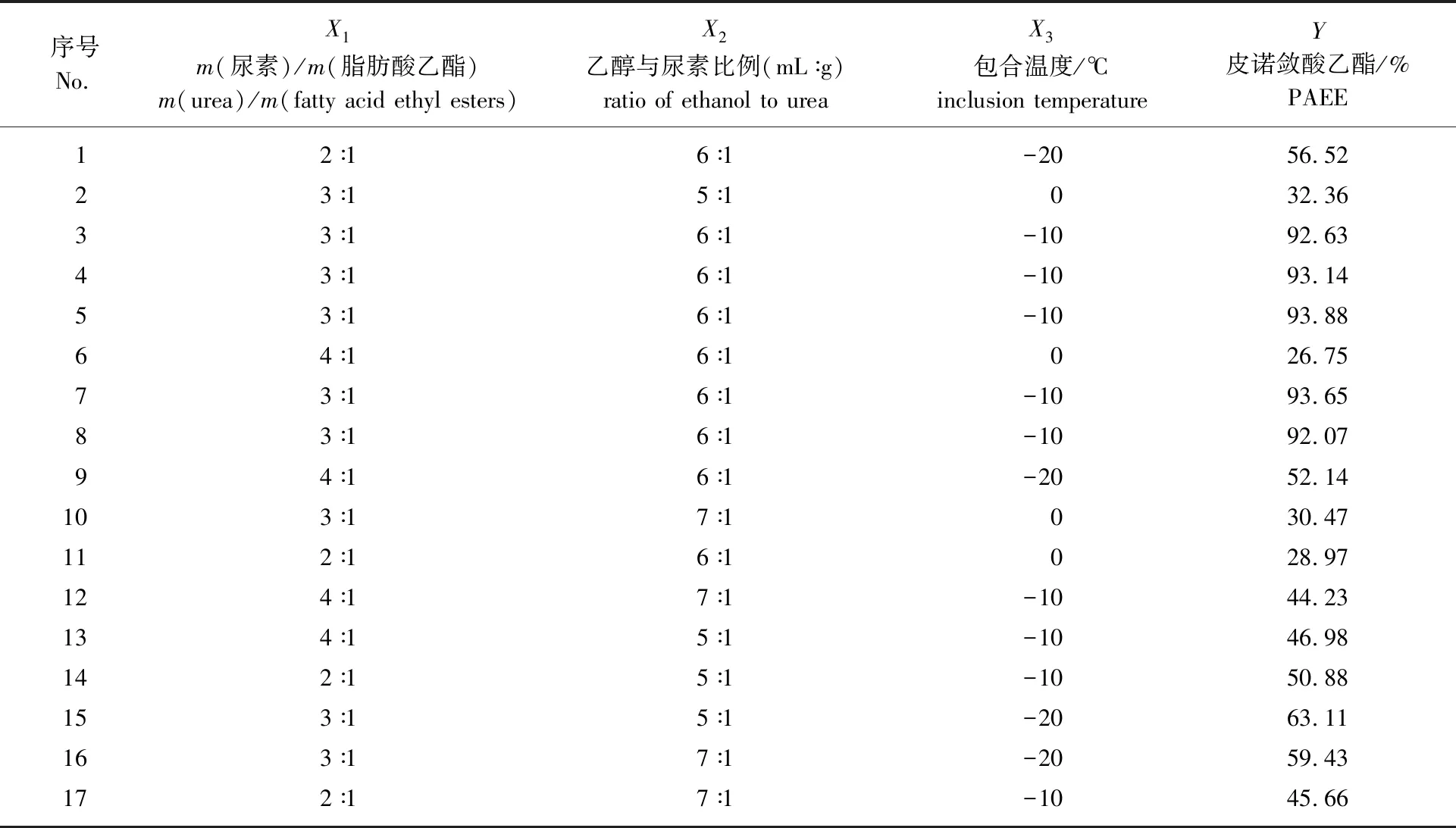
表2 响应面试验设计及结果
根据Box-Behnken试验所得到的数据结果和回归方程,利用Design Expert 8.0.6软件分析皮诺敛酸乙酯最佳纯化工艺,得到皮诺敛酸乙酯GC含量的二次回归模型方程为:Y=-893.085+149.495X1+242.236X2-7.096X3+0.617X1X2+0.054X1X3+0.044X2X3-25.692X12-20.444X22-0.262X32。对回归模型进行方差分析,结果见表3。
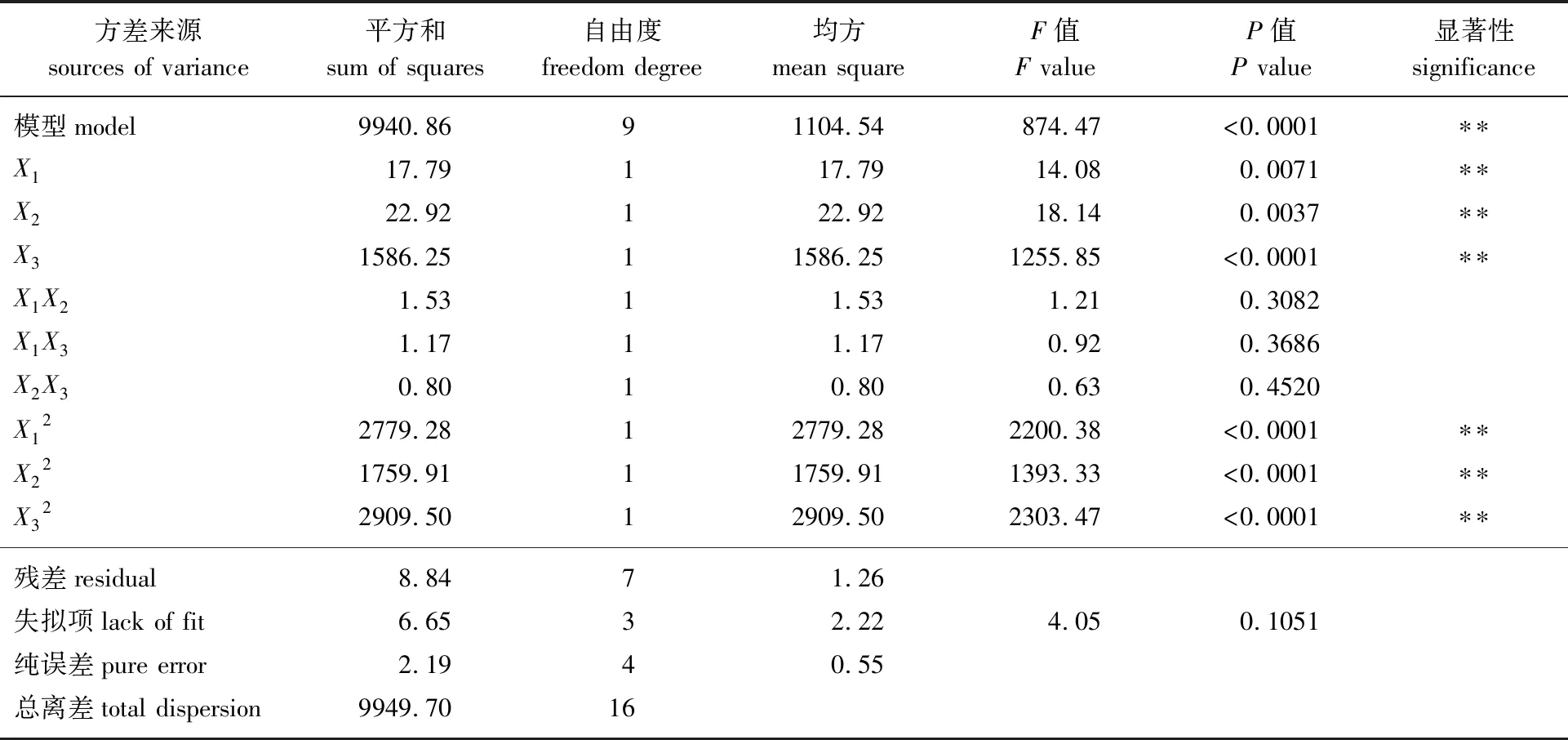
表3 回归方程方差分析
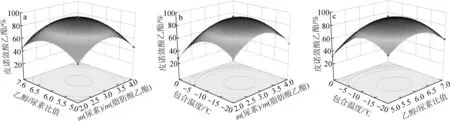
从表3的模型方差分析中可以看出,本试验的回归方程模型P<0.05具有显著性,失拟项不显著(P=0.1051>0.05),表明该模型拟合成功[15-16]。根据回归方程绘制皮诺敛酸乙酯GC含量随各影响因素变化的响应曲面图,结果见图2。尿素包合法中任意2个显著性影响因素所形成的响应曲面均呈现中心凸起四周下降的趋势,说明尿素包合法富集纯化皮诺敛酸乙酯实验中响应面选取水平范围准确,并且存在皮诺敛酸乙酯GC含量的最大值,通过模型预测的最佳纯化工艺科学合理。
通过软件分析,该回归方程拟合的皮诺敛酸乙酯GC含量达到最大值时的工艺条件为:尿素与红松籽油脂肪酸乙酯质量比3.04 ∶1,乙醇与尿素比例5.99 ∶1(mL ∶g),包合温度-12.85 ℃,模型预测的皮诺敛酸乙酯GC含量最高为94.84%。为了验证拟合结果并考虑到实际操作的可行性,在尿素与红松籽油脂肪酸乙酯质量比3 ∶1、乙醇与尿素比例6 ∶1(mL ∶g)、包合温度-13 ℃和包合时间24 h条件下进行3组验证性试验,得到皮诺敛酸乙酯平均GC含量为94.75%,回收率为66.25%。实际验证值与理论预测值非常接近,说明响应面法优化皮诺敛酸含量的条件真实可靠。
a.Y=f(X1, X2); b.Y=f(X1, X3); c.Y=f(X2, X3)
对回收尿素重复包合、分离、再包合过程进行了考察,通过对尿素3次包合和回收后,得到皮诺敛酸乙酯的纯度依次为94.75%、88.37%、72.72%,回收率依次为66.25%、61.24%、50.62%。皮诺敛酸乙酯平均纯度仍可达85.28%,虽然纯度略有所下降,但证明尿素仍有较好的重复利用性。
2.4 与传统纯化皮诺敛酸方法的对比
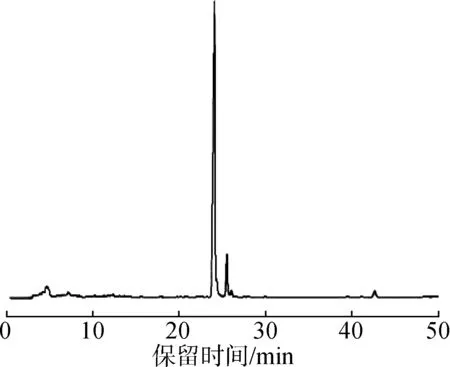
图3 新工艺纯化皮诺敛酸乙酯GC含量Fig.3 GC content of pinolenic acid ethyl ester purified by the novel technology
图3为本工艺富集纯化出的皮诺敛酸乙酯的GC图。尿素是一种四方系的晶体,当尿素与脂肪族化合物生成包合物后,包合物呈六棱柱的结晶。一般饱和脂肪酸乙酯和单不饱和脂肪酸乙酯可进入尿素形成的六棱柱空管道中,比多不饱和脂肪酸乙酯更容易形成稳定的包合物,最终通过减压抽滤法除去包合物就可以得到高纯度的多不饱和脂肪酸乙酯。传统尿素包合法纯化皮诺敛酸的方法较为繁琐,首先将红松籽油经过皂化反应制备红松籽油混合脂肪酸盐,再经酸化得到红松籽油混合脂肪酸,接着采用尿素包合法富集纯化皮诺敛酸,最后再对皮诺敛酸采用甲酯化或乙酯化处理后经过气相色谱检测其纯度。杨明非等[6]经此方法得到皮诺敛酸纯度约为45.8%,回收率约为27.3%。本实验利用新工艺纯化皮诺敛酸乙酯只包含2个步骤:采用乙醇醇解油脂法制备红松籽油混合脂肪酸乙酯,再优化尿素包合法富集纯化皮诺敛酸乙酯。纯化后得到的皮诺敛酸乙酯无需再经过甲酯化或者乙酯化处理,可直接利用气相色谱进行纯度检测。相比传统方法省去较多实验步骤,有效减少了实验过程中皮诺敛酸的损失,且以乙酯形式存在的脂肪酸在实验条件下结构更加稳定,有利于富集纯化过程的进行。本工艺富集纯化出的皮诺敛酸乙酯纯度可高达94.75%,回收率可达66.25%,可以看出,相比传统方法[6],皮诺敛酸乙酯纯度提高107%,回收率提高143%。
3 结 论
本研究结合乙醇醇解油脂反应和尿素包合法,将红松籽油中皮诺敛酸以脂肪酸乙酯的形式进行了高效的富集纯化,采用单因素和响应面试验优化了纯化工艺。结果表明:皮诺敛酸乙酯的最佳纯化工艺条件为尿素与红松籽油脂肪酸乙酯质量比3 ∶1、乙醇与尿素比例6 ∶1(mL ∶g)、包合温度-13 ℃和包合时间24 h,此条件下分离纯化出皮诺敛酸乙酯纯度高达94.75%,回收率达66.25%。与传统尿素包合法纯化皮诺敛酸相比,纯度提高107%,回收率提高近143%,并且尿素在回收实验中表现出较好的回收利用性。本方法克服了常规富集纯化皮诺敛酸方法中实验步骤复杂且纯度不高的缺点,建立了一种高效富集纯化红松籽油中皮诺敛酸乙酯的新工艺,将为后续皮诺敛酸在相关食品、医药、保健领域的应用提供数据基础和技术支持。

