β-环糊精包合红松籽油的制备工艺及生物利用度评价
祖述冲
(东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
红松籽别名为果松子、海松子,是红松的种子[1]。红松(Pinuskoraiensis)为松科(Pinaceae)松属(Pinus),常绿针叶乔木,野生红松主要分布在中国的小兴安岭及长白山地区,属于国家珍贵濒危树种,被列为国家一级保护植物[2]。野生红松需要生长50年后才能开始结松籽,成熟期为两年[3]。果球大呈卵圆形,暗褐色,球内结子,大如巴豆,故称为红松籽[4]。红松籽去壳后得到红松籽仁,属于坚果类食物,不仅美味,而且具有食疗的功效,受到历代医者、营养学者的推崇。红松籽在我国古代就已有食用记载,宋朝时把红松籽称为“长生果”,具有延年益寿的作用。明代李时珍所著《本草纲目》记载:“松仁性温,味甘,无毒,主治关节风湿,头眩,润五脏,逐风痹寒风,补体虚,滋润皮肤,久服轻身不老”[5]。红松籽仁中除油脂外,还含有丰富的营养成分,包括:蛋白质、糖类、脂肪和粗纤维等。其蛋白质含量在13%~19%,并含有人体必需的多种氨基酸[6]。此外,红松籽仁的营养价值极高,含有多种人体必需营养元素和丰富的维生素[7]。
红松籽蛋白的提取主要是通过碱提酸沉法[8]、磷酸化化学改性[9]和酶法处理[10]等方法。提取后的粗蛋白主要用于蛋白类饮料的开发;红松籽中脂肪酸的提取主要是通过压榨法、超临界二氧化碳法、有机溶剂浸出法,主要生产红松籽油产品[11]。其中压榨法绿色环保,无溶剂残留,通过此法制备的红松籽油受到广大消费者的青睐。
目前市场上红松籽油相关产品主要有红松籽油软胶囊和红松籽油乳体饮料等。本文主要利用β-环糊精对红松籽油进行包合制备工艺研究,使红松籽油固体化,形成粒径小、稳定、体内吸收率高的包合物,有利于保存和方便携带。本研究对皮诺敛酸在大鼠体内生物利用度进行重点评价研究。
1 实验仪器与材料
1.1 仪器
7890A型气相色谱仪(美国Agilent公司);DENVER型电子分析天平(美国丹佛仪器公司);水浴锅(上海辽卓科贸有限公司);DF-101S数显恒温水浴磁力搅拌器(上海辽卓科贸有限公司);101-2AB电热鼓风干燥箱(天津泰斯特仪器有限公司);SHB-IV双A负压真空泵(郑州宏朗仪器设备有限公司);VGT-2127QT超声仪(深圳市固特宏业机械设备有限公司);RE-201C旋转蒸发仪(上海申盛仪器有限公司);ZetaPALS激光粒度仪(美国布鲁克海文)。
1.2 材料
红松籽油(实验室自制);正己烷(天津市富于精细化工有限公司,分析纯);浓硫酸(北京化工厂有限公司,分析纯);无水乙醇(天津市天力化学试剂有限公司,分析纯);甲醇(山东禹王实业有限公司);β-环糊精(阿拉丁化学试剂有限公司);220-250gSD大鼠(哈尔滨医科大学动物实验中心);石油醚(天津市富于精细化工有限公司,分析纯);皮诺敛酸准品(美国sigma公司)。
2 实验方法
2.1 制备及检测方法
红松籽油包合物:将一定量的β-环糊精溶于去离子水中,50℃加热搅拌至完全溶解后待用,称取一定量的实验室自制红松籽油与乙醇按照一定比例(w/w)混合后,在加热搅拌的条件下,将红松籽油乙醇混合液缓慢加入β-环糊精水溶液中,加热搅拌一定时间。反应结束后,加入整个体系一倍体积的乙醇,放置0℃条件下,搅拌30 min后静置3 h,过滤得到沉淀,再将沉淀用乙醇清洗3次。将清洗后的沉淀放置于60℃烘箱中,进行干燥,时间为4 h。干燥后的沉淀即为β-环糊精固体化的红松籽油包合物。
红松籽油包合物检测:将干燥后的红松籽油包合物与一定量的正己烷加入索氏提取器装置中,80℃回流4 h进行提取。将回流后的提取液在45℃下进行旋转蒸发去除溶剂,得到红松籽油称取质量,通过甲酯化后进行气象色谱(GC)检测。
2.2 单因素优化实验方法
采用单因素法进行优化实验,通过预实验确定红松籽油包合实验中的影响因素,即包合温度、包合时间、乙醇加入量、红松籽油加入量4个影响因素,其各因素变量范围如表1所示。保持包合时间为2.5 h、500 mL的β-环糊精饱和溶液体系、红松籽油与β-环糊精的摩尔比为1∶2、乙醇加入量为红松籽油的3倍条件下不变,将包合温度控制在40、45、50、55、60、65、70℃条件下进行优化,并计算包合物固体化率选取最优条件。保持包合温度固定在50℃、500 mL的β-环糊精饱和溶液体系、红松籽油与β-环糊精的摩尔比为1∶2、乙醇加入量为红松籽油的3倍条件下不变,将包合时间控制在0.5、1.5、2.5、3.5、4.5、5.5、6.5 h进行优化,并计算包合物固体化率选取最优条件。保持包合温度控制在50℃、包合时间为2.5 h、500 mL的β-环糊精饱和溶液体系、乙醇加入量为红松籽油的3倍条件下不变,将按照红松籽油与β-环糊精的摩尔比为3∶1、2∶1、1∶1、1∶2、1∶3、1∶4、1∶5进行优化,并计算包合物固体化率选取最优条件。包合温度固定在50℃、包合时间为2.5 h、500 mL的β-环糊精饱和溶液体系、红松籽油与β-环糊精摩尔比为1∶2保持不变,乙醇加入量控制在红松籽油用量的0,1.5,3.0,4.5,6.0,7.5、9.0倍条件下进行优化。
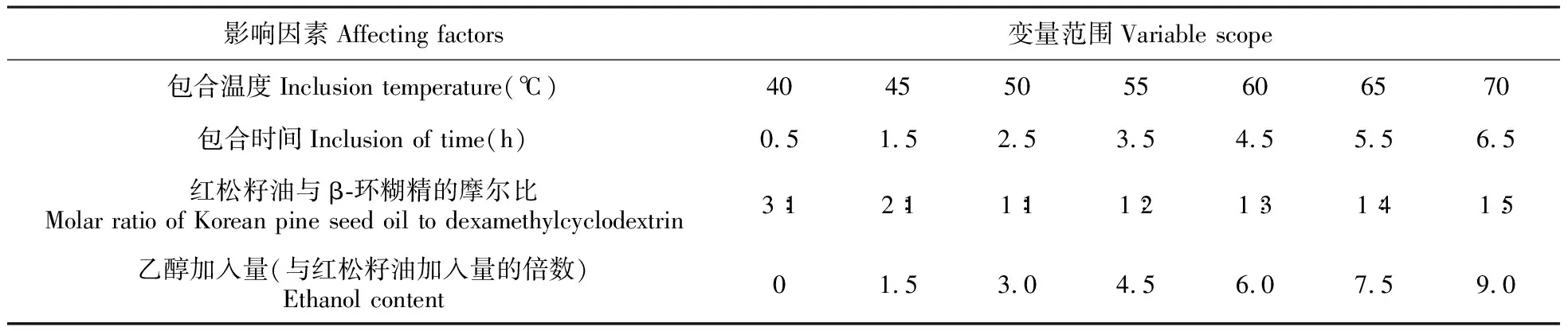
表1 红松籽油包合物实验影响因素变量范围
固化率可以考察出红松籽油包合情况,因此将红松籽油固化率作为优化考察结果。通过不同优化条件分别计算红松籽油的固化率,每组实验平行重复3次,取平均值,选取最优制备条件。
固化率计算公式为:
100%(1)
2.3 红松籽油包合物检测
2.3.1 红松籽油甲酯化GC检测
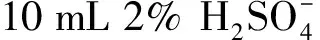
GC检测条件:HP-5MS型石英毛细管柱(30 mm×0.25 mm×0.25 μm);柱温150~240℃,以5℃·min-1程序升温;进样口温度250℃;柱前压13.332 psi;分流比为1∶20;载气为高纯氦气;进样量2 μL。
2.3.2 粒径检测
红松籽油包合物的粒径都使用美国布鲁克海文Zeta PALS激光粒度仪测定,将红松籽油包合物用5 mL去离子水复溶,浓度为5 mg·mL-1,放入比色皿中,用激光粒度仪测定其乳液中红松籽油的平均粒径大小和所带电荷数,每次实验重复3次,取平均值。
2.4 红松籽油包合物生物利用度检测
2.4.1 灌胃红松籽油
经东北林业大学实验动物伦理委员会的批准,取质量为250±25 g的健康雌性SD大鼠12只,随机将其平均分成两组(n=6),进行平行实验。实验前自由饮水、禁食,采用眼球后静脉丛取血法,实验前取1.0 mL空白血样。分别灌胃红松籽油和红松籽油包合物,给药剂量均为10 mL·kg-1(按含红松籽油质量计算)。给药后分别于1/4、1/2、1、2、4、6、8、10、12、14、18、24 h分别取血1 mL,将所取血样离心后取上清血浆0.2 mL。
2.4.2 血浆样品预处理
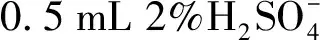
2.4.3 血浆中皮诺敛酸的含量检测
将之前取得大鼠空白血浆中加入皮诺敛酸标准品中,配置成0.08、0.02 μg·mL-1溶液,混合均匀。将所得样品进行甲酯化处理,利用气相色谱测定皮诺敛酸含量。采用外标法计算其他血浆样品中皮诺敛酸的含量。
3 结果与分析
3.1 单因素优化结果
3.1.1 包合温度对红松籽油的固化率的影响
如图1所示,当其他条件恒定时,随着包合温度的逐渐升高,红松籽油的固化率是随着温度升高而增大,当固化温度达到50℃后固化率开始下降,原因是β-环糊精在水中的溶解度,随着温度增加溶解度增加,导致固化率下降。因此固化率最高时的温度为50℃,即为71.81%,因此选择50℃作为红松籽油包合的最优温度。

图1 温度对固化率的影响Fig.1 The influence of temperature on the solidification rate

图2 时间对固体化率的影响Fig.2 The influence of time on the solidification rate
3.1.2 包合时间对红松籽油的固化率的影响
如图2所示,当其他条件恒定时,随着包合时间的逐渐延长,红松籽油的固化率是随着时间的延长而增大,当固化时间达到2.5 h后固化率开始下降,原因是已被β-环糊精包合的红松籽油,随着包合时间的增加,会引发红松籽油过度饱和而析出,导致固化率下降。因此固化率最高时的时间为2.5 h,即为66.38%,因此选择2.5 h作为红松籽油包合的最优时间。
3.1.3 红松籽油加入量对红松籽油的固化率的影响
如图3所示,当其他条件恒定时,红松籽油的固化率是随着红松籽油的加入量减少而增加,当红松籽油与β-环糊精为1∶2后,固化率开始有所下降,原因是β-环糊精达到饱和后,过量的红松籽油与被包合的红松籽油之间,由于分子间的极性相同,相互吸引,而导致固化率下降。因此固化率最高时的比值为1∶2,即为72.63%,因此选择皮诺敛酸与β-环糊精摩尔比为1∶2时为最优条件。
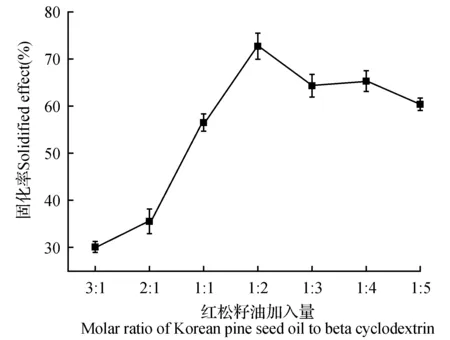
图3 红松籽油加入量对于固化率的影响Fig.3 The influence of amount of peony seed oil on the solidification rate
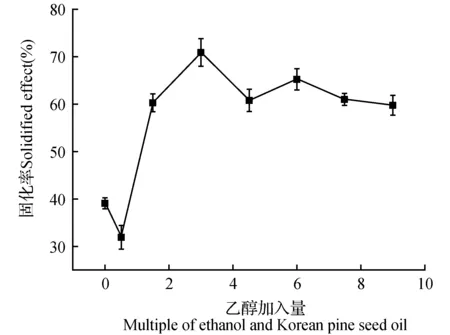
图4 乙醇加入量对于固化率的影响Fig.4 The influence of amount of ethanol on the solidification rate
3.1.4 乙醇加入量对红松籽油的固化率的影响
如图4所示,当其他条件恒定时,红松籽油的固化率是随着乙醇的加入量增加而增大,当乙醇的加入量为红松籽油加入量的3倍后,固化率开始逐渐下降,原因是乙醇作为包合过程中水和红松籽油的助乳化剂,对红松籽油一定量的溶解度,所以加入少量的乙醇时未起到助乳化的作用,会使固化率下降,当乙醇达到一定量时可发挥其助乳化作用,固化率随之增大,当过量的乙醇加入时,会产生对红松籽油的溶解。因此固化率最高时的乙醇加入量为红松籽油加入量的3倍,即为70.95%,在不加乙醇时的固化率为39.12%。因此选择乙醇加入量为红松籽油加入量的3倍时为最优条件。
通过以上单因素优化实验可得制备红松籽油包合物最佳工艺条件为:包合温度50℃、包合时间为2.5 h、皮诺敛酸与β-环糊精的摩尔比为1∶2、乙醇加入量为红松籽油用量的3倍(w/w),在最优条件下包合所得红松籽油固化率为70.95%,经索氏提取法检测包合物含油率为26.88%。将最佳制备条件实验重复3次。得固化率平均为69.55%。结果表明,在最优制备条件下具有一定的重复性,因此可通过此方法制备红松籽油包合物。
3.2 GC检测结果
对红松籽油进行甲酯化处理后采用GC对其主要脂肪酸组分进行分析,得到气相色谱图,如图5~6所示,红松籽油中皮诺敛酸含量为14.25%、亚油酸含量为47.30%、油酸含量为29.10%、硬脂酸含量为3.33%、棕榈酸含量为6.03%;红松籽油包合物中皮诺敛酸含量为14.35%、亚油酸含量为48.59%、油酸含量为28.80%、硬脂酸含量为2.76%、棕榈酸含量为5.50%。结果表明,包合物中红松籽油的脂肪酸各组分含量与红松籽油中脂肪酸各组分含量无明显差异性,因此说明了包合过程中不会对红松籽油中各脂肪酸含量产生影响。
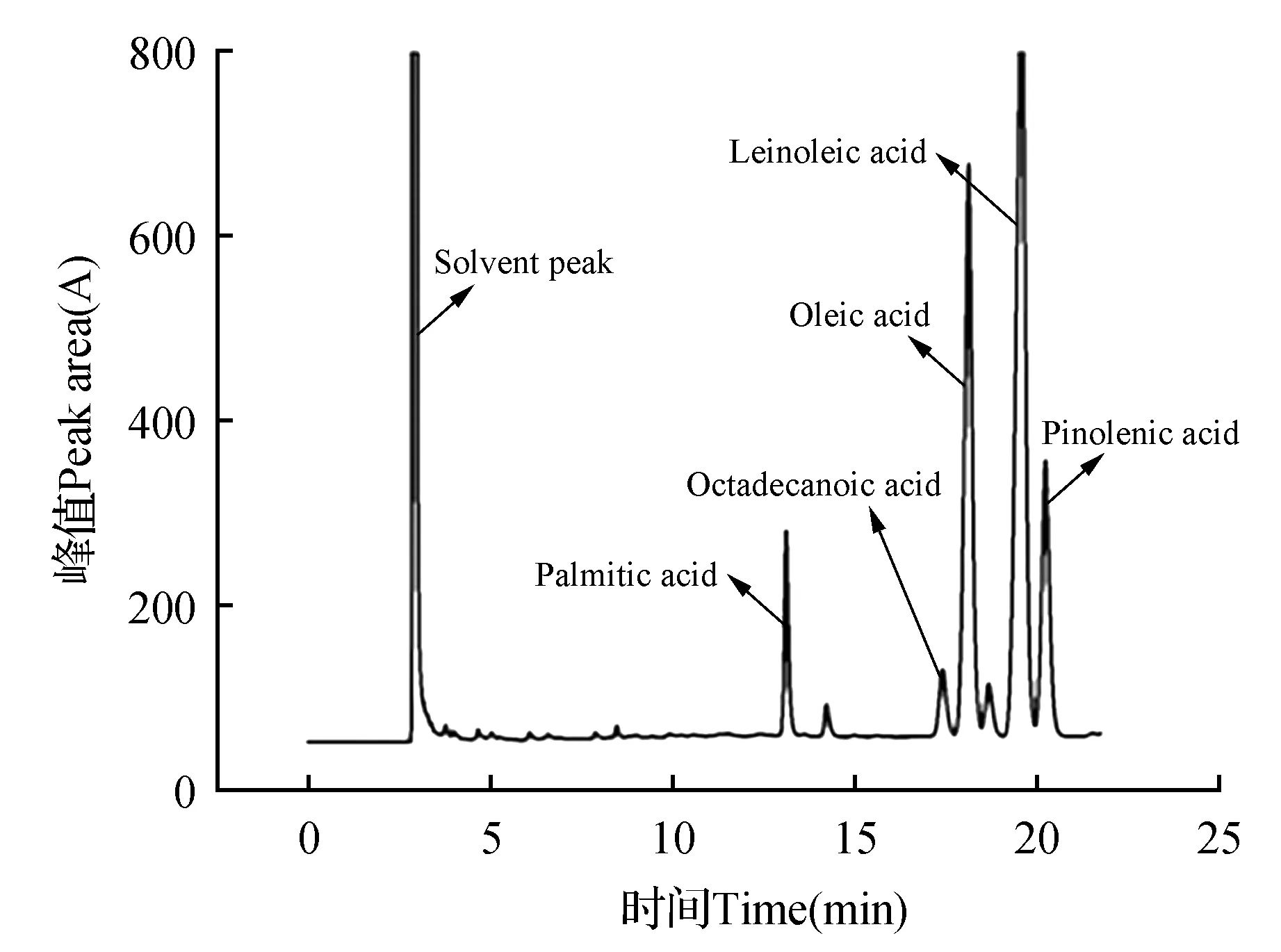
图5 红松籽油气相色谱图Fig.5 GC of Korean pine seed oil
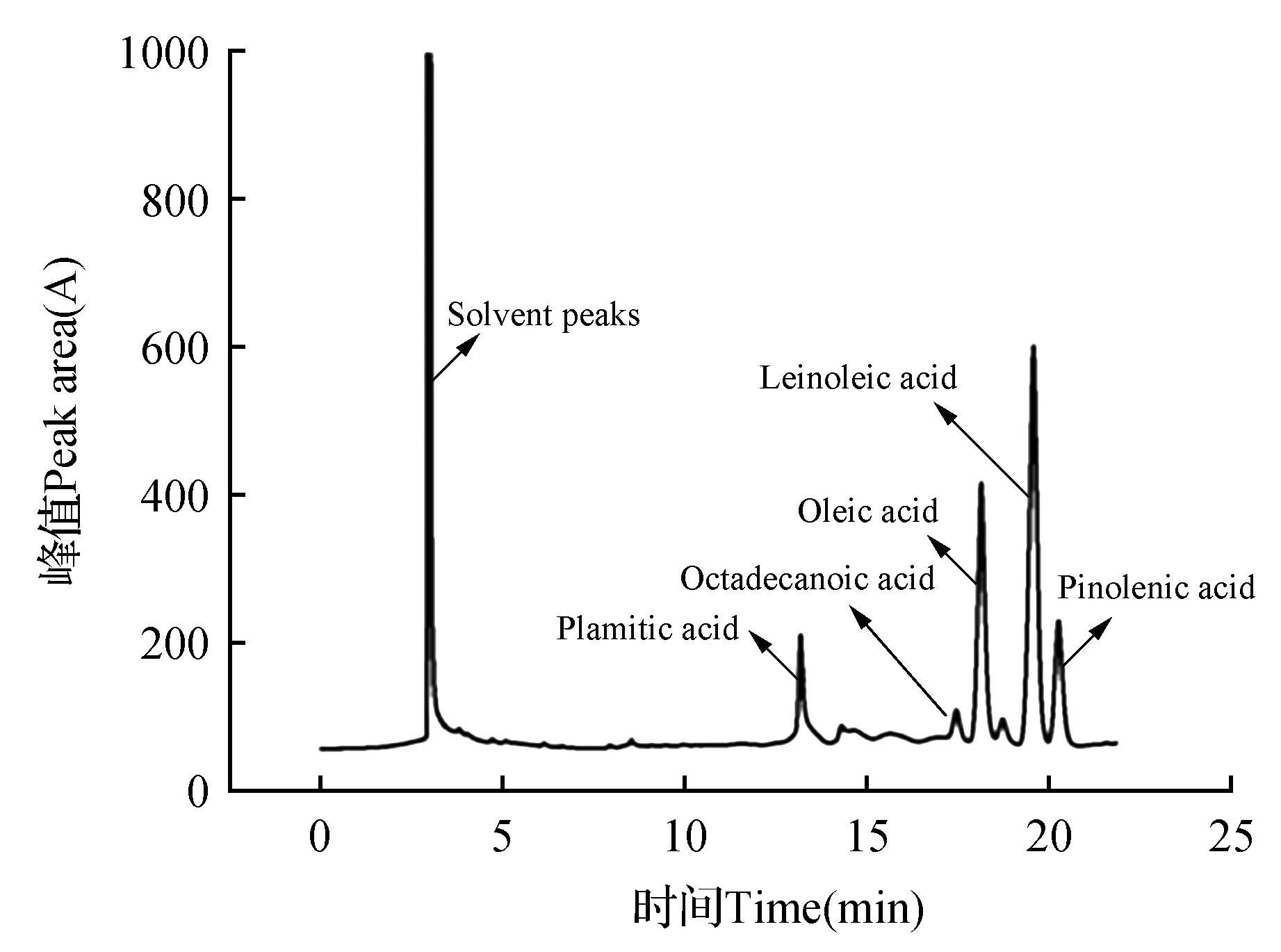
图6 红松籽油包合物气相色谱图Fig.6 GC of inclusion complex of Korean pine seed oil
3.3 粒径检测结果
在最优工艺条件下,制备得到红松籽油包合物,经激光粒度仪检测,其正态分布曲线图如图7所示。红松籽油包合物乳液的平均粒径为177.3±2.6 nm,如图8所示,红松籽油包合物电位为-33.01±1.4 mV。制备包合物稳定性好,有利于贮藏;与水溶液形成乳剂,粒径减小,水溶性增大,可提高红松籽油在体内的吸收率。
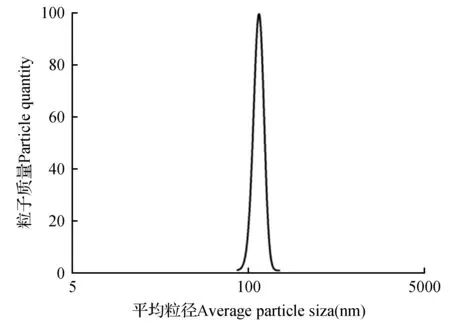
图7 红松籽油包合物正态分布图Fig.7 The Normal distribution diagram of Korean seed oil inclusion complex
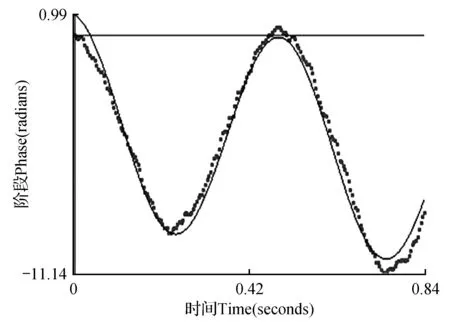
图8 红松籽油包合物电位分布Fig.8 The inclusion complex of Korean pine seed oil
3.4 生物利用度检测结果
红松籽油及红松籽油包合物大鼠口服给药后皮诺敛酸的血药浓度曲线如图9所示。从图9中可以看出,在大鼠体内,红松籽油包合物组的皮诺敛酸的吸收速度明显高于红松籽油组。红松籽油组血样中皮诺敛酸浓度在8 h时达到最大高血药浓度(Cmax)95.26 ng·mL-1。红松籽油包合物组相对吸收较快,在6 h时达到最大高血药浓度(Cmax)120.53 ng·mL-1。红松籽油包合物组的血药的Cmax是红松籽油组的1.27倍。利用DAS2.0软件对数据进行模型拟合,拟合发现红松籽油及红松籽油包合物在大鼠体内的药动学均符合二室模型,权重系数为1/cc,模拟计算得到的药动学参数结果如表2所示。红松籽油包合物的t1/2a是红松籽油的1.42倍;AUC值是红松籽油1.56倍;平均滞留时间(MRT)是红松籽油的1.04倍。结果显示,说明红松籽油包合物与水溶液形成乳剂,粒径减小,水溶性增大,增加了包合物在体内的t1/2a和平均滞留时间(MRT),提高了皮诺敛酸在体内的吸收。
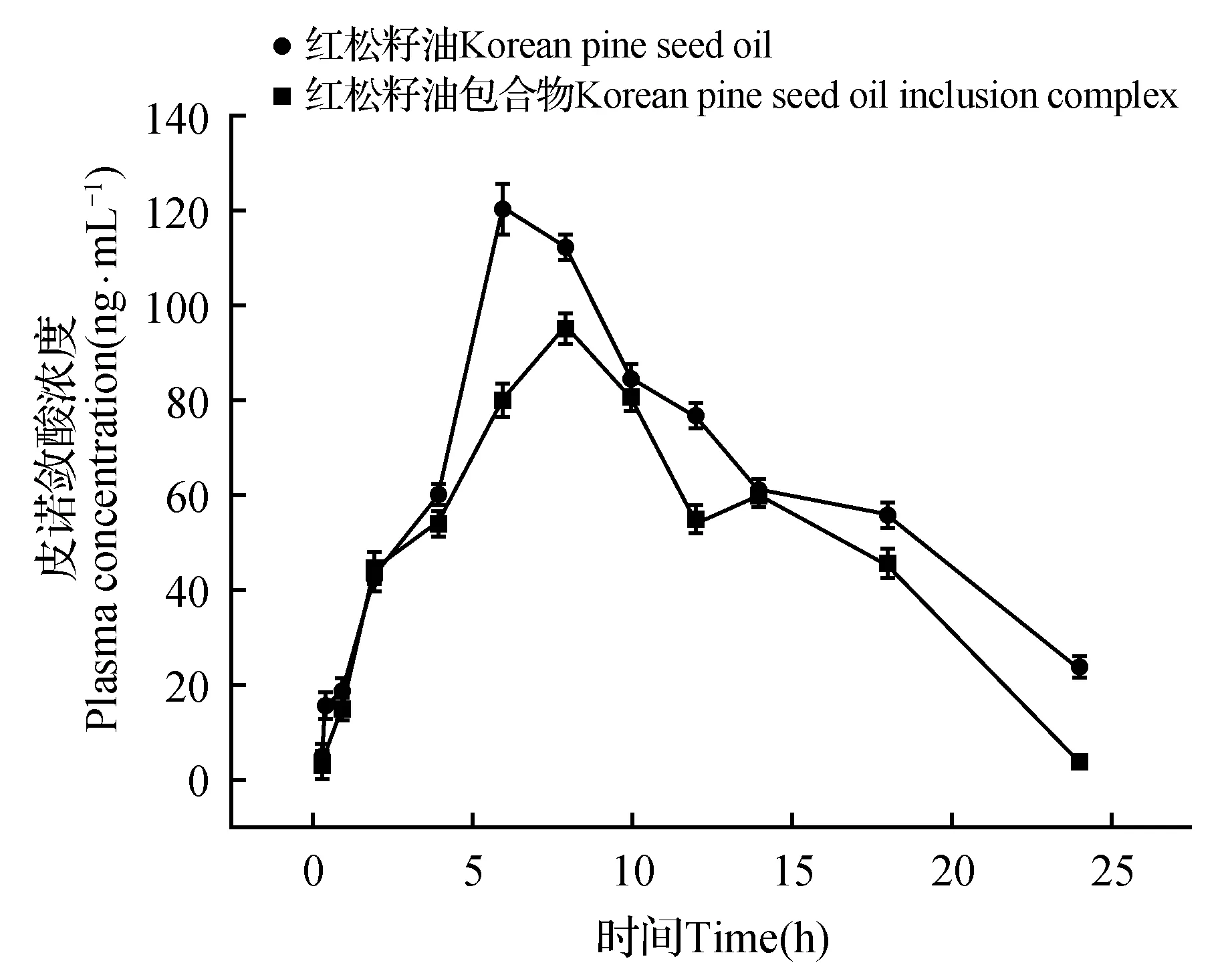
图9 红松籽油及红松籽油包合物中皮诺敛酸血药浓度曲线Fig.9 Pinolenic acid concentration curve in Korean pine seed oil and Korean pine seed oil inclusion complex
表2 红松籽油和红松籽油包合物药代动力学参数
Table 2 Variable Korean pine seed oil and Korean pine seed oil inclusion complex pharmacokinetic parameters
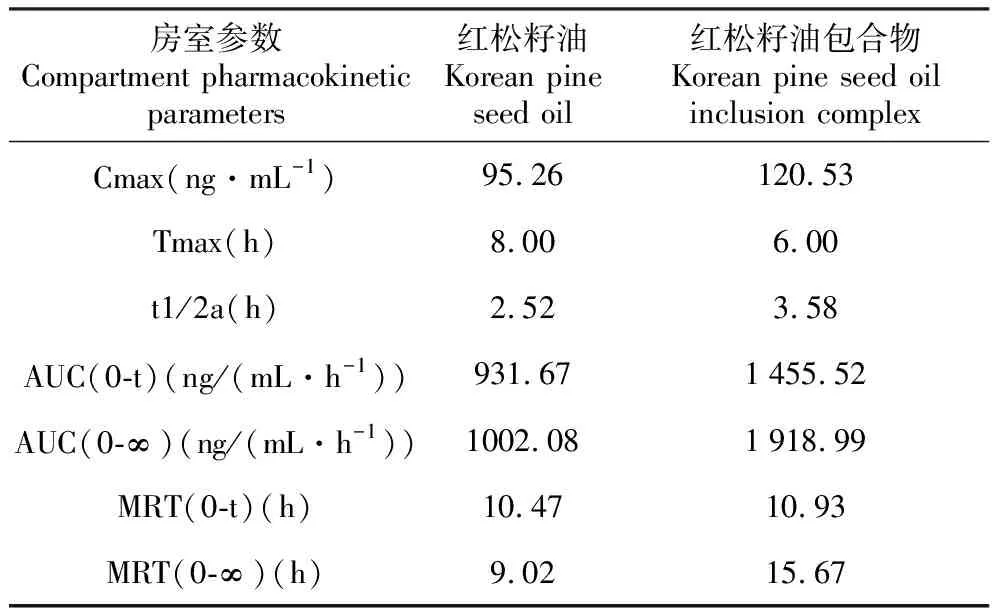
房室参数Compartment pharmacokinetic parameters红松籽油Korean pine seed oil红松籽油包合物Korean pine seed oil inclusion complexCmax(ng·mL-1)95.26120.53Tmax(h)8.006.00t1/2a(h)2.523.58AUC(0-t)(ng/(mL·h-1))931.671455.52AUC(0-∞)(ng/(mL·h-1))1002.081918.99MRT(0-t)(h)10.4710.93MRT(0-∞)(h)9.0215.67
4 讨论
通过单因素法优化,得到红松籽油包合物的最优制备工艺为:包合温度50℃,包合时间为2.5 h,皮诺敛酸与β-环糊精的摩尔比为1∶2,乙醇加入量为红松籽油用量的3倍(w/w),在最优条件下制备包合物所得红松籽油固化率为70.95%,包合物含油率为26.88%。通过GC检测红松籽油及其包合物的脂肪酸组分可知,包合物中红松籽油的各组分含量与红松籽油中各组分含量无明显差异,其中皮诺敛酸的含量在14%~16%。通过激光粒度仪检测可知,红松籽油包合物的平均粒径为177.3±2.6 nm,电位为-33.01±1.4 mV。通过生物利用度检测可知,红松籽油包合物组的血药最大浓度(Cmax)是红松籽油组的1.27倍,t1/2a是红松籽油的1.42倍;AUC值是红松籽油1.56倍;平均滞留时间(MRT)是红松籽油的1.04倍。因此,通过本实验说明红松籽油包合物与水溶液形成乳剂,粒径减小,水溶性增大,增加了包合物在体内的t1/2a和平均滞留时间(MRT),提高了皮诺敛酸在体内的吸收,这对红松籽油的新产品研发具有重要参考意义。

