系统性红斑狼疮伴结肠多部位慢性病变及梗阻一例报告并文献复习
王李 钟鹏 田跃 叶景旺 童卫东
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种全身性多系统多脏器受累的自身免疫性疾病,临床表现形式多样。文献报道,SLE合并消化系统受累临床较常见[1-3]。狼疮性肠系膜血管炎(lupus mesenteric vasculitis,LMV)是系统性红斑狼疮累及消化道的主要表现形式之一[4],可表现为腹痛、腹泻、恶心、呕吐及消化道出血等不同的症状。但往往因为其症状及体征较轻、病程长、缺乏特异性,在临床上容易被忽视[5]。尽管SLE合并消化道受累可出现在胃肠道的任何部位,但主要以小肠受累最为常见,结肠发生病变者罕见[6]。本例SLE患者反复腹痛近20年,先后出现了升结肠和乙状结肠的节段性病变伴慢性穿孔及梗阻,两次均通过外科手术及术后病理结果得以证实。追溯文献,SLE患者反复发生结肠的节段性病变伴慢性穿孔未见报道,特报道如下。
一、病例资料
患者50岁,女性,1991年(22岁)因“反复发热、四肢关节疼痛”在外院行经皮肾穿刺诊断“系统性红斑狼疮,狼疮性肾炎”,之后一直口服“火把花根片、强的松、环磷酰胺”等多种药物治疗,病情控制稳定。2000年在外院因“右下腹疼痛”行“阑尾切除术”。31岁绝经。个人史及家族史无特殊。2001年12月(32岁)因“右下腹痛3天”第一次入陆军军医大学附属大坪医院,主要表现为右下腹阵发性绞痛,查血常规、妇科超声及腹部彩超未见明显异常。入院查体:心肺无特殊,全身浅表淋巴结未触及肿大。腹部平坦、软,右下腹压痛明显,无反跳痛及肌紧张。入院后查自身抗体ANA阳性,血糖28.85 mmol/L,肝肾功、血尿淀粉酶及血细胞分析等正常。诊断:(1)狼疮性胃肠炎;(2)SLE;(3)继发性糖尿病。予以抗感染、解痉止痛等对症治疗好转出院。之后9年间反复多次因“右下腹痛”等症状入院治疗,多次查血常规Hgb 90~100 g/L,尿蛋白(++)、血沉一般波动在38~100 mm/h之间,肿瘤标志物均正常。期间出现血压增高,最高160/100 mmHg(1 mmHg=0.133 kPa),一直服降压药治疗,血压控制稳定。胃镜检查提示慢性非萎缩性胃炎,肠镜检查提示慢性结肠炎,全消化道钡餐未见明显异常,腹部增强CT未见明显改变。均诊断为:(1)狼疮性胃肠炎;(2)SLE,狼疮性肾炎,肾性高血压病;(3)继发性糖尿病。每次予以抗感染、解痉等对症支持治疗后好转出院。
第一次手术:2010年3月4日因“反复右下腹疼痛10年,间断性发热3年”入本院。查体:腹部平坦,软,右下腹压痛,无反跳痛及肌紧张。腹部CT检查提示右侧髂窝脓肿可能,右侧升结肠、髂腰肌、腰大肌、腰方肌受侵,其内可见气泡影。肠镜检查未见明显异常。肿瘤标志物正常。余检查、检验结果基本同前。入院诊断右侧髂窝脓肿、SLE。于2010年3月10日行剖腹探查术。术中发现升结肠后壁可见一0.3 cm大小穿孔,与后方脓腔相连。遂行“右半结肠切除、回肠横结肠吻合术、右侧髂窝脓肿冲洗引流术”。术后病理结果回报:升结肠壁微小穿孔,慢性炎,伴浆膜面钙化;脓腔壁慢性炎症及炎性肉芽。术后脓液培养:肺炎克雷伯杆菌及铜绿假单胞菌生长。术后恢复顺利出院。
第二次手术:2012年7月开始因“反复左下腹隐痛”症状多次入院治疗,肠镜检查提示乙状结肠黏膜充血水肿,肠腔狭窄,活检提示慢性炎(图1)。腹部CT提示乙状结肠节段性增厚,考虑结肠炎,肿瘤不除外。后续多次复查CT提示乙状结肠增厚范围逐渐增大,伴肠腔狭窄(图2)。2015年肠镜提示进镜20 cm肠腔狭窄,无法继续进镜。钡灌肠检查提示乙状结肠远端肠腔狭窄并改变,新生物不除外(图3)。期间多次查自身抗体正常,结核抗体正常,肿瘤标志物正常。诊断(1)乙状结肠狭窄:肿瘤?结肠炎?克隆恩病?不全性梗阻;(2)SLE:狼疮性肾炎,肾性高血压病。2018年6月23日因“急性肠梗阻”在外院行“剖腹探查、横结肠造口术”,术中发现乙状结肠质地硬,肠壁及系膜挛缩,切除困难,并形成梗阻导致近端肠管扩张。术后恢复顺利,进食通畅,造口排便通畅。
第三次手术:患者横结肠造口术后多次到本院就诊,希望还纳造口。复查相关结果同前,诊断:(1)乙状结肠狭窄:狼疮性肠病?肿瘤?结肠炎?克隆恩病?不全性梗阻;(2)系统性红斑狼疮:狼疮性肾炎,肾性高血压病;(3)横结肠造口术后。经充分沟通讨论后,于2019年3月12日行“腹腔镜探查、肠粘连松解、乙状结肠切除、降结肠直肠吻合术”(图4)。术中发现乙状结肠系膜内多个大小不等的坚硬钙化结节相互融合,乙状结肠肠壁节段性增厚挛缩,僵硬狭窄形成不全性梗阻。术后病理报告:切除肠段挛缩狭窄,长约15 cm,肠壁及肠系膜坚硬,肠壁黏膜慢性炎,局部穿孔,肠壁浆膜面脂肪变性、液化性坏死,伴闭塞性血管炎,局部血管管壁变性,可见较多慢性炎性细胞浸润及钙盐沉积(图5、6)。术后患者康复出院,随访至今病情稳定。
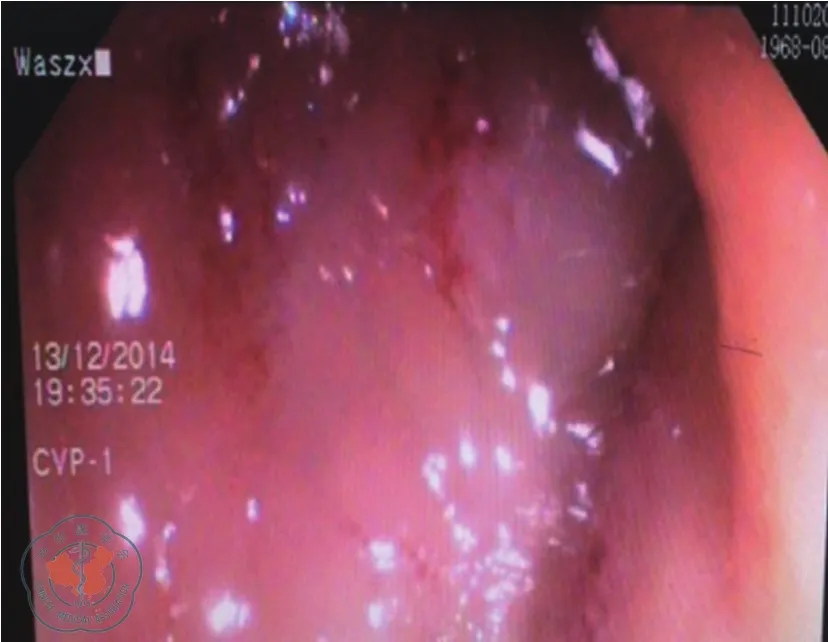
图1 肠镜见乙状结肠黏膜充血水肿,肠腔狭窄
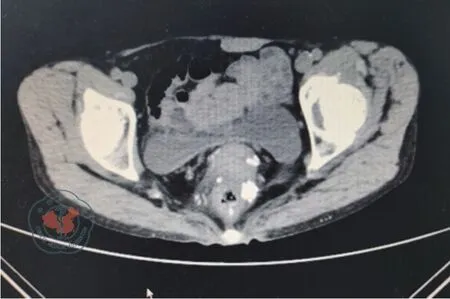
图2 CT见乙状结肠增厚伴肠腔狭窄,增强扫描后肠壁强化
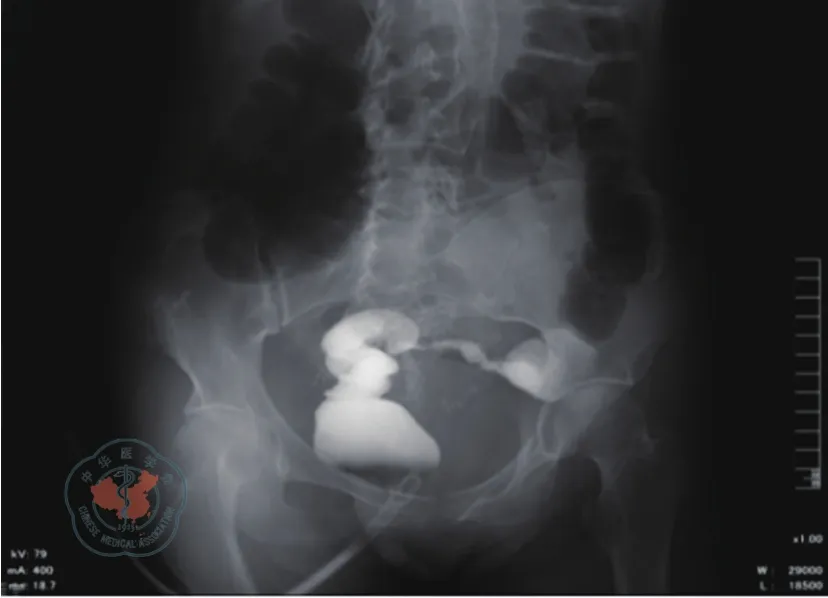
图3 钡灌肠见乙状结肠肠腔局限性狭窄,肠壁僵硬,蠕动消失
二、讨论
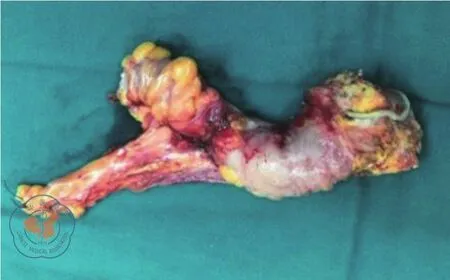
图4 切除病变肠段见肠壁及肠系膜坚硬挛缩,肠腔狭窄
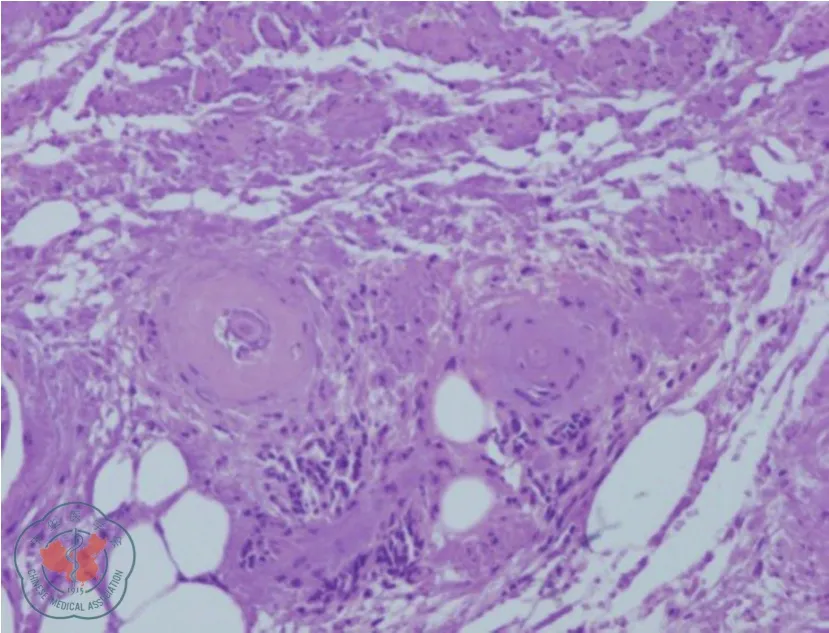
图5 病理见血管壁玻璃样变性(100×)
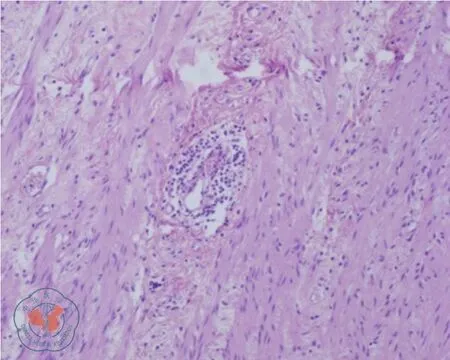
图6 病理见血管管壁炎性细胞浸润(100×)
SLE多发生于青年女性,起病隐匿缓慢,病程伴随终生。目前其病因尚不完全明确,常被认为是自身免疫系统被异常激活,体内产生大量免疫沉积物,使全身各脏器系统受损[7-8]。据报道,消化道系统受累的比例大约在20%~50%,它可以发生在SLE病程的任何阶段[1,4]。其临床表现形式多样,腹痛是最为常见的症状。它亦可表现为蛋白丢失性肠病、假性肠梗阻、炎症性肠病等症状。LMV及血管病变被认为是SLE在肠道的主要表现形式,但临床确诊较困难。因此当出现腹痛等症状时,尤其在消化道症状作为首发症状时,往往因其症状、体征较轻,缺乏特异性,无法完全明确是否为SLE合并消化道受累,除非在CT检查时发现典型的“靶形”或“梳齿状”特征[4]。
本例患者第一阶段的右下腹疼痛,初始在外院诊断为阑尾炎行阑尾切除术,术后仍然出现右下腹疼痛,临床诊断为狼疮相关性肠炎,考虑SLE累及消化道所致。但相关检查未发现消化道阳性改变,无法判断具体消化道的哪个部位受损,在治疗上只能以全身对症支持治疗为主。直到患者出现右侧髂窝脓肿后行第一次手术治疗,才发现反复右下腹疼痛与升结肠近端的慢性炎症改变相关。第二阶段的左下腹疼痛,随着病程的延长,出现乙状结肠肠壁增厚水肿,肠腔狭窄。患者反复腹痛近20年,从临床上准确诊断较为困难。当CT等检查无阳性改变的患者,肠系膜血管造影检查也许对LMV的诊断能够提供一定帮助[6]。从术后病理结果分析结肠及其系膜的病变与肠系膜血管病变的分布相吻合,主要为血管壁的炎症改变及变性坏死。但为何两次手术都发现结肠有慢性的微小穿孔仍然病因不明,可能与局部的缺血坏死或局部慢性炎性改变引起的溃疡穿孔有关。当SLE合并小肠病变时,因小肠血供丰富,很少出现相应肠段的缺血坏死或肠梗阻。而结肠的血供则相对较差,若出现肠系膜血管及肠壁血管的病变,更易出现病变肠管的慢性炎性改变。SLE患者往往出现多区域多灶性病变,此患者以后是否会出现肠道其他部位的病变我们无法得知。
总之,SLE引起的胃肠道病变症状常见,不易被明确诊断。治疗上除了激素治疗外,一般以对症支持治疗为主,手术仅用于出现梗阻、穿孔等急症。当SLE患者出现不明原因的结肠梗阻或穿孔时,需要行手术治疗。同时SLE引起的消化道病变也可能是多部位多发血管的改变,总的治疗原则仍然需要以控制疾病活动稳定为主。

