老年直肠黏液腺癌患者预后模型的构建
刘恒昌 李春香 魏然 刘正 陈海鹏 关旭 赵志勋 邹霜梅 王锡山 姜争
直肠黏液腺癌(rectal mucinous adenocarcinoma,RMAC)是一种特殊病理类型的直肠癌[1],约占直肠癌的5%~15%[2-3]。RMAC具有较独特的生物学行为,与非黏液腺癌相比,表现出较强的向周围组织浸润性生长的特性[4],术后更易发生复发或远处转移[5],且对于新辅助治疗和术后辅助放化疗的疗效均较差[6-8],这都导致RMAC患者的预后较差[9-10]。目前关于RMAC的预后,尤其是老年RMAC患者的预后,仍然按照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)制定的TNM分期进行预测。本研究拟通过收集美国国家癌症研究所的监测、流行病学和结果数据库(SEER)中登记的60岁及以上老年RMAC患者的临床病理资料,探讨影响老年RMAC患者预后的独立危险因素,并构建可以预测总生存(OS)和肿瘤特异性生存(CSS)的列线图,以期对这部分患者进行个体化的预后预测。
资料与方法
一、一般资料
收集2010年至2016年在SEER数据库中登记的RMAC的患者(ICD-O-3编码为8480/3),共1 657例。纳入标准:(1)确诊时年龄≥60岁;(2)组织学或脱落细胞学诊断为黏液腺癌;(3)行标准根治性手术治疗。排除标准:(1)随访信息不完整;(2)围术期发生死亡;(3)多原发癌。所有患者TNM分期均采用AJCC颁布的第七版直肠癌TNM分期。
二、收集指标
应用SEER*Stat软件(Version 8.3.6),收集患者以下信息:(1)患者基本资料(性别、确诊时年龄、确诊时的年份、种族、婚姻状态);(2)肿瘤基本资料(诊断方法、肿瘤大小、组织学分级、TNM分期、是否存在远隔器官转移、清扫淋巴结数量、阳性淋巴结数量);(3)治疗资料(手术方式、是否行新辅助放疗、是否行辅助化疗或放疗);(4)随访资料(生存时间、随访结果、死亡原因)。评价患者预后的两项指标为总生存率(overall survival,OS)和肿瘤特异性生存(cancer specific survival,CSS),其中OS终点定义为任何原因引起的死亡,CSS终点定义为因肿瘤引起的死亡。
三、统计学分析方法
应用R语言(Version 3.6.3)Caret包(Classification and Regression Training)对数据按照7:3的比例随机分为训练队列(70%)和验证队列(30%)。在训练队列中,应用SPSS 25.0对影响RMAC患者预后的因素进行Cox多因素回归分析,并将独立危险因素应用R语言构建预测OS和CSS的列线图。应用Bootstrap法在训练队列和验证队列中对模型进行验证,计算C指数(C-index),并绘制校准图。应用Kaplan-Meier法绘制生存曲线并计算5年生存率,组间生存率比较应用Log-rank检验。以P<0.05为差异有统计学意义。
结 果
一、患者基线资料
本研究共纳入619例RMAC患者,其中男性378例,女性241例,随访时间1~83个月,中位随访时间32个月。随机分为训练队列436例,验证队列183例。两组患者的人口学和肿瘤临床特征的基线资料见表1~2。

表1 619例老年RMAC患者人口学基线资料[例,(%)]
二、影响老年RMAC患者预后的独立因素
COX多因素回归分析结果显示,性别、年龄、婚姻状态、肿瘤分化程度、TNM分期、放疗、辅助化疗、阳性淋巴结数量和肿瘤大小是影响老年RMAC患者OS的独立预后因素,而婚姻状态、种族、肿瘤分化程度、TNM分期、辅助化疗、阳性淋巴结和肿瘤大小是影响老年RMAC患者CSS的独立预后因素。见表3。
三、构建列线图并验证
将COX多因素回归分析中得到的影响预后的独立因素,绘制预测3年和5年OS和CSS的列线图。见图1。
应用Bootstrap法对列线图进行1 000次有放回的抽样验证,结果显示,预测OS的列线图在训练队列内部验证的C指数为0.735,在验证队列中验证的C指数为0.717;预测CSS的列线图在训练队列内部验证的C指数为0.780,在验证队列中验证的C指数为0.741。校准曲线显示该列线图具有较好的预测效能。见图2。
四、对老年RMAC患者辅助治疗方式的探索
在预测老年RMAC患者OS和CSS的列线图中,我们发现辅助治疗(放疗和化疗)也是影响预后的独立因素,故对不同辅助治疗方案进行深入探索,发现新辅助放疗联合辅助化疗可以提高患者的 OS(χ2=7.682,P=0.006) 和 CSS(χ2=6.476,P=0.011),而仅行辅助化疗与单纯手术的五年OS和CSS均无明显差异,在术后辅助放疗的基础上使用辅助化疗也无法使患者受益(P>0.05)。见图3。
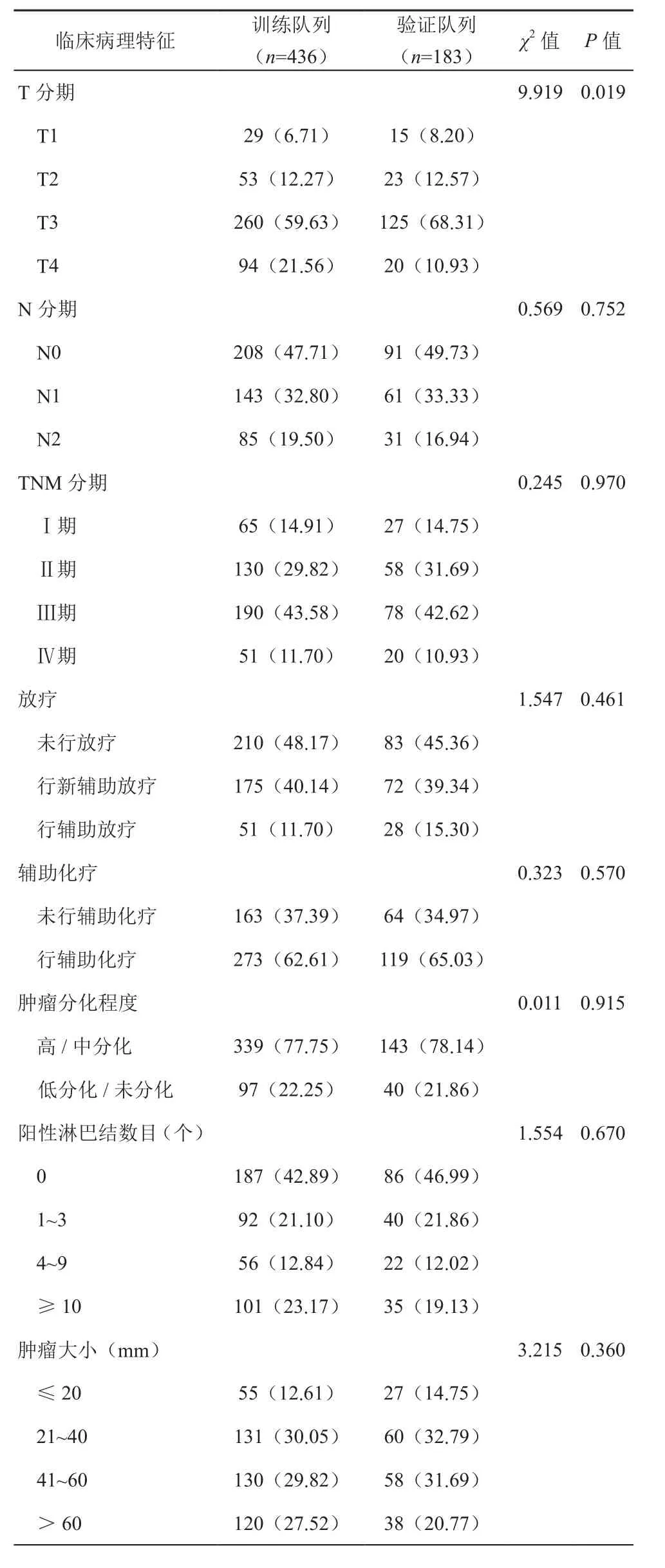
表2 619例老年RMAC患者肿瘤临床特征基线资料[例,(%)]

表3 影响老年RMAC患者OS和CSS的COX多因素分析

续表

图1 老年RMAC患者的3年和5年列线图预后模型。1A:OS预测模型;1B:CSS预测模型
讨 论
RMAC是直肠癌中恶性程度较高的一种病理亚型,患者的发病年龄普遍较年轻,且预后较差[11]。评估预后对于肿瘤患者的监测和随访都有十分重要的意义,但目前对于RMAC患者,临床上仍然以TNM分期和临床经验作为评价预后的主要依据,而没有一个较为完善的、量化的指标。列线图将影响预后的多种独立危险因素进行整合,并且可以量化各项指标对患者预后所占比重,以可视化的形式对患者的预后进行个体化评价[12]。目前,已有多种肿瘤都具有预测效能良好的列线图[13-14]。老年RMAC患者由于数量较少,单中心数据均较少,故关于其影响这部分患者预后的因素的研究也较少。本研究通过收集美国国家癌症研究所的监测、流行病学和结果数据库(SEER)中登记的RMAC患者,试图用较大的样本量来探寻影响老年RMAC患者预后的独立危险因素,并分析对这部分患者有效的治疗方式。
本研究应用COX多因素回归分析影响老年RMAC患者预后的因素,结果发现,男性、未婚或丧偶、未进行新辅助放疗和辅助化疗、年龄越大、TNM分期、组织学分级、阳性淋巴结数量以及肿瘤体积是影响OS的独立危险因素。而未婚或丧偶、未行辅助化疗、组织学分级、TNM分期越高、阳性淋巴结数量以及肿瘤体积是影响CSS的独立危险因素。肿瘤分化程度越低、TNM分期越高、阳性淋巴结数量越多以及肿瘤体积越大,患者预后越差,这与目前评价RMAC患者预后的标准类似,也与目前的研究结果类似[5,10,15]。这提示临床上针对这部分患者,要合理制定治疗方案,并严格随访。本研究利用上述因素构建了对OS和CSS预测较为完善的预测模型,无论是训练队列的内部验证还是在验证队列中进行验证,C指数都接近0.8,校准曲线也显示该模型预测能力与实际情况的一致性较好,这提示该模型具有良好的预测效能。
值得注意的是,本研究发现,新辅助放疗和辅助化疗对老年RMAC患者的预后具有积极意义。关于RMAC的治疗方案,目前仍按照腺癌的治疗方案进行,即新辅助放化疗联合TME手术治疗。但关于新辅助放疗对RMAC的治疗效果和对预后的影响,目前争论不一。大部分研究认为RMAC对新辅助放化疗并不敏感[16-17],且对预后的影响不大[18]。也有研究认为新辅助放疗联合手术治疗可以提高RMAC患者的OS[19-20]。本研究分析了不同的(新)辅助治疗方式对老年RMAC患者预后的影响,结果发现,新辅助放疗联合术后辅助化疗,较之单纯新辅助放疗,可以提高患者的OS和CSS,但单纯术后辅助放疗,或在此基础上添加辅助化疗,对患者预后影响无明显差异。这提示老年RMAC患者可以从新辅助放疗联合辅助化疗中受益。

图2 列线图校准曲线。训练队列3年(2A)和5年(2B)OS预测校准曲线;训练队列3年(2C)和5年(2D)CSS预测校准曲线;训练队列3年(2E)和5年(2F)OS预测校准曲线;训练队列3年(2G)和5年(2H)CSS预测校准曲线

图3 不同辅助治疗方式对预后的影响。仅行辅助化疗对OS(3A)和CSS(3D)的影响;新辅助放疗联合辅助化疗对OS(3B)和CSS(3E)的影响;术后辅助放疗联合辅助化疗对OS(3C)和CSS(3F)的影响
目前,国内外尚无直肠黏液腺癌患者预后的相关模型。李海超等[21]发现TNM分期、区域淋巴结转移、远处转移以及神经/脉管浸润是影响直肠黏液腺癌预后的重要因素;林延明等[10]发现TNM分期越晚、年龄越小,患者预后越差。Emile等[22]的研究也发现年龄、性别和T分期是影响RMAC患者局部复发和远处转移的独立危险因素。但这些研究均未将这些对预后造成影响的因素进行量化,对患者的预后也无法做出较为准确的评估。
本研究的不足之处在于:(1)为回顾性研究,可能存在一些未知的偏倚;(2)SEER数据库中没有给出详细的辅助化疗的方案,而不同辅助化疗方案可能会影响预后;(3)无法获得肿瘤标志物、基因突变等信息,预测模型还有待完善;(4)数据集中黄种人较少,无法探寻是否存在人种差异。
综上所述,本研究发现了影响老年RMAC患者预后的独立危险因素,构建了评价预后的列线图模型。并发现新辅助放疗联合术后辅助化疗可能会改善这部分患者的预后。

