动脉粥样硬化患者血清高迁移率族蛋白1对Th17/Treg平衡的调节作用研究
朱丹,郑延坤
【关键字】动脉粥样硬化;高迁移率族蛋白1;辅助性T细胞17;调节性T细胞;流式细胞术;细胞凋亡
动脉粥样硬化常见于心脑血管疾病患者,是此类患者的主要病理基础[1]。在全球范围内,动脉粥样硬化的发生率和死亡率较高,并且近年来呈逐渐增长趋势,对人们的生命健康造成严重影响[2]。高迁移率族蛋白1(HMGB1)属于非组蛋白家族成员,主要分布于细胞核内,参与DNA复制、转录及损伤修复过程[3]。已有的研究报道显示动脉粥样硬化患者中血清HMGB1水平明显上调,并且是非钙化性斑块形成的独立危险因素[4]。T淋巴细胞参与动脉粥样硬化形成的各个阶段,与动脉粥样硬化的发生发展密切相关[5]。白细胞分化抗原4+(CD4+)T细胞在白介素-2(IL-2)和肿瘤生长因子-β(TGF-β)等细胞因子的作用下诱导分化成调节性T细胞(Treg),其具有免疫抑制作用[6]。而CD4+T细胞在在白介素-6(IL-6)和白介素-1β(IL-1β)等细胞因子的作用下诱导分化成辅助性T细胞17(Th17)细胞,其具有炎症促进作用[7]。目前的研究报道显示HMGB1在免疫细胞的成熟过程中也起到重要作用[8],但是对于HMGB1对Th17和Treg细胞的调节作用以及HMGB1是否通过调节Th17/Treg细胞失衡来促进动脉粥样硬化的发生依然缺乏相应研究。本研究通过检测血清HMGB1水平、Th17和Treg细胞凋亡率以及重组高迁移率族蛋白1(rHMGB1)蛋白对Th17和Treg细胞比例的影响,旨在探讨动脉粥样硬化患者血清HMGB1对Th17/Treg平衡的调节作用,现报道如下:
1 资料与方法
1.1 研究对象选择2017年2月至2019年8月于首都医科大学附属北京同仁医院诊治的120例冠状动脉粥样硬化患者作为观察组,纳入标准:①经冠状动脉(冠脉)造影显示至少一支狭窄程度≥50%;②前3个月内未接受过抗炎抗菌药物治疗;③前6个月内未接受过免疫治疗。排除标准:①合并肿瘤患者;②肝肾功能障碍患者;③前3个月内有手术治疗史;④存在全身性感染性疾病患者;⑤合并糖尿病等代谢异常疾病患者。其中男性67例,女性53例。年龄51~68(60.84±8.91)岁。既往高血压史25例,冠心病史14例,吸烟史35例。同时选择120例冠脉造影显示无冠脉狭窄的作为对照组,其中男性64例,女性56例。年龄49~70(61.05±9.74)岁。既往高血压史27例,冠心病史11例,吸烟史38例。两组的性别比例、年龄和高血压史等一般资料比较,组间差异无统计学意义(P>0.05)。均与研究对象签署知情同意书,临床研究经首都医科大学附属北京同仁医院伦理委员会批准同意。
1.2 方法
1.2.1 外周血单个核细胞分离患者入院后清晨采集空腹静脉血5 ml至抗凝管中,采集后3 h内对血液样本进行处理。采用密度梯度离心法对观察组和对照组血液样本中的外周血单个核细胞进行分离,将10 ml血液加入到离心管中,加入10 ml预热的磷酸缓冲盐溶液(PBS)及10 ml预热的淋巴细胞分离液,混合均匀后,2000 r/min离心20 min。离心结束后分成四层,将第二层白色雾状层吸取到另一洁净离心管中,加入3 ml PBS缓冲液混合均匀。1000 r/min离心15 min后弃去上清液,加入500 μl PBS缓冲液重悬细胞沉淀,并采用血球计数板对细胞进行计数,将单个核细胞浓度调整至2×106/ml。
1.2.2 Annexin-V染色法检测对照组及观察组Treg和Th17细胞凋亡Treg细胞凋亡检测:取两支离心管,分别标记检测管和对照管,各加入100 μl单个核细胞溶液、10 μl的CD4-藻红蛋白(PE)-荧光素7(Cy7)抗体(美国Abcam科技有限公司,货号:ab210351)、10 μl的白细胞分化抗原25(CD25)-PE抗体(美国Abcam科技有限公司,货号:ab210335)和10 μl的白细胞分化抗原127(CD127)-藻蓝蛋白(APC)抗体(美国A b c a m 科技有限公司,货号:ab240225),冰上孵育30 min。加入500 μl的PBS溶液混合均匀后2000 r/min离心10 min。弃去上清液后,加入100 μl结合增强缓冲液重悬细胞,检测管中加入10 μl的膜联蛋白-V(Annexin-V)-异硫氰酸荧光素(FITC,美国Abcam科技有限公司,货号:ab14082),对照管中则加入10 μl的PBS,室温下孵育20 min后加入500 μl的PBS溶液混合均匀后2000 r/min离心10 min。弃上清液,加入500 μl的PBS溶液重悬后上流式细胞仪(美国贝克曼库尔特科技有限公司,型号:CytoFLEX)。
Th17细胞凋亡检测:取200 μl单个核细胞溶液于24孔板中,加入400 μl的RPMI1640培养基及10 μl的聚丙烯酸甲酯(PMA)溶液和10 μl的蛋白转运抑制剂A(BFA)溶液,继续培养6 h。取两支离心管,分别标记检测管和对照管,各加入100 μl处理后的单个核细胞溶液、10 μl的白细胞分化抗原3(CD3)-PE-Cy7抗体(美国Abcam科技有限公司,货号:ab 81992)和10 μl的白细胞分化抗原8(CD8)-APC抗体(美国Abcam科技有限公司,货号:ab252196)冰上孵育30 min。加入500 μl的PBS溶液混合均匀后2000 r/min离心10 min。弃去上清液后,加入200 μl的细胞固定剂,冰上孵育30 min。加入500 μl的PBS溶液混合均匀后2000 r/min离心10 min。弃去上清液后,加入200 μl的破膜剂和10 μl的白介素-17(IL-17)-PE抗体(美国Abcam科技有限公司,货号:ab 79056),冰上孵育30 min。加入500 μl的PBS溶液混合均匀后2000 r/min离心10 min。弃上清液,加入500 μl的PBS溶液重悬后上流式细胞仪。
1.2.3 血清HMGB1水平检测患者入院后清晨采集空腹静脉血3 ml,室温下静置1 h后,5000 r/min离心30 min,将上清液收集至另一洁净离心管中,-80℃冻存。血清HMGB1水平检测采用酶联免疫吸附法,采用HMGB1检测试剂盒(上海晶抗生物工程有限公司,货号:JK5185)进行检测,实验操作严格按照试剂盒说明书进行。
1.2.4 rHMGB1蛋白的细胞刺激实验rHMGB1蛋白浓度梯度处理:取100 μl单个核细胞溶液至5 ml的RPMI1640培养基(含20%的胎牛血清)中,混合均匀后置于T25瓶中进行培养。48 h后将细胞接种于96孔板中,1×104/孔,分别加入0 ng/ml(低剂量组)、10 ng/ml(中等剂量组)和100 ng/ml(高剂量组)的rHMGB1蛋白(上海科敏生物科技有限公司,货号:H00003146-P01,100 mg),37℃、5%CO2培养条件下处理24 h。
rHMGB1蛋白时间梯度处理:取100 μl单个核细胞溶液至5 ml的RPMI 1640培养基(含20%的胎牛血清)中,混合均匀后置于T25瓶中进行培养。48 h后将细胞接种于96孔板中,1×104/孔,均加入100 ng/ml的rHMGB1蛋白,于0 h、12 h和24 h收集细胞进行检测。
Treg细胞比例检测:取处理后的细胞100 μl,加入10 μl的CD4-FITC、10 μl的CD25-PE和5 μl的CD127-PE-Cy7抗体,冰上孵育30 min。加入500 μl的PBS溶液混合均匀后2000 r/min离心10 min。弃上清液,加入500 μl的PBS溶液重悬后上流式细胞仪。
Th17细胞比例检测:在处理后的细胞中加入10 μl的PMA溶液和10 μl的BFA溶液,继续培养6 h。培养结束后取出100 μl细胞悬液,各加入10 μl的CD3-FITC和CD8-APC抗体,冰上孵育30 min。加入500 μL的PBS溶液混合均匀后2000 r/min离心10 min。弃上清液,加入200 μl的固定剂,冰上孵育30 min。PBS清洗细胞后,加入100 μl破膜剂和10 μl的IL-17-PE抗体,冰上孵育30 min。加入500 μl的PBS溶液混合均匀后2000 r/min离心10 min。弃上清液,加入500 μl的PBS溶液重悬细胞后上流式细胞仪。
1.3 统计学分析采用SPSS 20.0统计学软件对临床数据进行分析。平均年龄、Treg和Th17细胞凋亡率等计量资料采用平均值±标准差的方式来表示,两组间采用独立样本t检验,多组间比较采用单因素方差分析。采用Pearson相关性分析对血清HMGB1水平与Treg细胞凋亡率及Th17细胞凋亡率的相关性进行检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组Treg细胞凋亡率、Th17细胞凋亡率和血清HMGB1水平比较观察组Treg凋亡率和血清HMGB1水平明显高于对照组,组间差异具有统计学意义(P<0.05)。两组Th17凋亡率的差异无统计学意义(P>0.05)(表1)。
2.2 血清HMGB1水平与Treg细胞凋亡率及Th17细胞凋亡率的相关性分析血清HMGB1水平与Treg细胞凋亡率呈正相关(r=0.792,P<0.05),而与Th17细胞凋亡率无相关性(r=0.112,P>0.05)(图1)。
2.3 不同浓度rHMGB1对对照组外周血单个核细胞中Treg和Th17细胞比例及Treg/Th17比值的影响中等剂量组和高剂量组Treg细胞比例和Treg/Th17比值明显低于低剂量组,而Th17细胞比例明显高于低剂量组,组间差异具有统计学意义(P<0.05)。高剂量组Treg细胞比例及Treg/Th17比值明显低于中等剂量组,组间差异具有统计学意义(P<0.05),而两组Th17细胞比例比较,组间差异无统计学意义(P>0.05)(表2)。
2.4 不同时间rHMGB1作用对对照组外周血单个核细胞中Treg和Th17细胞比例及Treg/Th17比值的影响12 h组和24 h组Treg细胞比例和Treg/Th17比值明显低于0 h组,而Th17细胞比例明显高于0 h组,组间差异具有统计学意义(P<0.05)。24 h组Treg细胞比例及Treg/Th17比值明显低于12 h组,组间差异具有统计学意义(P<0.05),而两组Th17细胞比例比较,组间差异无统计学意义(P>0.05)(表3)。
3 讨论
动脉粥样硬化的发生发展涉及多种因素相互作用,是一种发病机制极为复杂的慢性疾病[9]。目前学界认为感染假说、脂质假说以及炎症假说是动脉粥样硬化形成的主要机制,并且学界普遍认为动脉粥样硬化是一种慢性炎症性疾病,同时伴随严重的脂质代谢障碍[10,11]。在动脉粥样硬化斑块发展进程中,巨噬细胞、单核细胞、淋巴细胞和天然杀伤性细胞等免疫细胞大量浸润至病灶组织当中,促进局部组织的炎症反应,加剧病情的发展[12]。深入探究动脉粥样硬化的发病机制并从中寻找到动脉粥样硬化的有效治疗靶点对于动脉粥样硬化预防、诊断和治疗具有重要意义。
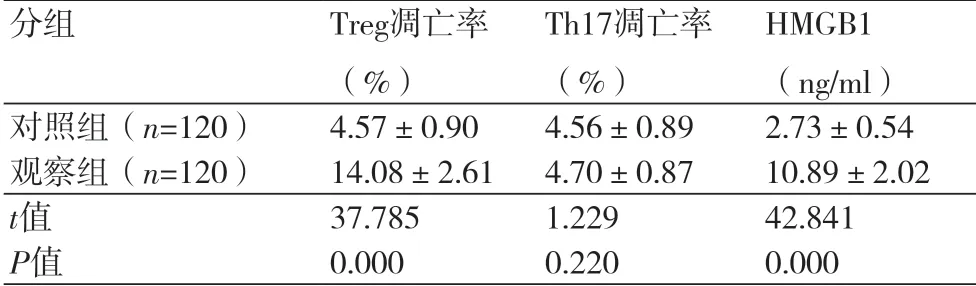
表1 两组Treg细胞凋亡率、Th17细胞凋亡率和血清HMGB1水平比较
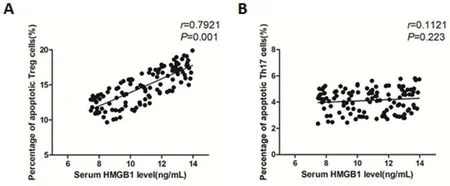
图1 血清HMGB1水平与Treg细胞凋亡率及Th17细胞凋亡率的相关性分析

表2 不同浓度rHMGB1对对照组外周血单个核细胞中Treg和Th17细胞比例及Treg/Th17比值的影响

表3 不同时间rHMGB1作用对对照组外周血单个核细胞中Treg和Th17细胞比例及Treg/Th17比值的影响
HMGB1是一种重要的免疫调节分子,已有的研究报道显示HMGB1能够通过激活核因子κB(NF-κB)炎症信号通路以及抑制T淋巴细胞功能起到免疫抑制的作用[13,14]。本研究发现观察组血清HMGB1水平和Treg细胞凋亡率明显升高,并且血清HMGB1水平和Treg细胞凋亡率呈正相关性,实验结果表明血清HMGB1水平升高可能与动脉粥样硬化的发生密切相关,并且在动脉粥样硬化发生过程中Treg细胞凋亡水平明显提高。分析其原因可能是由于HMGB1水平上调会促进Treg细胞内氧化应激的发生,已有研究报道显示HMGB1能够促进氧化应激的产生[15],并且氧化应激的发生会促进Treg细胞的凋亡[16],因此在动脉粥样硬化患者当中血清HMGB1水平升高会诱导Treg细胞发生氧化应激,进而促进Treg细胞发生凋亡,导致动脉粥样硬化患者体内Treg细胞凋亡率明显提高。同时,Bandala等[17]研究发现Treg细胞能明显抑制炎症反应的发生,而Proto等[18]则发现在HMGB1与炎症性疾病的发生密切相关,Treg细胞和HMGB1之间存在一定拮抗作用,因此在动脉粥样硬化患者体内由于炎症反应的存在引起患者体内炎症因子分泌紊乱,炎症因子活化NFκB炎症信号通路,引起患者血清HMGB1水平明显提高,由于HMGB1与Treg细胞之间的拮抗作用,HMGB1水平上调在抑制Treg细胞生长的同时促进Treg细胞凋亡,进而导致患者Treg细胞比例明显下降。进一步研究结果发现在rHMGB1蛋白的作用下,Treg细胞比例及Treg/Th17比值明显下降,分析其原因可能是由于Treg细胞的分化过程与细胞内代谢密切相关,细胞内代谢紊乱会导致Treg/Th17细胞平衡发生改变,Xu等[19]研究发现当细胞内谷氨酸转化成α-酮戊二酸的过程受到抑制,FOXO3基因的甲基化水平升高而导致FOXO3基因表达的下调,使得T淋巴细胞更倾向于分化成Treg细胞。而已有的研究报道显示HMGB1能够促进谷氨酸的代谢过程[20],因此在动脉粥样硬化患者中HMGB1可能通过促进谷氨酸转化成α-酮戊二酸,使得Treg细胞的分化过程受到抑制,导致Treg细胞比例明显下降。同时,Essig等[21]研究发现PI3K信号通路的活化会促进T淋巴细胞分化成Treg细胞,而Meng等[22]研究发现HMGB1能够抑制磷脂酰肌醇3-激酶(PI3K)信号通路的活化,因此在动脉粥样硬化患者当中血清HMGB1水平升高会抑制PI3K信号通路的活化,进而抑制T淋巴细胞分化成Treg细胞,导致Treg细胞细胞比例下降。在动脉粥样硬化患者中HMGB1会对患者体内的Th17/Treg平衡造成严重影响,使得T淋巴细胞分化成Treg细胞的过程受到抑制,使得机体处于免疫抑制状态,导致动脉粥样硬化患者的病情进一步恶化[23]。
综上所述,动脉粥样硬化患者体内HMGB1水平明显升高,并且Treg细胞凋亡水平明显上调,HMGB1可能通过抑制患者体内Treg细胞比例以促进动脉粥样硬化的发生发展。因此HMGB1是动脉粥样硬化疾病的潜在靶点,在动脉粥样硬化的诊断和治疗中具有一定临床意义。

