TACE联合索拉非尼治疗BCLC-C期肝癌的有效性及安全性
朱义江,殷 亮,储森林,周春泽,谢 晟
(1.中国科学技术大学附属第一医院介入放射科,安徽 合肥 230001;2.中日友好医院放射科,北京 100029)
肝细胞癌(hepatocellular carcinoma, HCC)是消化系统常见的高死亡率恶性肿瘤之一[1],手术切除是治疗早期HCC的首选方法,但多数患者确诊时已为中晚期,失去手术根治时机。TACE主要用于治疗不符合根治性切除条件的晚期HCC患者[2-3],但单用TACE治疗往往难以获得满意疗效,原因之一为肿瘤坏死后缺氧加剧,血管内皮生长因子(vascular endothelial growth factor, VEGF)分泌增加,促进肿瘤血管生成[4-5]。对接受TACE患者给予抗血管生成治疗,有助于提高临床疗效、抑制肿瘤复发转移和延长患者生存期。索拉非尼(Sorafenib)是口服多激酶抑制剂,可抑制新生血管相关受体活性及VEGF等细胞因子分泌,从而阻断肿瘤新生血管生成,延缓肿瘤生长。本研究观察TACE联合索拉非尼对巴塞罗那临床肝癌(Barcelona clinic liver cancer,BCLC)-C期HCC的有效性及安全性。
1 资料与方法
1.1 一般资料 回顾性分析2010年1月—2018年12月73例BCLC-C期HCC患者,男68例,女5例,年龄35~88岁,平均(55.1±11.9)岁。纳入标准:①符合美国肝病研究协会HCC诊断标准[6];②BCLC-C期[7];③肝功能Child-Pugh分级A或B级;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分为0或1分;⑤白细胞计数≥2 000/μl,血红蛋白≥8.0 g/dl,血小板计数≥6.0×104/μl;⑥肿瘤体积小于肝脏总体积的70%。排除标准:①曾接受全身化学治疗、靶向治疗等;②并发其他原发性恶性肿瘤或其他严重疾病;③TACE禁忌证;④严重凝血障碍。根据治疗方法将患者分为TACE组(n=38)和TACE+Sorafenib组(n=35)。
1.2 仪器与方法 采用GE 3820S DSA机为介入引导设备。对2组均行TACE治疗。以改良Seldinger法穿刺右侧股动脉,行腹腔动脉、肝动脉、膈下动脉及肠系膜上动脉造影,确定肿瘤供血动脉。将2.8F微型导管(Progreat,Terumo)超选择插入肿瘤供血动脉,注射奥沙利铂(100~200 mg)和/或氟尿嘧啶苷(500~1 000 mg),而后在透视下注入表阿霉素(30~60 mg)与5~25 ml碘化油混合液(根据肿瘤病灶数量、大小及血供情况确定具体剂量),栓塞终点为供血动脉血流停滞。
对TACE+Sorafenib组于TACE术后第4天予以口服索拉非尼每次400 mg,2次/天。如出现不可耐受的不良反应,则将剂量调整为每次200 mg、2次/天,或停用2周待症状缓解后再给予索拉菲尼,至少服用3个月或至病情进展。服药期间如肝功能进展为Child-Pugh C级或失访或出现耐药则停药。
术后每隔1个月复查,如影像学检查发现新病灶和残留病灶,则再次行TACE,方法同前。
1.3 观察指标及研究终点 ①疗效评价:术后1个月行CT或MR增强扫描,由2名放射科主任医师对随访图像与基线图像进行比较,采用改良实体瘤疗效评价标准(modified response evaluation criteria in solid tumors, mRECIST)标准[8]评价疗效,分为完全缓解(complete response,CR)、部分缓解(partial response, PR)、稳定(stable disease, SD)及进展(progressive disease, PD)。计算客观缓解率(objective response rate,ORR)=(CR+PR/总例数)×100%及疾病控制率(disease control rate,DCR)=(CR+PR+SD/总例数)×100%;②不良反应:参照美国国立癌症研究所不良反应分级标准3.0[9],观察2组不良反应发生情况;③疾病进展时间(time to progression,TTP)及总生存期(overall survival,OS):TTP为开始TACE治疗至疾病进展的时间,OS指自首次TACE术后至死亡或研究终点(疾病进展或末次随访)的时间间隔。
1.4 统计学分析 采用SPSS 20.0统计分析软件。计量资料以±s表示,组间比较采用独立样本t检验;计数资料组间比较采用χ2检验;生存分析采用Kaplan-Meier法,以Log-rank检验进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 TACE+Sorafenib组患者年龄(54.6±12.1)岁、肿瘤直径(6.92±2.14)cm,TACE组分别为(52.3±11.4)岁、(7.45±3.22)cm,组间差异均无统计学意义(t=1.28、1.46,P=0.33、0.28)。2组患者性别、肿瘤数量、门静脉癌栓、乙型肝炎、AFP、ECOG、Child-Pugh分级及肝外转移差异均无统计学意义(P均>0.05),见表1。
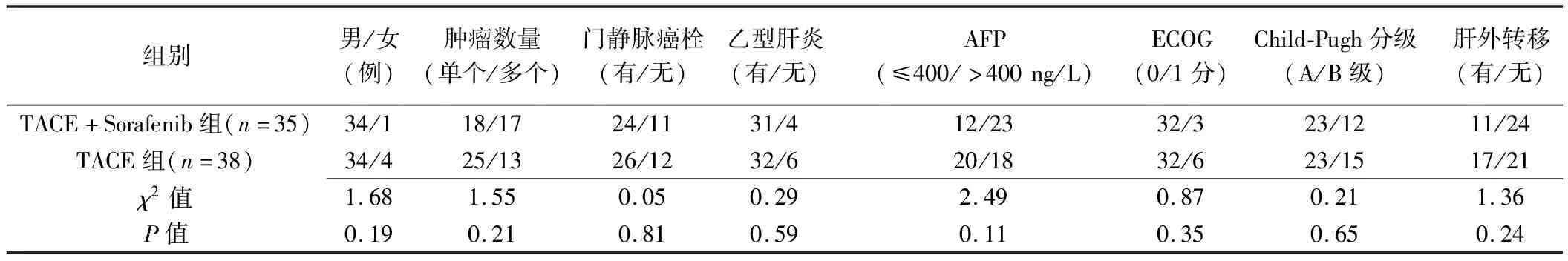
表1 2组患者基线资料比较(例)
2.2 治疗效果 术后1个月,TACE+Sorafenib组DCR为82.86%(29/35)、ORR为42.86%(15/35),TACE组为60.53%(23/38)、28.95%(11/38),TACE+Sorafenib组DCR高于TACE组(χ2=4.43,P=0.04),2组ORR差异无统计学意义(χ2=0.99,P=0.32),见表2及图1、2。
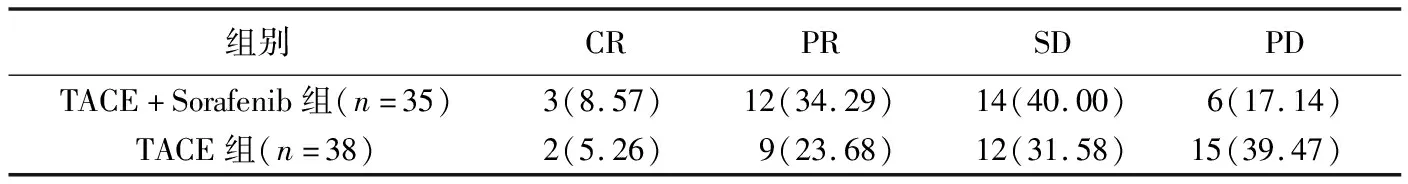
表2 治疗1个月后2组治疗效果[例(%)]

图1 患者男,54岁,BCLC-C期HCC,TACE+Sorafenib组 A.增强CT图像示肝脏右叶团块状异常强化灶;B.行TACE;C.术后1个月复查CT示病灶内散在碘油沉积;D.术后3个月,肝内病灶体积明显缩小,病灶内碘油沉积致密
2.3 不良反应 2组不良反应主要包括胃肠道反应、骨髓抑制、皮肤反应及肝功能异常。TACE+Sorafenib组出现皮肤反应27例、口腔黏膜炎25例、高血压12例,TACE组分别为1、2、2例,组间差异有统计学意义(χ2=42.78、P<0.001,χ2=34.22、P<0.001,χ2=9.92、P=0.002);2组间其他不良反应差异均无统计学意义(P均>0.05)。上述不良反应均较轻,经对症治疗后均明显减轻或消失,未对后续治疗产生明显影响。2组均未见严重不良反应发生。
2.4 预后 TACE+Sorafenib组术后3、6个月和1年生存率分别为82.86%(29/35)、71.43%(25/35)和45.71%(16/35),TACE组分别为57.63%(20/38)、42.11%(16/38)和21.05%(8/38),TACE+Sorafenib组均高于TACE组(χ2=7.54、6.36、5.02,P=0.01、0.01、0.03)。TACE+Sorafenib组中位OS为13.6个月,中位TTP为6.5个月,TACE组分别为6.5、3.3个月,TACE+Sorafenib组均高于TACE组(P=0.004、0.007,图3)。
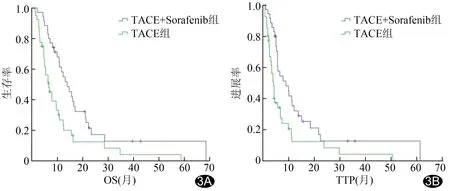
图3 TACE+Sorafenib组及TACE组的Kaplan-Meier生存曲线 A.OS;B.TTP
3 讨论
HCC的主要病因是乙型肝炎病毒感染[10],其发病隐匿,确诊时多处于中晚期,失去外科手术治疗机会。作为一线治疗手段,TACE在治疗不能切除的晚期HCC中发挥着重要作用。既往研究[11-12]证实,TACE可显著延长晚期肝癌患者OS,但术后复发率高,6个月内复发率高达29%。
分子靶向药物是目前治疗肿瘤研究热点,也是治疗HCC的方向。索拉非尼为常用分子靶向药物,在治疗晚期HCC方面显示出巨大潜力,可延长患者生存期,且药物耐受性良好[13-14]。国际权威指南推荐索拉非尼作为晚期HCC的标准治疗方案,于姑息性手术后早期应用索拉非尼可延缓肿瘤复发[9]。索拉非尼一方面通过抑制Raf激酶抑制/丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase, MEK)/细胞外调节蛋白激酶(extracellular regulated protein kinase, ERK)信号通路;另一方面通过抑制血管内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR-2)及受体3(VEGFR-3)、血小板衍生生长因子受体-β(platelet-derived growth factor receptor-β, PDGFR-β)、受体型酪氨酸蛋白激酶FLt-3等而抑制癌细胞增殖及肿瘤细胞血管生成,并诱导肝癌异位种植凋亡[15-17]。TACE治疗后,由于肿瘤血管被栓塞,肿瘤细胞处于缺血缺氧状态,促进VEGF、胰岛素样生长因子2(insulin like growth factor, IGF-2)等血管生成因子分泌,诱导肿瘤新生血管生成;而新生血管和肝内其他血管形成侧支循环,增加复发和转移概率,影响预后[18]。理论上TACE联合索拉非尼靶向治疗具有互补的抗肿瘤作用。目前国内相关研究[15]主要关注TACE联合索拉非尼治疗BCLC-B期HCC,且疗效存在争议;对于BCLC-C期HCC的整体治疗效果尚未明确。

图2 患者女,58岁,BCLC-C期HCC,TACE组 A.术前增强CT图像示肝右叶下段病灶明显强化;B.DSA示病灶存在明显肿瘤染色和肿瘤血管;C.栓塞术后造影示肿瘤染色基本消失;D.术后1个月增强CT示病灶内碘油沉积良好
本研究对BCLC-C期HCC患者给予TACE联合索拉非尼组治疗,治疗1个月后DCR为82.86%,高于单纯TACE;随访结果显示TACE+索拉非尼组治疗3、6个月和1年生存率,以及OS、TTP均高于单纯TACE组,证实TACE联合索拉非尼治疗可显著改善BCLC-C期HCC患者预后,与既往研究[19]结果相符。治疗期间2组患者均出现发热、白细胞减少、肝损害、胃肠道反应等不良反应,但组间差异无统计学意义;TACE+Sorafenib组皮肤反应、口腔黏膜炎、高血压发生率虽高于TACE组,但经对症处理后症状均逐渐缓解,未影响后续治疗,提示联合治疗的安全性较好。
综上所述,TACE联合索拉非尼治疗BCLC-C期HCC的效果及安全性均较好,可显著延长患者生存时间。但本研究入组患者例数相对较少,且随访时间有限,尚待进一步观察。

