超声引导下经皮射频消融治疗多囊肝病的有效性及安全性
张姗姗,董 刚*,孙璐璐,任志刚,纪晓惠,吴 洁,刘婷婷,彭梦凡
(1.郑州大学第一附属医院超声科,2.感染科,河南 郑州 450052;3.河北医科大学第四医院超声科,河北 石家庄 050011)
多囊肝病(polycystic liver disease, PLD)是一种遗传性疾病,以肝脏多发散在囊肿为特征,常伴多囊肾。PLD早期无明显临床症状,随着囊肿进展,肝脏体积增大,可出现腹痛、腹胀、恶心、呕吐等临床表现[1-2]。目前临床尚无治疗PLD的标准方案,且治疗后并发症多、复发率高[3]。本研究观察超声引导下射频消融(radiofrequency ablation, RFA)治疗PLD的有效性及安全性。
1 资料与方法
1.1 一般资料 回顾性分析2018年1月—2019年12月14例接受超声引导下RFA治疗的PLD患者,男4例,女10例,年龄35~64岁,平均(51.8±8.2)岁;均合并多囊肾;主要临床症状均为上腹部饱胀感,伴或不伴腹痛。纳入标准:经肝脏增强CT或增强MRI确诊PLD;肝功能Child-Pugh分级A级;凝血功能正常。排除存在全身性感染等消融禁忌证者。
1.2 仪器与方法 采用立德公司LDRF-120S多极RFA系统(冷循环),以Philips EP IQ7超声诊断仪为引导设备,探头型号C5-1,频率1~5 MHz。
术前患者禁食、水8 h,酌情行肠道准备。嘱患者平卧,先行超声检查,评估消融范围并拟定消融进针方案。全身麻醉后,于超声引导下将17G消融电极(带抽吸侧孔)经皮置入囊肿内,以起始功率120 W行RFA治疗。对单个直径>5 cm囊肿或单个直径2~5 cm、相邻囊肿直径之和>5 cm者,先将消融电极置入囊内,抽净囊液,待囊壁皱缩至附着于电极后对囊肿回缩区进行消融,至囊壁被强回声覆盖后结束消融;对直径<2 cm单个囊肿无需抽液,将消融电极直接置入囊肿聚集区,启动消融,至囊肿及囊壁被强回声覆盖后结束治疗。见图1。
1.3 相关指标观察 观察术后有无出血、胆瘘、腹腔积液等并发症。于术前与术后1周检测肝功能指标,包括丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)和总胆红素(total bilirubin, TBIL)。比较术前与术后12个月患者肝内囊肿总体积,并统计复发情况。
1.4 统计学分析 采用SPSS 21.0统计分析软件。计量资料符合正态分布者以±s表示,组间比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
14例PLD中,13例顺利完成RFA,1例因术中出血而中止治疗。13例RFA后即刻囊腔消失、肝内囊肿总体积缩小,腹胀较术前明显好转。术后第1天,3例患者出现上腹部轻度疼痛,考虑为术后反应,给予保肝、抗感染等处理后好转;2例自诉夜间恶心、呕吐,无其他不适,给予营养支持、补液等对症处理,症状好转。术后1周症状明显缓解率92.31%(12/13)。术后12个月,1例因肝内最大囊肿囊壁未消融完全而复发,12例未复发。
术前与术后1周ALT、AST、TBIL水平差异均无统计学意义(P均>0.05),见表1。
表1 PLD患者术前与术后1周ALT、AST、TBIL比较(±s,n=13)
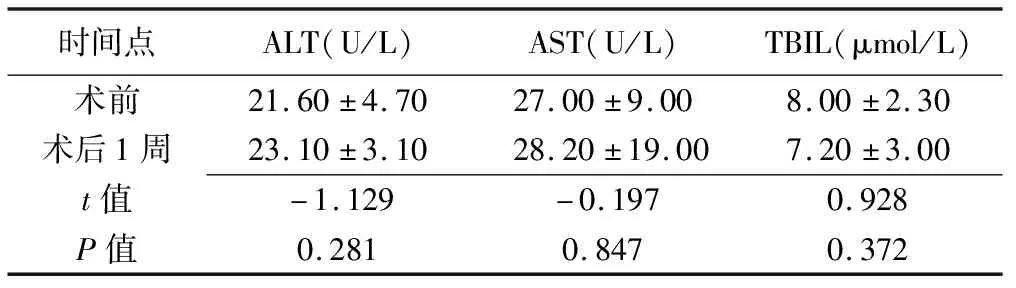
表1 PLD患者术前与术后1周ALT、AST、TBIL比较(±s,n=13)
时间点ALT(U/L)AST(U/L)TBIL(μmol/L)术前21.60±4.7027.00±9.008.00±2.30术后1周23.10±3.1028.20±19.007.20±3.00t值-1.129-0.1970.928P值0.2810.8470.372
13例PLD患者术前肝内囊肿总体积为2 573.35~5 960.11 cm3,平均(4 068.91±1 145.11)cm3;术后12个月为1 305.70~2 862.23 cm3,平均(2 027.17±584.70)cm3,肝内囊肿总体积缩小率26.33%~63.03%,平均(49.60±10.04)%,较术前缩小明显(t=9.259,P<0.001)。见图2。

图2 患者男,56岁,PLD,行超声引导下RFA治疗 A.术前CT示多囊肝;B.射频消融术后12个月复查CT,肝内囊肿总体积较术前明显缩小
3 讨论
目前临床治疗PLD的常用方法包括超声引导下囊肿穿刺抽液及硬化治疗、腹腔镜下或开腹开窗去顶术、肝部分切除术、肝切除联合囊肿开窗及肝移植等,均存在不同程度缺陷[4-5]。囊肿抽液及硬化治疗的主要缺点为过量乙醇易致乙醇中毒,囊壁冲洗不彻底致硬化剂不能充分接触囊壁,囊壁毁损不完全易致复发,常需多次引流及硬化治疗,可致肝组织纤维化,且抽液减压后囊肿不易回缩[6-7]。囊肿开窗术仅适用于靠近肝表面的囊肿,对位置较深的囊肿无法开窗,单纯囊肿开窗不能有效治疗PLD[8-9]。肝叶切除术可有效缓解症状,复发率低,但术后并发症发生率较高[10-11]。肝切除联合囊肿开窗术可弥补单纯囊肿开窗的不足,通过肝部分切除治疗深部囊肿,可在缓解症状的同时有效缩小肝体积,但创伤大[12-13]。肝移植治疗后患者需终身进行免疫治疗,且肝供体缺乏、治疗费用高[14-15]。
RFA通过电极发射频繁变化的高频交变电流,使组织细胞内的导电离子或极化分子快速变换方向,相互振荡,摩擦产生热能,导致局部温度达100 ℃左右,使组织细胞迅速发生蛋白变性并产生不可逆凝固坏死,从而达到治疗目的。近年来,RFA逐渐用于治疗实体肿瘤,具有疗效确切、创伤小、安全性高、可重复应用等优势[16-17],但用于治疗肝脏囊性病变的研究相对较少。RHIM等[18]将RFA用于治疗先天性肝囊肿,获得了较好的临床疗效。DU等[19]以RFA治疗63例肝单发或多发囊肿,对直径>5 cm囊肿先冲洗后行RFA,34例(囊肿直径<5 cm)治疗后3个月未见复发,21例(直径5~10 cm)囊肿体积缩小70%以上,8例(直径>10 cm)囊肿体积缩小60%。KIM等[20]的研究结果进一步证实了RFA治疗的有效性及安全性。PAI等[21]采用RFA治疗6例胰腺囊性肿瘤,术后3~6个月2例囊肿完全吸收,3例囊肿直径减小48.4%,提示RFA治疗胰腺囊性病变疗效确切。
PLD源于与胆道系统脱离的胆管上皮细胞过度增殖和过度分泌,形成肝内大小不等的多发囊肿。本研究利用RFA的热效应使囊肿内壁细胞凝固发生不可逆坏死,毁损囊壁,使其失去分泌能力,囊肿复发的基础不复存在。对于中等大小囊肿(直径2~5 cm且相邻直径之和>5 cm)及较大囊肿(直径>5 cm),先以消融电极穿刺至囊肿内,抽净囊液使囊壁皱缩附着于消融电极,而后再行RFA治疗。其主要优点如下:①可使囊壁充分受热,以充分破坏囊肿内壁上皮细胞,致囊肿复发基础不复存在,以预防复发[18];②使RFA范围减小,降低对正常肝组织的损伤。对于小囊肿(直径<2 cm),可直接启动消融损毁,彻底消除复发因素,避免术后复发,有望达到临床彻底治愈。
本组对13例PLD成功完成消融治疗,术后1周症状明显缓解率为92.31%(12/13),肝功能均正常;术后12个月,12例肝内囊肿总体积明显缩小。以上结果提示,RFA治疗PLD效果较好,对周围组织损伤小,在有足够正常肝实质前提下实施RFA治疗,对肝功能无影响。操作主要关键点:①穿刺抽液过程中应缓慢抽吸,以避免囊腔压力骤减而引起出血;②术中必要时可根据肝内囊肿数目、大小及分布范围等调整消融电极位置及方向,实现1个穿刺点消融尽可能多的囊肿;③RFA起始功率设为120 W,消融时间约30 s~2 min,以超声显示强回声范围覆盖整个囊腔及囊壁为结束标识。
综上所述,RFA治疗PLD创伤小,恢复快,术后囊腔即刻消失,可迅速缓解症状,并发症发生率及复发率均较低。但本组样本量小、随访时间短,尚待进一步观察。

