长链非编码RNA LINC01296对胃癌细胞增殖的影响及其机制
钊雯婧,杨芬,夏睿,吴鹏,陈锦飞
1南京医科大学附属南京医院 南京市第一医院,南京210006;2南京医科大学;3南京市胸科医院
胃癌是常见的消化道恶性肿瘤之一,其发病率和病死率均较高,但发生机制仍不明确[1]。长链非编码RNA(lncRNA)是一类转录本长度超过200 nt,缺少完整开放阅读框,没有蛋白编码功能的RNA分子,在非编码RNA中占有相当大的比例,参与多种表观调控及肿瘤发生过程[2]。lncRNA最初被认为是基因在转录过程中的“暗物质”,是RNA聚合酶Ⅱ转录的副产物,不执行生物学功能;但是最近的研究发现,lncRNA可在表观遗传水平、转录和转录后水平调控基因表达,影响基因的生物学功能,从而参与多种疾病的发生与发展[3,4]。研究表明,lncRNA异常表达可以影响肿瘤细胞增殖、侵袭和迁移等生物学功能,在肿瘤形成过程中发挥促癌基因或者抑癌基因的作用[5]。2017年10月~2019年10月,本研究观察了LINC01296在胃癌细胞中的表达变化及其对胃癌细胞增殖的影响,并探讨其可能的机制。现报告如下。
1 材料与方法
1.1 材料 细胞:人胃癌细胞系SGC-7901、BGC-823及人正常胃黏膜上皮细胞GES1均购自中国科学院上海生命科学研究院细胞资源中心。主要试剂:FBS购自美国Scien Cell公司,DMEM购自美国Gibco公司,转染试剂Lipofectamine2000、Opti-MEM分别购自美国Invitrogen、Gibco公司,反转录及荧光定量PCR试剂盒购自日本TaKaRa公司;小干扰RNA(siRNA)以及阴性对照RNA(siNC)均由广州锐博生物科技有限公司设计合成。
1.2 细胞LINC01296表达检测 采用实时荧光定量PCR法。将SGC-7901、BGC-823及GES1细胞接种于含有10% FBS的DMEM培养基,置于37 ℃、5% CO2恒温培养箱中进行培养。取对数生长期细胞,采用TRIzol法提取细胞总RNA,Thermo NanoDrop 2000超微量分光光度计检测RNA浓度和纯度,光密度(OD)260/2801.9~2.1为合格的RNA样本。取总RNA 1 μg,逆转录获得cDNA,进行荧光定量PCR检测。LINC0296上游引物5′-AGGCTGACTCAGGAAATGCTT-3′,下游引物5′-TGCTTTATTGTGGTGGTCTCG-3′,引物长度21 bp;内参β-actin上游引物5′-CTCACCATGGATGATGATATCGC-3′,下游引物5′-AGGAATCCTTCTGACCCATGC-3′,引物长度23 bp。采用2-ΔΔCt法计算LINC01296相对表达量。
1.3 LINC01296对胃癌细胞增殖能力的影响观察
1.3.1 细胞转染 转染前1天将SGC-7901、BGC-823细胞置于6孔板中培养,待第2天细胞融合度达70%左右时进行转染。采用Opti-MEM分别孵育siRNA、siNC及Lipofectamine2000,静置5 min。将Opti-MEM与Lipofectamine2000混合液体分别加入siRNA与siNC中,混匀后静置20 min。将SGC-7901、BGC-823细胞各分为两部分,分别加入上述siRNA与siNC进行转染,转染24 h收集细胞。
1.3.2 细胞增殖能力检测 ①CCK-8法:收集分别转染siRNA、siNC 24 h后的SGC-7901、BGC-823细胞,以3×103/孔接种于96孔板,并设置5个复孔。加入完全培养基,使每孔终体积为200 μL,置于细胞培养箱中培养6 h。每孔加入CCK-8试剂20 μL,置于细胞培养箱中培养2 h,使用酶标仪检测波长450 nm处的OD值。实验重复3次,取平均值。②克隆形成实验:收集分别转染siRNA、siNC 24 h后的SGC-7901、BGC-823细胞,以1×103/孔接种于6孔板,置于细胞培养箱中培养,每3 d换液1次。10~14 d后细胞形成肉眼可观察到的克隆集落,弃去培养基,PBS冲洗2次。4%多聚甲醛固定30 min,0.1%结晶紫染色20 min,清洗后干燥,肉眼观察计数克隆形成数。实验重复3次,取平均值。
1.4 LINC01296在胃癌细胞中的分布观察 采用胞质胞核分离实验。将SGC-7901、BGC-823细胞接种于10 cm×10 cm培养皿中,至细胞融合度为90%时收集细胞。使用PARIS试剂盒进行细胞核和细胞质组分的分离,PBS冲洗后胰酶消化细胞。将细胞转移至2 mL EP管中,4 ℃条件下500 r/min离心5 min,弃去上清。加入fractination Buffer 500 μL,轻轻吹打后冰上静置5 min。再次在相同条件下离心,上清即为细胞质,将上清转移至新的2 mL EP管中,沉淀即为细胞核。分别对细胞核和细胞质进行RNA提取及逆转录,参照1.2采用实时荧光定量PCR法检测LINC01296在细胞核和细胞质中的CT值,计算相对表达比例。细胞核相对表达比例=2细胞核CT-细胞质CT/(1+2细胞核CT-细胞质CT)×100%,细胞质相对表达比例=1-细胞核相对表达比例。实验重复3次,取平均值。
1.5 LINC01296与EZH2、SUZ12的相互作用观察 采用RNA结合蛋白免疫共沉淀实验。将SGC-7901、BGC-823细胞分别溶解于完整的RIP裂解缓冲液中,RIP裂解缓冲液含蛋白酶抑制剂和磷酸酶抑制剂。4 ℃条件下,将细胞提取物与特定抗体偶联的磁珠或对照IgG进行孵育,孵育时间6 h;将磁珠洗净并与蛋白酶K孵育以去除蛋白质,冰上孵育5 min,4 ℃条件下10 000 r/min离心10 min。室温条件下,将磁珠与IP级抗EZH2抗体或抗SUZ12抗体5 mg混合,旋转孵育30 min。取上清液,加入RNA免疫沉淀缓冲液中,4 ℃过夜。同时对正常对照IgG进行检测,以确保检测到的信号来自与蛋白质特异性结合的RNA。将产物进行荧光定量PCR检测,以IgG作为阴性对照,其与LINC01296的结合设为1,分析LINC01296相对于IgG结合EZH2和SUZ12情况。
2 结果
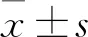
2.1 胃癌细胞SGC-7901、BGC-823及GES1细胞LINC01296表达比较 SGC-7901、BGC-823及GES1细胞LINC01296相对表达量分别为4.04±1.64、5.33±1.32、1.41±0.01,SGC-7901、BGC-823细胞LINC01296相对表达量均高于GES1细胞(P均<0.05)。
2.2 SGC-7901、BGC-823细胞转染前后OD值和克隆形成个数比较 转染siRNA、siNC的SGC-7901细胞OD值分别为1.20±0.03、1.38±0.02,克隆形成数分别为(112.56±5.22)、(256.14±6.42)个,二者比较P均<0.05;转染siRNA、siNC的BGC-823细胞OD值分别为1.50±0.04、1.73±0.22,克隆形成个数分别为(98.21±5.56)、(203.76±5.31)个,二者比较P均<0.05。
2.3 LINC01296在SGC-7901、BGC-823细胞核与细胞质中的相对表达比例比较 LINC01296在SGC-7901细胞核与细胞质中的相对表达比例分别为82.13%±1.97%、17.87%±1.97%,在BGC-823细胞中分别为94.22%±0.90%、5.81%±0.89%;LINC01296在SGC-7901、BGC-823细胞核中的相对表达比例均高于细胞质(P均<0.05)。
2.4 LINC01296与EZH2、SUZ12的相互作用结果 SGC-7901细胞中LINC01296相对于IgG与EZH2、SUZ12结合的相对表达量分别为7.83±0.68、4.52±0.87,BGC-823细胞分别为9.15±0.56、5.01±0.27。
3 讨论
目前我国胃癌的诊断主要依赖于胃镜下取活组织检查,该检查为有创检查,不易为患者接受[6,7]。虽然一些肿瘤标志物(CA125、CEA)与可用于胃癌筛查,但是其特异度和敏感度较低,大部分患者确诊时已经发展为进展期胃癌,5年生存率较低,预后较差[8]。因此,临床上亟需找到特异度和敏感度均较高的肿瘤标志物,以提高胃癌早期诊断率,从而改善患者预后。在人类基因组中,大约有23 000个lncRNA参与了X染色体沉默、基因组印记以及染色质修饰、转录激活、转录干扰、核内运输等。lncRNA可作为促癌基因或者抑癌基因,通过参与调控肿瘤细胞的增殖、迁移、转移、凋亡、血管形成等过程,在肿瘤的发生发展过程中发挥作用[9,10]。研究表明,lncRNA异常表达可能参与了胃癌的发生发展[11]。本研究结果显示,LINC01296在胃癌细胞SGC-7901、BGC-823中的表达均高于正常胃黏膜上皮细胞GES1,而沉默胃癌细胞SGC-7901、BGC-823的LINC01296表达后,其增殖能力下降;这表明LIN01296在胃癌细胞中表达升高,LINC01296具有促进胃癌细胞增殖的作用,其可能作为促癌因子参与了胃癌的发生。
为了研究LINC01296促进胃癌发生的作用机制,我们通过胞质胞核分离实验确定其在细胞中的定位;结果显示LINC01296主要表达于胃癌细胞核,表明其可以通过与转录因子结合调控特定靶基因的表达而发挥作用。表观抑制因子PcGs是表观遗传变化的重要调控因子,在物种间具有较好的保守性。PcGs主要包括PRC1和PRC2两种复合体,两种复合体由于结构不同而发挥不同作用。PRC1主要发挥泛素连接酶的作用,而PRC2发挥甲基转移酶的作用,可以催化组蛋白H3K27的甲基化修饰[12,13]。PRC2复合体尤其是其主要组成部分EZH2、SUZ12在多种肿瘤中表达异常。EZH2是PRC2复合体的核心组成部分,通过EZH2和DNA甲基转移酶(DNMTs)之间的相互作用,可将H3K27和CpG甲基化联系起来,导致DNA高甲基化,从而引起H3K27me3基因沉默[6,14,15]。EZH2不仅可以通过抑制基因转录而沉默基因表达,还可以促进肿瘤细胞增殖,参与调节干细胞的自我更新、胚胎发育和肿瘤发生等过程。EZH2和SUZ12在卵巢癌、前列腺癌、食管癌、神经胶质瘤等多种肿瘤组织中呈高表达,其在胃癌组织中的表达也高于癌旁正常胃上皮组织[16~18]。研究表明,lncRNA可通过参与调控EZH2通路而促进肿瘤发生。本研究RNA免疫共沉淀结果显示,LINC01296可以与EZH2和SUZ12结合;因此,LINC01296可能通过与EZH2和SUZ12的结合,调控下游特定靶基因表达,从而促进胃癌细胞的增殖。
综上所述,LINC01296可能通过与EZH2、SUZ12结合而促进胃癌细胞增殖,从而参与胃癌的发生发展。但LINC01296与EZH2和SUZ12结合后可以调控下游的哪些靶基因以及其调控的机制并不明确,未来需进一步探索和深入研究。

