基于CT图像的神经网络模型鉴别纯磨玻璃样微浸润性腺癌和浸润性腺癌
车思雨 蒋依宁 韩广庆 赵文静 李国生 李智勇
大连医科大学附属第一医院1放射科,2病理科(辽宁大连116011)
由国际多学科联合发布的肺腺癌分类已被越来越多的学者认可[1]。微浸润性腺癌(minimally invasive adenocarcinoma,MIA)是一种以贴壁生长方式为主,侵袭范围0.5 cm的孤立性小腺癌。浸润性腺癌(invasive adenocarcinoma,IAC)要求侵袭范围>0.5 cm即可。前者仅进行亚肺叶切除,术后5年无瘤生存率可达或接近100%[2],IAC患者宜行肺叶切除术[3],其5年无病生存率40%~85%不等[4-5]。因此,术前准确预测肺腺癌的病理亚型,制定合理的手术方案是非常重要的。
纯磨玻璃结节(pure ground-glass nodules,pGGN)通常具有良性或缓慢转化的趋势[6]。但近年来,越来越多文献的报道证实pGGNs为IAC[7-8]。定性或定量测量已用于区分不同病理类型[9-10],通过某种单纯的影像特征对pGGNs的评估仍具有一定的困难。神经网络模型现逐步用于医疗领域并拥有较好的前景,已有文献证实了该模型可以预测GGN为IAC的可行性[11]。因此,本研究目的是利用薄层CT影像特征并建立神经网络模型鉴别呈现pGGN的MIA和IAC。
1 资料与方法
1.1 一般资料回顾性收入2015年1月至2018年1月期间于大连医科大学附属第一医院薄层CT上呈现为pGGN,经手术病理证实为单发MIA 151例、IAC 127例。纳入标准:(1)所有患者术前2周内均行肺部薄层CT扫描,并可在图像存档和通讯系统中进行评价;(2)病灶在肺窗上均为pGGN(窗宽-600 Hu,窗位1 200 Hu),纵隔窗不能显示实性成分(窗宽40 Hu,窗位400 Hu)[9];(3)所有患者术后均为单发MIA或IAC;(4)术前无放化疗者。
1.2 检查方法所有患者均行16排以上螺旋CT机平扫和薄层扫描(包括GE和Siemens)。患者为仰卧位,扫描范围从肺尖到肺底。扫描条件:管电压120 kV,管电流170~200 mAs,层厚5.0 mm,层间距5.0 mm,矩阵512 × 512,薄层CT采用骨算法重建,层厚1.0~1.5 mm,层间距1.0~1.5 mm。
1.3 图像分析薄层CT扫描的原始图像数据被传输到ITK-Snap软件[Version 3.6.0,University of Pennsylvania][12]。
1.3.1 pGGNs 的影像形态学特征pGGNs的影像形态学特征包括:形状(包括类圆形和不规则形);分叶征(定义为pGGN的轮廓呈多个弧形凸起,弧形相间为凹入的切迹,形成分叶状);空气支气管征(定义为pGGN内部含气的支气管分支影);胸膜凹陷征(定义为胸膜下病灶牵拉胸膜时出现的线形、幕状或喇叭样阴影);空泡征(定义为病灶内1 ~3 mm的圆形透亮区)。
1.3.2 pGGNs 的影像定量指标(1)最大层面平均CT值(CT-LP)定义为肺窗轴位pGGN面积最大层面的平均CT值。(2)整体平均CT值(CT-W)为病灶所有横位平面的平均CT值。(3)直径,以病灶最大横断面上的最大径。(4)体积。(5)质量,用平均结节密度乘以结节体积计算:
质量(g)=体积(cm3)×(CT-W(Hu)+1000)/1000[13]。
采用不规则曲线形式对pGGNs的轴位层面进行感兴趣区(region of interest,ROI)勾画,ROI应该包括单一层面内pGGN病灶整体的90%以上。当病变水平有亚段支气管血管束和空泡成分时,我们避免其测量。然后自动计算体积和衰减值。
1.4 病理分析所有病例术后均获得石蜡包埋标本,切片厚度4 mm,包括肿瘤最大切面,组织切片使用苏木精-伊红染色。所有切面均由2位病理学教授进行研究。当有争议时,通过协商一致的方式解决。所有病例按2015年WHO肺腺癌分类标准进行诊断和分类,病理诊断类型包括:MIA和IAC[14]。
1.5 统计学方法使用SPSS 24.0统计软件(SPSS Inc,Chicago,IL,USA)进行分析。在所有变量中,正态分布采用均值±标准差,非正态分布采用中位数。比较MIA组和IAC组的临床和影像学特征上的差异性。计数数据采用卡方检验,符合正态分布的测量数据采用student t检验,非正态分布采用Mann-Whitney U检验。P <0.05有统计学意义。以单变量分析中P <0.05的变量作为输入变量及因子建立神经网络模型。通过MedCalc v19.0.2软件分析受试者操作特征曲线(Subject operating characteristic,ROC)、计算并比较受试者工作特征曲线下面积(Area under the curve,AUC)评估IAC的预测价值。
2 结果
2.1 pGGNs 的基本临床资料与分析本研究纳入278例单发pGGN患者,其中MIA组151例、IAC组127例。在MIA组中患者年龄(56.64岁)低于IAC组(60.96岁)(P <0.001)。性别、吸烟史及病灶位置在这两组中均没有统计学差异。见表1。
2.2 MIA 组与IAC 组影像学特征分析MIA组中病灶呈类圆形多于IAC组(P <0.001)。MIA组中病灶的影像形态征象(分叶征、血管集束征、空气支气管征、空泡征和胸膜凹陷征)均少于IAC组(均P <0.001)。定量分析中,MIA组的mCT-LP和mCT-W低于IAC组;MIA组在直径、体积和质量均显着低于IAC组。见表2和图1-2。

图1 IAC 患者影像学特征Fig.1 Imaging characteristic of patients with IAC

图2 MIA 患者影像学特征Fig.2 Imaging characteristic of patients with MIA

表1 MIA 组与IAC 组的临床资料Tab.1 Clinical characteristics between MIA group and IAC group 例(%)
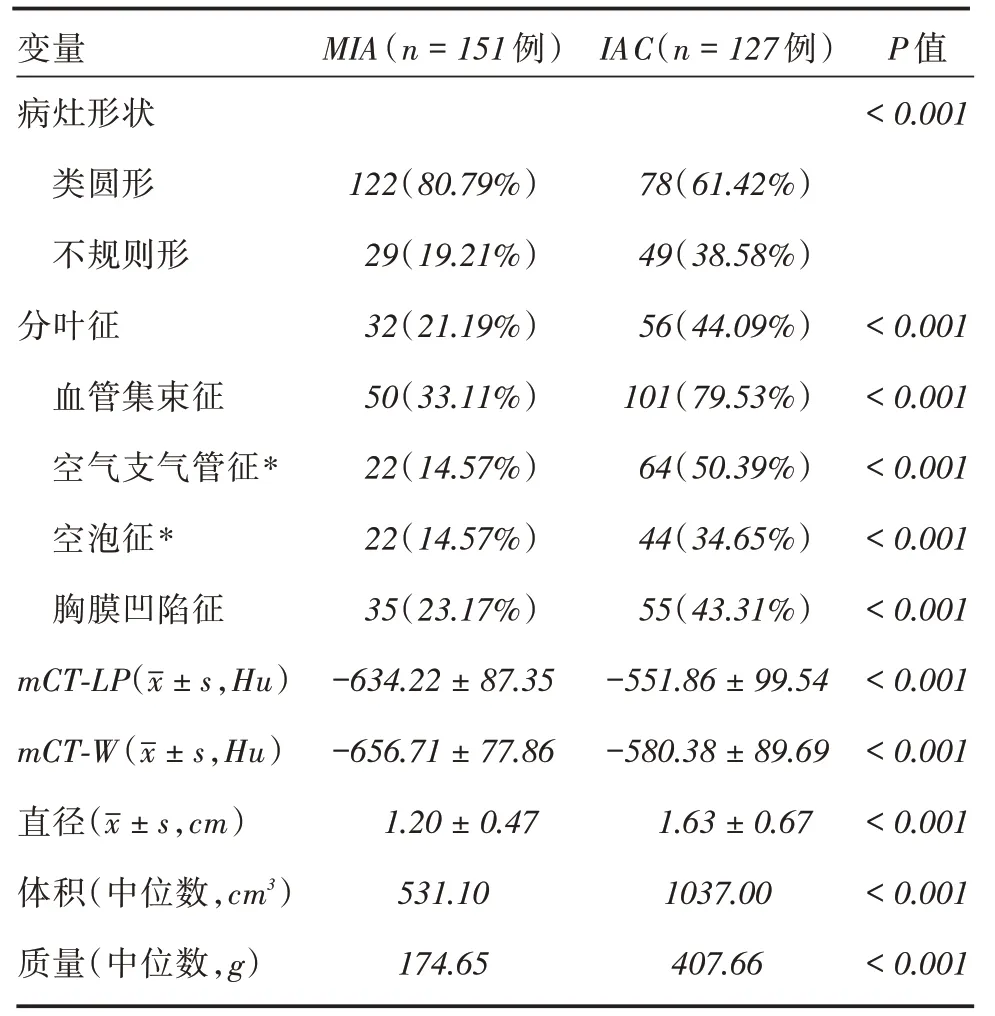
表2 MIA 组与IAC 组之间影像学特征的差异性比较Tab.2 Comparison of imaging characteristics between MIA group and IAC group
2.3 建立神经网络模型与预测效能分析在278例pGGNs中,mCT-LP、mCT-W、病灶直径、体积和质量判定IAC的AUC分别为0.74、0.74、0.71、0.71和0.77(表3、图3)。将单变量分析中P <0.05的变量作为输入变量和因子建立神经网络模型(图3)。通过AUC、总体预测准确率、敏感度和特异度来评估神经网络模型的诊断效能,其结果分别为0.91、81.00%、78.81%和86.61%,见表4。
比较神经网络模型与余定量参数(mCT-LP、mCT-W、病灶直径、体积和质量)的ROC曲线显示:前者明显优于后者的预测结果(均P 0.001),见图4。
3 讨论
2015年,WHO[14]以生长方式作为临床病理类型提出一个新的分类系统,明确了肺腺癌的不同病理类型之间异质性的不同,手术治疗方案和患者预后也不尽相同,因此,本研究回顾性分析术前未经治疗的278例单发pGGN,探索利用薄层CT影像学特征鉴别MIA与IAC,并建立神经网络模型提高其诊断效能。

图3 神经网络(多层感知器)拓扑结构图,模型包括1 个输入层、1 个隐藏层和1 个输出层Fig.3 Neural network diagram.The model includes an input layer,a hidden layer,and an output layer

表4 神经网络模型在验证组中的诊断效能Tab.4 Diagnostic efficiency of neural network model in validation group

图4 预测pGGN 为IAC 的ROC 曲线分析Fig.4 ROC Curve Analysis predicting pGGN as IAC
在本研究中,MIA组患者平均年龄(56.64岁)低于IAC组(60.96岁)(P <0.001)。这与WANG等[15]在对154例3 cm的亚实性肺结节的研究中发现MIA的发病年龄(55.46岁)小于IAC(60.07岁)相一致(P <0.05)。性别、吸烟史及病灶位置没有统计学差异。
pGGN的形状和边缘是由不同的细胞增长速度以及基质反应联合两者同时决定的,大多数MIA呈椭圆形(86.70%)[10]。在本研究中MIA组的病灶呈类圆形多于IAC组,与其结果相似[7,16-17]。同时,本研究pGGNs的其他影像形态学特征(分叶征、血管集束征、空气支气管征、空泡征和胸膜凹陷征)在两组之间有统计学差异性,这与以往文献结果相仿。同级支气管总是与肺动脉伴行,当pGGNs中出现血管集束征和空气支气管征时,该病灶可能具有较多的血液和氧气供应,可能反应肿瘤细胞的加速生长及浸润进展[18]。病理学上,空泡征是指小气道阻塞性扩张,多个破裂的肺泡融合腔及肺组织未被肿瘤组织所占据。胸膜凹陷征是由于病理改变内部的间质纤维组织收缩所导致,当然与病变位置也有一定的联系。
病灶的大小和CT值对pGGNs的诊断与鉴别有着十分重要的意义。通常认为pGGN越大,提示恶性等级越高。本研究中,MIA组在直径、体积和质量均显着低于IAC组。ERIGUCHI等[19]利用定量CT直方图和FDG-PET分析225例c-0/I期肺腺癌发现IAC组的肿瘤直径、体积均高于浸润前病变组。MENG等[20]分析145例GGNs亦得出IAC组的肿瘤显着大于MIA组(12.84 vs.9.05 cm,P <0.05)。病灶CT值可以反映沿肺泡间隔生长的更多肿瘤细胞,与肿瘤中保留的空气间隙之间有强烈负相关[21],随着浸润成分不断蔓延增长,CT衰减值也不断增加。邱太春等[22]在研究253例pGGNs中,浸润前病变的CT值(-622 Hu)低于IAC(-549 Hu)(P = 0.020),与我们结果相似。本研究中MIA组的mCT-LP和mCT-W均低于IAC组(-634.22 vs.-551.86,-656.71 vs.-580.38,均P <0.001)。
值得注意的是,某单一的CT特征对预测pGGN的浸润程度的价值有限。本研究中,mCT-LP、mCT-W、病灶直径、体积和质量预测IAC的AUC分别为0.74、0.74、0.71、0.71和0.77。最新的报道中,李凤等[23]通过CT特征分析90例表现为pGGNs的MIA和IAC中,病灶直径的最佳阈值为1.38 cm,AUC为0.76,与本研究结果相似。CHU等[24]分析172 pGGNs,病灶直径、面积和CT值预测IAC的AUC分别为0.84、0.81和0.72,略高于本研究,其原因可能为纳入了73例癌前病变导致两组差异较大。
神经网络的本质是通过参数和激活函数来拟合特征与目标之间的真实函数关系。神经网络模型含有三层结构:输入层、输出层和隐藏层,其中隐藏层(即神经元)的连接权值反映了模型的连接强度。训练学习算法可以在迭代过程中不断调整这些权值,从而尽可能减小预测误差。GONG[11]和WANG等[25]利用神经网络模型分别分析828例和1 545例GGNs,判 断IAC和 非IAC的AUC分 别 为0.92和0.89。本研究中,神经网络模型预测IAC的AUC为0.91,进而比较ROC曲线显示神经网络模型明显优于各项定量指标的预测结果(均P 0.001),其敏感度和特异度分别为78.81%和86.61%。因此,利用神经网络模型可以提高鉴别呈现pGGN的MIA和IAC的能力。
局限性:(1)这是一项回顾性研究,根据严格的纳入标准,患者数量相对较少,部分病例因其他医院未获得HRCT图像而被排除在外。(2)本研究仅为单中心研究,数据可能存在偏倚。

