lncRNA ZNF571-AS1对前列腺癌细胞增殖及侵袭能力的影响
杨凌博 杨金辉 鲁帅奇 李小辉 卢绩
1郑州大学附属洛阳中心医院泌尿外科(河南洛阳471009);2吉林大学附属第一医院泌尿外科(长春130021)
前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤之一,前列腺癌的发病率逐年增加,严重威胁男性健康[1]。早期前列腺癌的治疗方式是根治性手术,治疗效果较好[2]。但由于早期前列腺癌多无明显症状,导致多数患者发现时已是中晚期前列腺癌[3]。探究前列腺癌发生、发展的分子机制,可能对前列腺癌的早期诊断和分子靶向治疗具有重要临床意义。长链非编码RNA(long non-coding RNA,lncRNA)存在于真核细胞,长度大于200个核苷酸,不能编码蛋白质[4]。在人类几乎所有恶性肿瘤中存在lncRNA的异常表达,其表达水平与肿瘤细胞的各种生物学行为相关[5]。前列腺癌中存在lncRNA的异常表达,通过检测前列腺癌组织或患者血清lncRNA的表达可能有助于前列腺癌的早期诊断[6]。ZNF571-AS1是近年来新发现的lncRNA,可能参与急性髓细胞性白血病的发生、发展[7]。ZNF571-AS1在前列腺癌组织中的表达和分子机制尚不清楚。本研究拟分析ZNF571-AS1在前列腺癌组织和细胞系中的表达,观察ZNF571-AS1对前列腺癌细胞增殖和侵袭的影响,探讨其可能的分子机制。
1 材料和方法
1.1 材料
1.1.1 临床标本52例前列腺癌组织及癌旁组织均取自2018年3月至2019年5月郑州大学附属洛阳中心医院泌尿外科住院患者。所有组织标本均经两名以上病理学专家确诊,所有患者术前均未接受过放疗和化疗。患者年龄平均(59.43±14.63)岁。Gleason评分:<7分27例,7分25例。临床分期:Ⅰ和Ⅱ期33例,Ⅲ和Ⅳ期19例。本研究经本院医学伦理委员会批准,患者均签署知情同意书。
1.1.2 细胞与试剂正常前列腺上皮细胞(RWPE-1)和前列腺癌细胞系(DU-145、C4-2B、LNCaP、PC-3)购于中国典型培养物保藏中心。qPCR试剂盒购于南京建成生物工程研究所。沉默ZNF571-AS1基因的质粒和阴性对照质粒购于上海吉玛基因股份有限公司。Matrigel基质胶、一抗和二抗购于美国BD公司。培养基和胎牛血清购于美国Hyclone公司。转染试剂LipofectamineTM 3000购于美国Invitrogen公司。Transwell小室购于美国Corning公司。噻唑蓝(methyl thiazol tetrazolium,MTT)试剂盒购于南京凯基生物科技发展有限公司。
1.2 方法
1.2.1 细胞培养和转染前列腺癌细胞系用含10%胎牛血清的RPMI-1640培养基培养,正常前列腺上皮细胞用含10%胎牛血清的KSFM培养基培养。将对数生长期的DU-145细胞采用LipofectamineTM 3000试剂转染沉默ZNF571-AS1基因的质粒和阴性对照质粒,命名为实验组和对照组,转染操作按照说明书进行。
1.2.2 qPCR 检测ZNF571-AS1、miR-301b-3p 和AR mRNA 的表达TRIzol法提取组织及细胞总RNA,进一步逆转录为cDNA。建立qPCR反应体系,以GAPDH作为内参,检测ZNF571-AS1和AR mRNA的表达;以U6作为内参,检测miR-301b-3p的表达。引物序列如下,ZNF571-AS1正向引物:GGTCTCGGTACATGCGTGGA,反向引物:TGGCAGTATAACAGGCTCCC;miR-301b-3p正 向 引 物:GGGCTTTGACAATATCATTG,反向引物:CAGTGCGTGTCGTGGAGT;GAPDH正向引物:CTGGGCTACACTGAGCACC,反向引物:AAGTGGTCGTTGAGGGCAATG;AR正向引物:CCAGGGACCATGTTTTGCC,反向引物:CGAAGACGACAAGATGGACAA。U6正向引物:CTCGCTTCGGCAGCACA,反向引物:AACGCTTCACGAATTTGCGT。应用2-ΔΔCt方法计算相对表达量。
1.2.3 MTT 法检测DU-145 细胞的增殖能力收集两组细胞,分别以3 × 103个/孔接种于96孔板。检测时每孔加入20 μL MTT试剂,继续培养4 h。加150 μL/孔二甲基亚砜,振荡10 min,酶标仪测定每孔450 nm波长处的光密度(OD)值,分别检测第1、2、3、4、5天细胞的增殖活性。
1.2.4 小室(Transwell)实验检测DU-145 细胞的侵袭能力采用培养基稀释Matrigel基质胶,按50 μL每孔包被小室底膜上室。收集两组细胞,分别以3 × 104个/孔接种于上室,下室加入600 μL含胎牛血清的RPMI-1640培养基。培养箱内培养24 h后,棉签擦去未侵袭的细胞,采用多聚甲醛固定,采用0.1%结晶紫染液染色,PBS溶液冲洗。在100倍显微镜下每孔随机取4个视野,计数并拍照。
1.2.5 生物信息学技术预测ZNF571-AS1 的分子机制采用生物信息学网站starBase v2.0预测ZNF571-AS1可互补结合的miRNA。采用生物信息学网站RNAhybrid预测miR-301b-3p可互补结合的靶基因mRNA。
1.2.6 Western blot法检测AR蛋白和PI3K/Akt信号通路蛋白的表达收集两组细胞并提取细胞蛋白,测定蛋白浓度。采用10%十二烷基硫酸钠聚丙烯酰胺凝胶垂直电泳分离蛋白,转膜后应用5%脱脂牛奶封闭。采用一抗孵育,在4 ℃下过夜。洗膜后,采用二抗在室温下孵育。洗膜后,采用ECL法发光、显影。
1.2.7 统计学方法所有数据均采用SPSS 19.0软件统计分析,计量资料以均数±标准差表示,组间均数比较采用方差分析及t检验,以P <0.05为差异有统计学意义。
2 结果
2.1 前列腺癌组织和癌旁组织中ZNF571-AS1 的表达前列腺癌组织和癌旁组织中ZNF571-AS1的表达分别为(5.71 ± 0.61)和(0.69 ± 0.18),前列腺癌组织中ZNF571-AS1表达显著高于癌旁组织(P <0.01),见图1。

图1 前列腺癌组织和癌旁组织中ZNF571-AS1 的表达Fig.1 ZNF571-AS1 expression in prostate cancer tissues and adjacent tissues
2.2 前列腺癌细胞和正常前列腺上皮细胞中ZNF571-AS1的表达与正常前列腺上皮细胞相比,前列腺癌细胞系中ZNF571-AS1的表达显著较高(P <0.05),DU-145细胞中ZNF571-AS1的表达最高(P <0.01),因而选择DU-145细胞进行研究。见图2。

图2 前列腺癌细胞和正常前列腺上皮细胞中ZNF571-AS1 的表达Fig.2 ZNF571-AS1 expression in prostate cancer cells and normal prostate epithelial cells
2.3 两组DU-145 细胞中ZNF571-AS1 的表达qPCR结果显示,实验组和对照组DU-145细胞中ZNF571-AS1表达分别为(0.17 ± 0.04)和(1.01 ±0.06),实验组显著低于对照组(P <0.01),提示转染成功。
2.4 低表达ZNF571-AS1抑制DU-145细胞的增殖能力MTT法结果显示,从 第2天起,实验组DU-145细胞增殖能力显著低于对照组(P <0.05)。见图3。

图3 MTT 检测ZNF571-AS1 对DU-145 细胞增殖能力的影响Fig.3 MTT was used to detect the effect of ZNF571-AS1 on the proliferation ability of DU-145 cells
2.5 低表达ZNF571-AS1 抑制DU-145 细胞的侵袭能力小室(Transwell)实验显示,实验组和对照组DU-145细胞侵袭细胞数分别为(33.37±5.33)个和(87.55±6.72)个,与对照组相比,低表达ZNF571-AS1后显著抑制DU-145细胞的侵袭能力(P <0.01),见图4。
2.6 生物信息学技术预测ZNF571-AS1 的分子机制采用生物信息学网站starBase v2.0预测ZNF571-AS1可互补结合miR-301b-3p。采用生物信息学网站RNAhybrid预测miR-301b-3p可互补结合AR mRNA。见图5。
2.7 低表达ZNF571-AS1 的前列腺癌细胞中miR-301b-3p 和AR mRNA 的表达qPCR结果显示,实验组和对照组DU-145细胞miR-301b-3p的表达分别为(5.28±0.49)和(1.08±0.40),低表达ZNF571-AS1可促进miR-301b-3p的表达(P <0.01)。实验组和对照组DU-145细胞AR mRNA的表达分别为(0.38 ± 0.05)和(1.01 ± 0.06),提示miR-301b-3p表达增加后,AR mRNA表达降低(P <0.01)。
2.8 低表达ZNF571-AS1促进AR蛋白表达Western blot结果显示低表达ZNF571-AS1引起AR蛋白表达升高,AR蛋白表达升高后,造成PI3K/Akt信号通路蛋白如p-PI3K、p-Akt及p-GSK3β蛋白表达降低,PI3K/Akt信号通路转导被抑制。见图6。
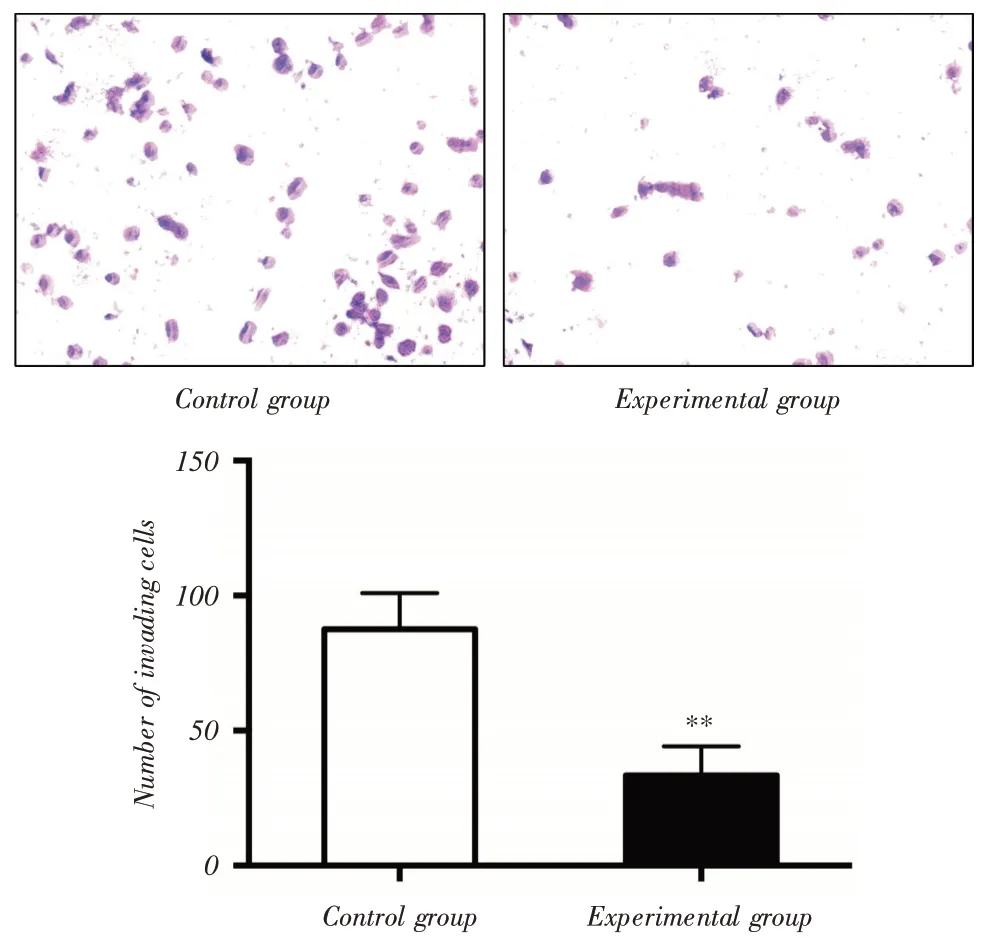
图4 小室(Transwell)实验检测ZNF571-AS1 对DU-145 细胞侵袭能力的影响Fig.4 Transwell invasion test was used to detect the effect of ZNF571-AS1 on the invasion ability of DU-145 cells

图5 生物信息学技术预测ZNF571-AS1 的分子机制Fig.5 Bioinformatics technology predicted the molecular mechanism of ZNF571-AS1
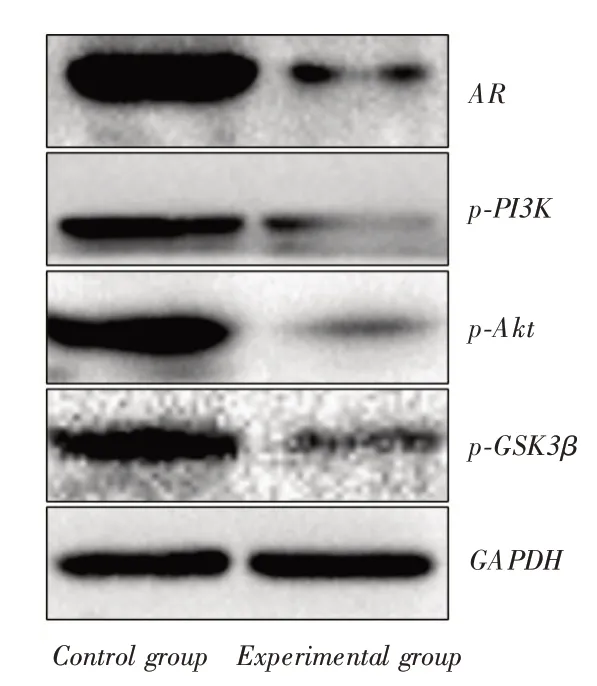
图6 Western blot 法检测AR 蛋白及PI3K/Akt 信号通路蛋白表达情况Fig.6 Western blot method was used to detect the expression of AR protein and PI3K/Akt signaling pathway proteins
3 讨论
lncRNA是一类内源性非编码RNA,缺乏开放阅读框[8]。lncRNA可调控基因的转录和翻译,参与包括前列腺癌在内的各种肿瘤的发生、发展[9]。越 来 越 多 的lncRNA如MNX1-AS1[10]、GAS5[11]、PCAT1[12]、CCAT1[13]、LINC01638[14]等被发现在前列腺癌中异常表达,影响前列腺癌细胞的生物学行为。ZNF571-AS1是近年来新发现的长链非编码RNA,有研究[7]表明,ZNF571-AS1可能发挥癌基因作用,促进急性髓细胞性白血病的发生、发展。ZNF571-AS1在前列腺癌中的表达和功能尚不明确。本研究中,ZNF571-AS1在前列腺癌组织和细胞系中均呈高表达,表明其可能在前列腺癌细胞中发挥癌基因作用。MTT实验和小室实验显示,下调ZNF571-AS1可抑制前列腺癌细胞的增殖和侵袭能力,进一步证明ZNF571-AS1在前列腺癌细胞中发挥肿瘤促进作用。
lncRNA携带有特定miRNA的“种子序列”,可吸附结合miRNA,阻止miRNA与其靶基因mRNA结合,从而抑制miRNA对靶基因表达的干扰作用[15]。本研究采用starBase v2.0网站预测,ZNF571-AS1可互补结合miR-301b-3p。miR-301b-3p可能在肝癌组织和细胞系中表达降低,上调miR-301b-3p具有抑制肝癌细胞增殖、迁移和侵袭的作用[16]。本研究发现,下调ZNF571-AS1后,前列腺癌细胞中miR-301b-3p表达增加,提示ZNF571-AS1可能通过吸附结合miR-301b-3p。miRNA主要通过结合靶基因mRNA区域,抑制其翻译或者直接导致其降解,从而抑制靶基因的表达[17]。本研究采用RNAhybrid网站预测,miR-301b-3p可互补结合雄激素受体(Androgen receptor,AR)mRNA。AR属于类固醇激素受体家族,定位于Xq11-12[18-19]。AR在前列腺癌组织和细胞系中表达明显增加,与前列腺癌的发生、发展显著相关[20]。下调AR表达可明显抑制前列腺癌细胞的生长和转移[21]。本研究发现,miR-301b-3p表达增加后,前列腺癌细胞中AR基因表达下调,提示miR-301b-3p可能具有抑制AR基因表达的作用。有研究[22]表明,AR通过促进PI3K/Akt信号通路转导,促进细胞的生长和转移。本研究证明,AR基因表达降低后,PI3K/Akt信号转导通路蛋白如p-PI3K、p-Akt及p-GSK3β表达明显降低,表明PI3K/Akt信号通路转导被干扰。本研究下一步将通过双荧光素酶报告基因实验验证ZNF571-AS1与miR-301b-3p及miR-301b-3p与AR mRNA之间的结合。
综上所述,lncRNA ZNF571-AS1在前列腺癌组织和细胞系中高表达,下调ZNF571-AS1可能通过调控miR-301b-3p/AR信号通路抑制前列腺癌细胞的增殖和侵袭能力。因此,ZNF571-AS1在前列腺癌分子靶向治疗中具有一定的研究价值。

