miR-365通过调控ATG3对HCC细胞自噬的作用机制
王丽红 吴慧丽 张利 李宾 刘迎
郑州大学附属郑州中心医院1消化内科,2门诊综合诊疗中心(郑州450000)
肝细胞性肝癌(hepatocellular carcinoma,HCC)是临床上最为常见的恶性肿瘤之一,具有较高发病率和致死率,严重威胁人类生命健康。临床上治疗肝癌常见的方式有手术切除、放射治疗、免疫治疗等,但HCC患者预后仍不理想[1]。自噬是细胞自我消化过程,可将细胞质内衰老或受损细胞器及一些大分子物质包裹在囊泡,形成自噬泡,与溶酶体融合,降解为小分子物质,对维持细胞内环境稳态至关重要[2]。自噬过程在细胞内受严格调控,不仅是细胞正常生理状态下的生存机制,同时与肿瘤发生发展密切相关[3]。在HCC发展过程中,自噬具有双重作用,HCC发展初期,自噬可抑制肿瘤细胞生长,在发展阶段,自噬可为肿瘤细胞提供营养促进肿瘤细胞增殖[4]。微小RNA(microRNA,miRNA)参与基因表达与调控,与自噬过程密切相关,其通过对自噬水平的调控,影响肿瘤结局。miR-365是miRNA家族一员,在肝癌细胞中表达下调,但关于miR-365与HCC细胞自噬关系报道较少[5]。本研究通过探讨miR-365在HCC中对自噬的作用及可能机制,旨在为治疗HCC提供新的靶点和方向。
1 材料与方法
1.1 材料
1.1.1 临床资料选取本院收治确诊为HCC患者13例,其中男性8例,女性5例,年龄26 ~61岁,平均年龄(41.37 ± 5.16)岁,收集患者术后HCC组织与癌旁组织,保存于液氮中。纳入标准:年龄18岁;符合临床HCC诊断标准,患者均接受根治术,术后经病理验证为HCC。排除标准:无影像学资料及合并其他恶性肿瘤患者。
1.1.2 细胞系和试剂人肝癌SMMC-7721细胞、肝癌HepG2细胞,人正常肝细胞L02购于中国科学院上海细胞库。DMEM培养基、胎牛血清(fetal bovine serum,FBS)(美国Gibco公司),含有miR-365激动剂(miR-365-mimics)、无义随机序列(miR-365-NC)的pcDNA3.1重组质粒(上海吉玛制药技术有限公司),兔抗人自噬相关基因3(autophagy related gene 3,ATG3)多抗、自噬微管相关蛋白轻链3-II(microtubule-associated protein1 light chain3-II,LC3-II)多抗、p62单抗、Beclin1单抗(美国Abcam公司),HRP标记的山羊抗兔二抗(北京中杉金桥生物技术有限公司),双荧光素酶报告基因检测试剂盒(美国Promega公司)。
1.2 方法
1.2.1 细胞培养、转染及分组取人肝癌SMMC-7721细胞、肝癌HepG2细胞,人正常肝细胞L02,放入含有10%FBS+100 U/mL青霉素+100 μg/mL链霉素的DMEM培养基中,于体积分数5%CO2、37 ℃条件下恒温培养。2 ~3 d传代一次,取对数生长期SMMC-7721细胞,按1×105个/mL接种于6孔板,随机分为对照组、NC组(转染miR-365无序对照序列miR-365-NC)过表达组(转染miR-365-mimics)。继续培养48 h,荧光显微镜下观察转染效率均>85%,可用于后续实验。
1.2.2 RT-qPCR 检测组织与细胞中miR-365、ATG3 mRNA 表达水平取患者HCC组织与癌旁组织,转染与未转染SMMC-7721细胞,HepG2肝癌细胞,人正常肝细胞L02,Trizol法提取总RNA,测定总RNA浓度和纯度,逆转录cDNA,进行RT-qPCR。反应体系:上下游引物各1 μL,cDNA 2 μL,SYBR Green PCR Master Mix 10 μL,加ddH2O至总体积25 μL。反应条件:95 ℃预变性10 min,95 ℃变性10 s,55 ℃退火10 s,70 ℃延伸30 s,45个循环。miR-365以U6为内参,ATG3以β-actin为内参,采用2-CT法计算目的基因的相对表达水平。引物由上海生工合成,引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.2.3 MTT 法检测细胞增殖情况各组细胞,按2 × 105个/mL接种于96孔板,培养48 h后,20 μL/孔加入MTT溶液(5 mg/mL),继续孵育4 h,150 μL/孔加入DMSO,震荡10 min,用酶标仪在450 nm处检测吸光度(A)值。
1.2.4 流式细胞术检测细胞凋亡情况各组细胞按1 × 106个/mL接种于6孔板,培养48 h,胰酶消化,1 500 r/min离心5 min,弃上清,加入200 μL Binding Buffer重悬细胞,加入5 μL Annexin V-FITC和5 μL PI染色液,混匀,室温避光孵育20 min,上流式细胞仪检测凋亡情况。
1.2.5 电镜观察细胞自噬情况取各组细胞按1×106个/mL接种于6孔板,培养48 h后胰酶消化收集细胞,1 200 r/min离心10 min,弃上清,加入4%戊二醛,4 ℃固定24 h,1%四氧化锇4 ℃固定1 h,梯度乙醇和丙醇脱水,环氧树脂包埋,切片(片厚约100 μm),醋酸铀和枸橼酸铅定位染色后封片,电镜观察。
1.2.6 Western blot 法检测细胞中ATG3、LC3-II、Beclin1、p62蛋白相对表达水平取各组细胞,加入细胞裂解液,提取总蛋白,BCA法定量,蛋白变性,上样进行SDS-PAGE电泳,转至PVDF膜,5%脱脂奶粉室温封闭2 h,TBST洗膜,加入1∶2 000稀释的ATG3、LC3-II、Beclin1、p62一抗4 ℃孵育过夜,TBST洗膜,加入二抗37 ℃孵育2 h,加入ECL曝光显影,以β-actin为内参,采用Image J软件进行灰度分析,计算目的蛋白相对表达水平。
1.2.7 双荧光素酶报告基因系统检测miR-365 与ATG3靶向性根据生物信息学软件分析预测miR-365与ATG3之间的结合位点,将ATG3-3′UTR插入荧光素酶报告载体pMIR-REPORT,分别构建野生型重组质粒pMIR-ATG3-MT和突变型重组质粒pMIR-ATG3-MUT,利用LipofectamineTM 2000转染试剂将miR-365-mimcs-NC/miR-365-mimcs与野生组和突变组质粒共转染SMMC-7721细胞,48 h后,检测荧光素酶活性。
1.3 统计学方法采用SPSS 25.0统计软件分析数据,计量资料以均数±标准差表示,多样本计量资料比较采用单因素方差分析,两两样本比较采用LSD-t检验。P <0.05为差异有统计学意义。
2 结果
2.1 HCC 患者组织与不同肝细胞系中miR-365 和ATG3 mRNA 表达情况HCC患者癌组织中miR-365、ATG3表达明显低于癌旁组织(P <0.05),见图1。肝癌SMMC-7721细胞、HepG2细胞中miR-365和ATG3表达均低于正常L02细胞(P <0.05),且SMMC-7721细胞较HepG2细胞更低(P <0.05),见图2。后续实验选择SMMC-7721细胞。
2.2 SMMC-7721 细胞转染后miR-365 和ATG3 mRNA 表达情况过表达组miR-365、ATG3相对表达量明显高于对照组、NC组(P <0.05),见图3。
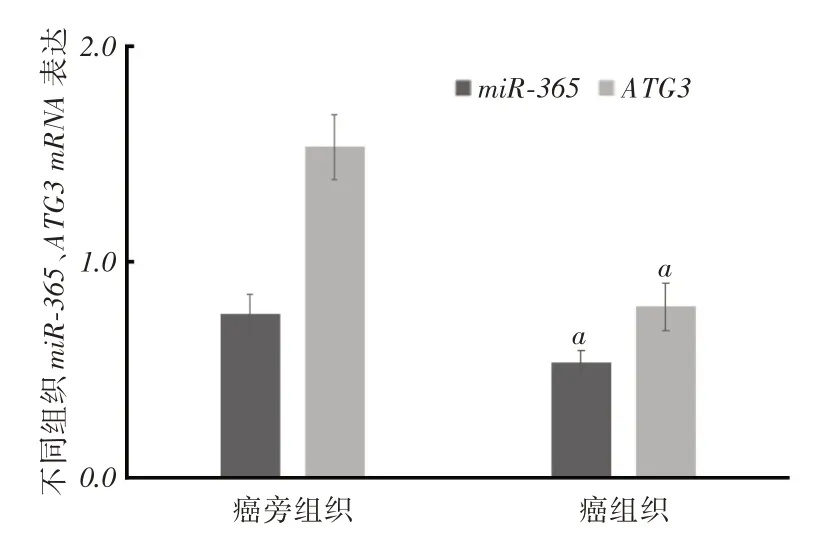
图1 HCC 患者不同组织miR-365、ATG3 表达情况Fig.1 The expression of miR-365 and ATG3 in different tissues of HCC patients

图2 不同细胞系中miR-365、ATG3 表达情况Fig.2 The expression of miR-365 and ATG3 in different cell line
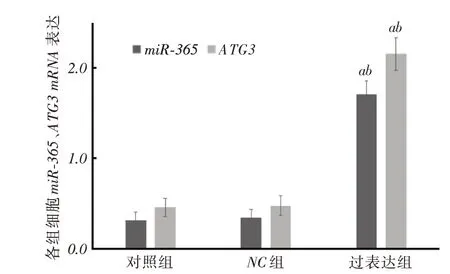
图3 各组细胞miR-365、ATG3 相对表达量比较Fig.3 Comparison of relative expression levels of miR-365 and ATG3 in each group of cells
2.3 细胞增殖情况过表达组细胞A值明显低于对照组、NC组(P <0.05)。见图4。
2.4 细胞凋亡情况过表达组细胞凋亡率明显高于对照组、NC组(P <0.05),见图5。

图4 各组细胞A 值比较Fig.4 Comparison of cell A values in each group
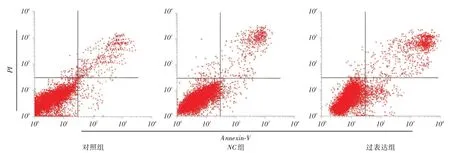
图5 各组细胞凋亡率比较Fig.5 Comparison of cell apoptosis rate in each group
2.5 透射电镜观察结果透射电镜观察显示,对照组、NC组内质网、溶酶体等细胞器结构正常;过表达组出现大小不一、包裹细胞器的圆形自噬泡(箭头指示),见图6。
2.6 细胞中ATG3、LC3-II、p62、Beclin1 蛋白相对表达量过表达组细胞中ATG3、LC3-II、Beclin1蛋白相对表达量明显高于对照组、NC组,p62蛋白相对表达量明显低于对照组、NC组(P <0.05),见图7。
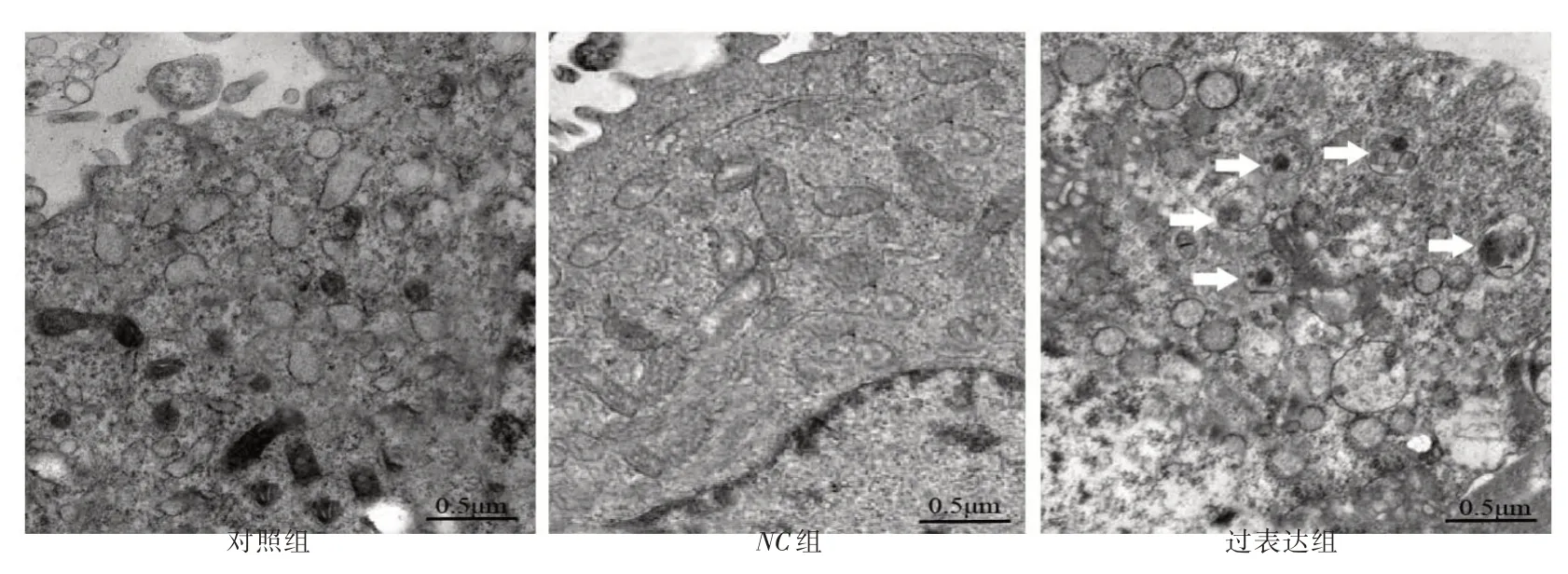
图6 透射电镜观察自噬(×25 000)Fig.6 Observation of autophagy under transmission electron microscope(×25 000)
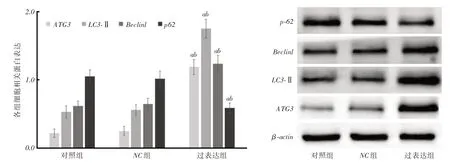
图7 细胞中ATG3、LC3-II、p62、Beclin1 蛋白表达Fig.7 Protein expression of ATG3,LC3-II,p62,Beclin1 in cells
2.7 双荧光素酶报告基因系统检测miR-365 与ATG3 靶向性生物学信息软件显示,ATG3存在miR-365结合位点,见图8A;进一步荧光素酶实验显示,转染miR-365 mimics可明显抑制野生型ATG3相对荧光素酶活性(P <0.05),而对突变型ATG3无明显影响(P >0.05),见图8B。

图8 miR-365 靶向调节ATG3 表达(A:miR-365 与ATG3 存在连续结合位点;B:miR-365 靶向抑制ATG3)Fig.8 miR-365 targeted regulation of ATG3 expression(A:miR-365 and ATG3 have continuous binding sites;B:miR-365 targeted inhibition of ATG3)
3 讨论
自噬与肿瘤发生发展过程关系密切,通过探讨肿瘤细胞自噬的分子机制,对治疗肿瘤具有重要意义[6]。自噬通过降解细胞组分,为细胞提供营养物质,维持细胞正常代谢,并可防止化疗药物诱导的细胞凋亡,保护细胞免受药物作用,促进细胞耐药;另一方面,自噬也可导致细胞死亡,通过诱导自噬促进细胞凋亡,发挥抑癌作用,在治疗癌症中具有潜在效应[7]。miRNA参与调控基因表达,通过调节自噬过程中关键蛋白的表达,对肿瘤细胞的增殖、凋亡、侵袭和转移过程表现出直接或间接调控作用,从而发挥抑癌或促癌作用,为肿瘤的治疗提供新靶点和新思路[8]。
miRNA在肿瘤组织中通过上调或下调下游相关基因,对肿瘤的结局和预后产生不同影响[9]。不同肿瘤组织中miR-365表达存在差异,其在皮肤鳞状细胞癌中表达上调,在肺癌、口腔鳞状细胞癌细胞中低表达[10-12]。HE等[13]报道显示,miR-365在HCC癌组织表达明显低于癌旁组织,miR-365下调可通过多种途径促进HCC进展和转移。本研究通过检测HCC患者癌组织与癌旁组织中miR-365表达,结果显示癌组织中miR-365表达显著低于癌旁组织,与以上结果一致。为进一步证实miR-365在HCC中的表达,本研究对不同HCC细胞系及正常肝细胞系中miR-365表达情况进行检测,结果显示,HCC细胞系中miR-365表达明显低于正常肝细胞,进一步验证miR-365在HCC中低表达。为揭示miR-365在HCC中作用机制,本研究采用miR-365转染SMMC-7721细胞,结果显示,miR-365过表达后,细胞增殖能力降低,凋亡率升高,与JIANG等[14]研究结果一致,提示过表达miR-365可抑制HCC细胞增殖促进其凋亡。
过表达miR-365可诱导HCC细胞凋亡,阻止原发性肿瘤生长,通过诱导自噬促进HCC细胞凋亡是抑癌的重要分子机制之一[15-16]。在肥大型心肌细胞中,miR-365表达显著上调,可负向调控心肌细胞自噬,引起自噬失调[17]。细胞自噬受机体多种基因和蛋白严密调控,参与调控自噬的基因统称为ATG家族,其中ATG3参与调节LC3蛋白脂化系统[18]。LC3分为Ⅰ型和Ⅱ型,发生自噬时,Ⅰ型经泛素样修饰转变成Ⅱ型,LC3-Ⅱ含量与自噬泡数量成正比,是发生自噬的标志性蛋白。Beclin1是自噬启动因子,其活性下降或缺失抑制自噬的启动,促进肿瘤进展。p62蛋白是自噬负性调控因子,参与调节自噬降解途径。本研究转染miR-365后,透射电镜提示细胞发生自噬,进一步经Western blot检测,结果显示过表达miR-365后,ATG3、LC3-II、Beclin1蛋白表达升高,p62蛋白表达下降,提示过表达miR-365抑制SMMC-7721细胞增殖促进细胞凋亡,可能与诱导细胞发生自噬有关。
miR-365下游有众多靶基因,通过调节不同靶基因表达,发挥相应生物学功能[19]。本研究通过miR靶基因预测软件预测miR-365与ATG3存在相互结合位点,经双荧光素酶实验验证miR-365与ATG3之间存在靶向性,与YANG等[20]研究结果一致,由此推测,过表达miR-365可能是通过靶向促进ATG3表达,激活细胞自噬,诱导细胞凋亡,抑制细胞增殖。
综上所示,过表达miR-365可诱导HCC细胞自噬,从而抑制细胞增殖促进其凋亡,其可能是通过靶向上调ATG3表达,调节细胞自噬水平,为临床治疗HCC提供新的治疗靶点。

