多时间点电针对腰多裂肌损伤大鼠HGF 及相关因子影响
李欣怡,李亚军,李祎琳,陈 莉,陈 洁,许 玥,张 莉*,刘 通*
(1.北京中医药大学,北京100029;2.河北省保定市第一中心医院,河北 保定071000;3.承德医学院,河北 承德067000;4.中国中医药出版社,北京100029;5.广州中医药大学第五临床医学院,广东 广州510000)
腰多裂肌是腰椎的最强稳定器,腰多裂肌损伤影响腰椎稳定。肌卫星细胞(muscle satellite cells,MSC)作为肌肉损伤微环境的重要干细胞,受到牵拉刺激被激活,促进损伤肌肉的修复[1]。 肝细胞生长因子(hepatocyte growth factor, HGF)通过激活肌卫星细胞参与组织再生和修复[2],它的特异性受体酪氨酸激酶c-Met 与HGF 结合而被激活,响应环境刺激促进组织重塑。 细胞性骨髓瘤样癌基因(cellularmyelocytomatosis oncogene, c-Myc)蛋白表达受生长因子影响,同样在参与细胞增殖活动中发挥重要作用[3]。因此,HGF 与c-Met、c-Myc 对于损伤微环境的改变值得探究。电针作为一种外源性刺激促进多裂肌损伤后修复[4],观察电针委中穴后相关因子动态改变,可加深对损伤微环境的认识。 故本文通过复制建立腰多裂肌损伤大鼠模型,探究不同时间点电针干预对于腰多裂肌损伤后HGF、c-Met、c-Myc 的表达及组织修复的影响。
1 材料与方法
1.1 动物与分组
SPF 级雄性SD 大鼠54 只,体质量为(300±20) g,由北京维通利华实验动物中心提供,许可证号:SCXK(京)2016-0006。 随机分笼并适应性饲养10 d,自由饮食普通饲料和水,明暗周期为12 h∶12 h,温度环境24 ℃,湿度40%~50%。 将54 只大鼠采用完全随机方法分为空白组、模型组、电针组,每组18 只。 根据干预时间点每组再分1 d、3 d 和7 d 3 个亚组,各组6 只。
1.2 主要试剂与仪器
1.2.1 主要试剂 布比卡因盐酸盐(美国Sigma 公司, 批号:80-477-DK);10% 水合氯醛(北京百诺威生物科技有限公司,货号:RH32027);4%多聚甲醛溶液(北京雷根生物技术有限公司,批号:90090525);HE(苏木素-伊红)染色剂试剂盒(北京索莱宝科技有限公司,批号:G1121);山羊抗兔二抗(北京中杉金桥生物科技有限公司,批号:SAP-9101);兔多抗HGF 抗体、兔单抗c-Myc 抗体(美国Abacm 公司,批号:ab216623,ab32072);兔多抗c-Met 抗体(美国Proteintech 公司,批号:25869-1-AP);兔多抗β-actin抗体(北京博奥森生物试剂有限公司,批号:bs-0061R);预染蛋白Maker(美国Thermo 公司,批号:26616);BCA 蛋白浓度测定试剂盒、SDS-PAGE 凝胶制备试剂盒(北京索莱宝科技有限公司,批号:PC0020,P1200);5X 蛋白上样缓冲液、RIPA 裂解液、ECL 超敏发光液(北京Coolaber 生物有限公司,批号分别为:SL1170,SL1010,SL1350)。
1.2.2 主要仪器 半自动化石蜡切片机(德国莱卡仪器有限公司,RM2245);电热恒温鼓风干燥箱(黄石市恒丰医疗器械有限公司,SKP-02.600);高速冷冻离心机(德国Eppendorf 有限公司,5810R);超低温病冰箱(美国Thermo Scientific 公司,FORMA907);全自动组织脱水机(德国徕卡仪器有限公司,ASP300S);正置智能型显微镜及采集系统(奥林巴斯中国有限公司,BX53);韩式电针仪(北京思盛达医疗器械中心,HANS200A);凝胶成像系统仪(美国AI-phaInnoteeh公司);电热恒温培养箱(黄石市恒丰医疗器械有限公司,SKP-02.600)。
1.3 动物造模
模型组和电针组复制大鼠腰多裂肌注射布比卡因建立损伤模型[4]。首先,选用10%的水合氯醛溶液(350 mg/kg)进行大鼠腹腔注射麻醉,以消除疼痛反射为度。成功后将大鼠四肢固定,背部备皮后暴露下腰,一次性注射器紧贴L4-L5 水平脊柱双侧的4 点棘突旁进针,针到达骨面后回抽无血注射。 每处注100 μL 的0.5% 布比卡因溶液,时间≥3 s,旋转针头拔出,操作过程保持无菌,模型制作完成。
1.4 干预方法
(1)电针组:造模24 h 后,将大鼠固定在操作台上,暴露背部和双侧后肢,参照大鼠解剖图[5]和最新国家标准穴位图[6],于大鼠膝关节背面正中取双侧委中穴干预。 针刺前用75%乙醇消毒,华佗牌0.25 mm×13 mm 一次性针灸针垂直刺入委中穴,连接韩式电针仪HANS-200A,2/100 Hz 的疏密波,电流强度1 mA,1 次/d,每次持续20 min。 (2)模型组:与电针组同步抓取、固定,不做其他处理。(3)空白组:不做任何干预,与其他两组大鼠同步取材。
1.5 取材
空白组、模型组和电针组分别于干预后1、3、7 d 同步取材。麻醉方式同动物造模,成功后将大鼠四肢固定,充分暴露腹部,先进行5 mL 以上的腹主动脉取血,再解开大鼠,将其俯卧暴露背部,固定四肢和头部,剪开大鼠背部皮肤,以镊子和组织剪剥离腰部筋膜,使腰骶部肌肉暴露,剥离开髂肋肌和最长肌,于L4-L5 锐性取下大鼠腰部的多裂肌,一侧放入4%多聚甲醛溶液固定,一侧迅速放入冻存管后投入液氮,待冷却后转移至-80 ℃冰箱。
1.6 检测指标及方法
1.6.1 HE 染色观察腰多裂肌形态 大鼠腰多裂肌组织置于4%多聚甲醛溶液固定48 h,将每一块组织转移至单个的包埋盒中。脱水与透明后,浸蜡包埋。使用半自动切片机连续切片,将包埋好的蜡块至水中展片,后在载玻片贴上,制好的载玻片于45 ℃恒温箱中进行烘干。结束后将石蜡切片放入浸泡用的铁架,经二甲苯(Ⅰ、Ⅱ,分别15 min)浸泡脱去切片中的石蜡,再经由高浓度至低浓度(100%、95%、90%、80%、70%、50%,分别1 min)的乙醇浸泡,最后转移至自来水冲洗2 min。 浸泡苏木素5 min 染色,再自来水洗1 min。 分化液10 s,自来水清洗10 min。浸泡伊红染色液2 min。 将切片浸于梯度乙醇脱水,二甲苯透明。 封片自然阴干后即进行显微镜观察。1.6.2 免疫组化法染色测HGF、c-Myc 表达 石蜡组织切片制作成功后,放入3%双氧水中浸泡10 min,PBS 溶液浸泡3 次,每次3 min,置抗原修复液中加热,自然冷却1 h 后,PBS 溶液浸泡3 次,每次3 min。切片于20%蛋清20 min 孵育,PBS 溶液浸泡1 次,3 min。 加山羊血清孵育在37 ℃环境下20 min,结束后不洗甩干。滴加一抗,置于4 ℃孵育过夜。结束后移至室温下复温30 min,而后放入PBS 溶液浸泡3 次,每次3 min。 滴加二抗,37 ℃孵育20 min。 结束后于PBS 溶液浸泡3 次,每次3 min。 滴加试剂SABC,于37 ℃20 min,最后PBS 溶液浸泡3次,每次3 min。 显色:滴加DAB 显色液10 min,在显微镜下观察,显色即可自来水冲洗,蒸馏水再次冲洗。苏木素溶液中复染3 min。脱水、透明后封片,自然阴干后即进行显微镜观察,采集图像进行分析。
1.6.3 Western blot 测c-Met 含量 取出存放在-80 ℃的腰部多裂肌组织,放置于预先配置的蛋白酶抑制剂和RIPA 裂解液混合溶液。使用超声粉碎仪充分裂解腰部多裂肌组织,选用BCA 法测量样品蛋白含量,绘制标准曲线后测定蛋白原液浓度。 用5×上样缓冲液按1∶4 比例与蛋白原液、RIPA 裂解液混合,放置水浴锅中加热,100 ℃5 min 后迅速静置冰上降温。 电泳、电转后,将膜取出置于丽春红染色液中,若目标蛋白完整清晰,用TBST 将染色液快速洗脱。然后将其浸没于由脱脂奶粉与TBST 配置的封闭液中,常温下置于摇床上,缓慢摇动1.5 h。 将膜取出放置于稀释好的一抗(c-Met 按1∶500 稀释,选用脱脂奶粉与10×TBST 配置)中,4 ℃摇床孵育过夜,后室温TBST 洗膜。 结束后将条带放入配制好的二抗稀释液(1∶3 000 稀释,选用脱脂奶粉与10×TBST 配置)中,室温摇床上慢速孵育1 h,后TBST洗膜。 洗膜结束后将目标条带显影曝光,进行图像分析。
1.7 统计学方法
采用SPSS 20.0 软件进行数据分析。每组样本数据用“±s”表示,服从正态分布采用单因素方差分析(One-Way ANOVA),两两比较方差齐时用LSD-t 检验,方差不齐用非参数检验。 以P<0.05 为差异有统计学意义。
2 结果
2.1 HE 染色观察肌纤维形态结果
空白组肌纤维细长多核,粗细均匀,纵向分布紧密;胞核呈扁椭圆形且靠近肌膜。干预1 d 后,模型组肌纤维坏死变形,肌纤维间隙增宽明显,间隙分布大量炎性细胞;电针组肌纤维增宽,间隙较模型组缩短,浸润的炎性细胞减少。干预3 d 后,模型组肌纤维形态仍不规则,部分排列开始紧凑,但仍有肌纤维的碎片存在,且大量炎性细胞分布;电针组肌纤维较模型组形态均匀、排列规则,间隙仍有炎性细胞浸润。干预7 d 后,模型组可见新生的肌纤维,且纤维间较干预1 d 和3 d 的模型组间隙缩短明显,仍有部分炎性细胞分布;电针组新生的肌纤维融合,排列紧密,细胞核开始向新生肌纤维边缘迁移。 详见图1。
2.2 免疫组化测定HGF、c-Myc 阳性表达情况

图1 大鼠腰多裂肌HE 染色结果(×200)
2.2.1 各组大鼠腰部的多裂肌HGF 阳性表达比较 与空白组比较,模型组1 d 组大鼠腰多裂肌HGF阳性表达降低(P<0.01);模型组3 d 组、7 d 组差异均无统计学意义(P>0.05)。与模型组比较,电针组治疗1 d 后腰多裂肌HGF 阳性表达升高(P<0.01);电针组3 d 组和7 d 组差异无统计学意义(P>0.05)。见表1、图2。
表1 各时间点大鼠腰多裂肌HGF 的平均光密度值(n=6,±s)

表1 各时间点大鼠腰多裂肌HGF 的平均光密度值(n=6,±s)
注:与空白组比较,##P<0.01;与模型组比较,&&P<0.01
组别空白组模型组电针组1 d 组0.37±0.02 0.30±0.02##0.36±0.05&&3 d 组0.38±0.03 0.36±0.04 0.40±0.01 7 d 组0.34±0.02 0.36±0.09 0.37±0.03
2.2.2 各组大鼠腰部的多裂肌c-Myc 阳性表达比较 与空白组比较,模型组1 d 组腰多裂肌c-Myc阳性表达升高(P<0.05),模型组3 d 组、7 d 组差异无统计学意义(P>0.05),电针组1 d 组、7 d 组腰多裂肌c-Myc 阳性表达升高(P<0.05 或P<0.01),电针组3 d 组差异无统计学意义(P>0.05)。与模型组比较,电针组1 d 组、3 d 组腰多裂肌c-Myc 阳性表达差异无统计学意义(P>0.05),电针组7 d 组表达升高(P<0.01)。 见表2、图3。
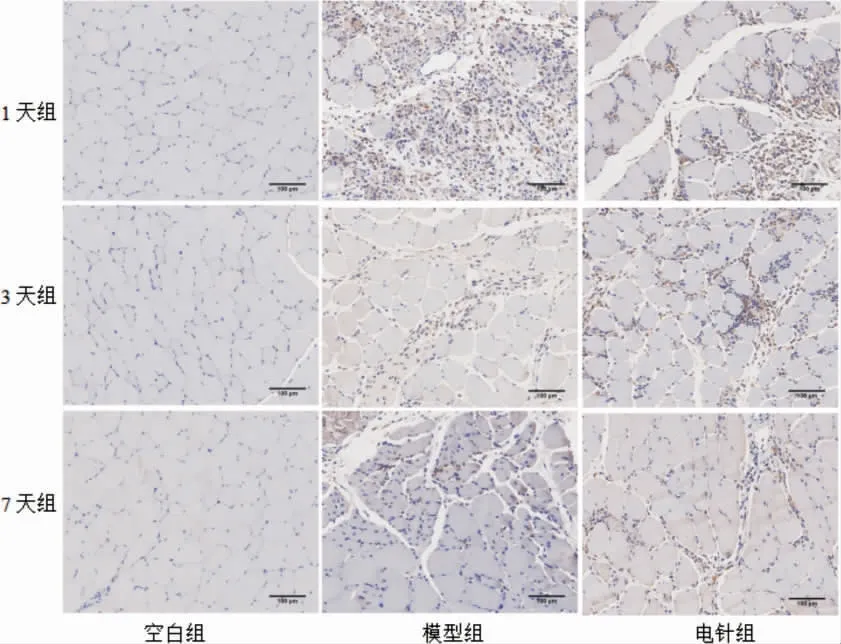
图2 大鼠腰多裂肌HGF 阳性表达结果(×200)
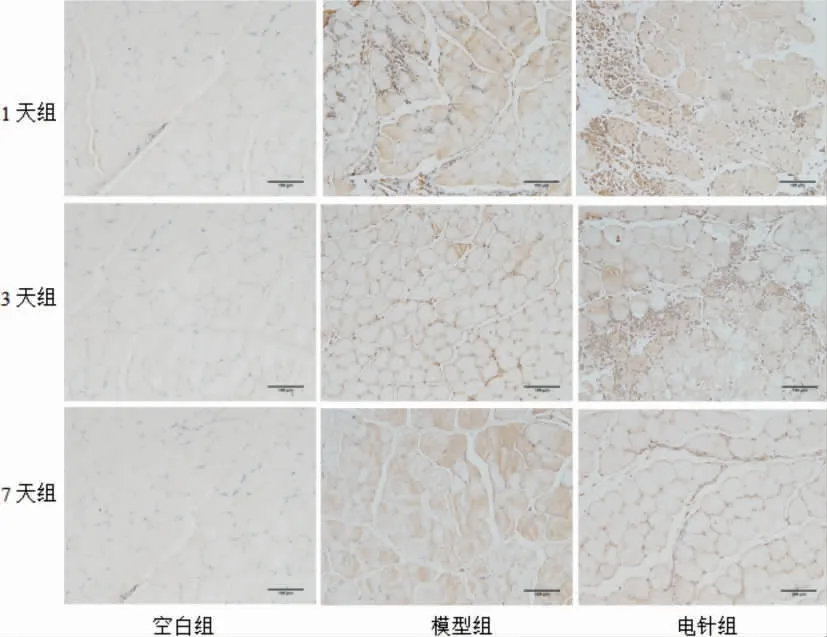
图3 大鼠腰多裂肌c-Myc 阳性表达(×200)
表2 各取材时间点大鼠腰多裂肌c-Myc 的平均光密度值(n=6,±s)

表2 各取材时间点大鼠腰多裂肌c-Myc 的平均光密度值(n=6,±s)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,&&P<0.01
组别空白组模型组电针组1 d 组0.20±0.01 0.24±0.02#0.25±0.04#3 d 组0.19±0.02 0.19±0.01 0.21±0.02 7 d 组0.18±0.02 0.18±0.01 0.23±0.03##&&
2.3 Western blot 检测c-Met 含量
与空白组相比,模型组和电针组各时间点腰多裂肌c-Met 表达量均降低(P<0.01);与模型组相比,电针组1 d 组、7 d 组腰多裂肌c-Met 表达量降低(P<0.05),电针组3 d 组腰多裂肌c-Met 表达量升高(P<0.01)。 见表3、图4。
表3 各取材时间点大鼠腰多裂肌c-Met 表达量(n=6,±s)

表3 各取材时间点大鼠腰多裂肌c-Met 表达量(n=6,±s)
注:与空白组比较,##P<0.01;与模型组比较,&P<0.05,&&P<0.01
组别空白组模型组电针组1 d 组0.54±0.03 0.31±0.02##0.28±0.02##&3 d 组0.48±0.03 0.24±0.02##0.36±0.02##&&7 d 组0.40±0.01 0.22±0.02##0.17±0.02##&
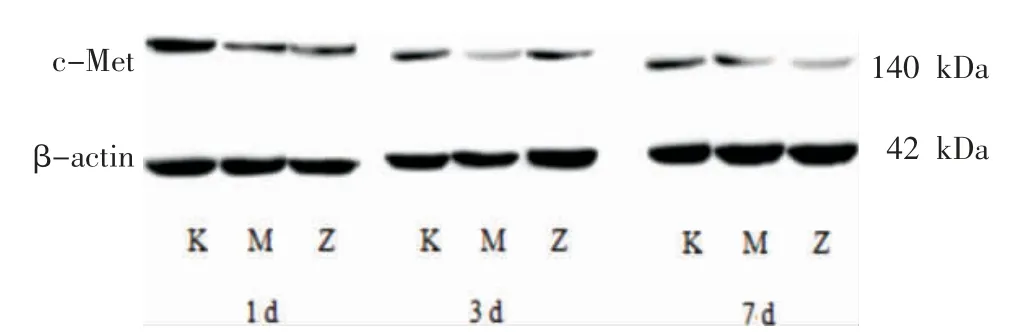
图4 各取材时间点大鼠腰多裂肌c-Met 表达量
3 讨论
多裂肌作为脊柱肌肉维持着腰椎稳定。 临床上许多腰痛患者通过MRI 检测到单双侧多裂肌萎缩[7-8]。由此可以看出,腰部多裂肌损伤后修复对于预防和治疗腰痛尤为重要。
本实验复制腰多裂肌损伤模型,一次性直接定量注射局部麻醉药0.5%盐酸布比卡因溶液,布比卡因具有肌肉毒性,可在不影响肌卫星细胞的情况下改变肌组织形态[4]。 HE 染色结果发现,模型组肌纤维破坏,提示造模成功。 干预后电针加速了多裂肌的恢复,出现新生肌纤维融合,电针在多裂肌损伤后的修复作用直观可见。 研究发现与腰多裂肌损伤后即刻干预和48 h 干预相比,24 h 电针干预的大鼠Myostatin、Myod、Foxol 和CDK4 表达改变差异更为显著,提示损伤后24 h 电针干预效果最佳[9-10]。在干预时间方面,研究发现与肾俞穴比较,电针委中穴对于骨骼肌损伤后早期有较好促修复作用[11],故本实验选择干预后1 d、3 d 和7 d,以观察早期电针干预对腰多裂肌损伤修复的影响。
肌卫星细胞作为成体肌源干细胞,受环境刺激激活进行增殖分化以修复受损细胞,对骨骼肌损伤修复发挥重要作用[12]。 研究表明外源性注射HGF 到正常肌肉中可激活静息状态卫星细胞,将HGF 注射到受损肌肉中则可促进肌细胞增殖[13]。 HGF 对针刺的机械牵拉刺激较为敏感,可诱导肌卫星细胞增殖,促进骨骼肌损伤后修复[14-15]。本实验发现模型组多裂肌损伤早期HGF 表达降低,提示腰部多裂肌损伤影响HGF 表达,7 d 后表达增高可能与损伤多裂肌组织的自我恢复有关。电针组整体趋势均高于模型组,且不同时间点变化趋势提示干预3 d 后HGF阳性表达升高,由此提示HGF 对电针干预后的骨骼肌修复早期效果明显。
HGF 与特异性受体c-Met 结合激活肌卫星细胞,共同参与对组织损伤的重塑。c-Met 作为受体酪氨酸激酶参与细胞增殖,对骨骼肌发育和再生起着重要作用[16]。 研究发现,c-Met 在骨骼肌损伤组织的肌卫星细胞中有表达,可能是肌损伤后修复的关键蛋白[17]。本实验发现,模型组整体腰部的多裂肌c-Met表达量低于空白组,提示多裂肌损伤致该蛋白表达减少。干预后1 d、7 d 电针组c-Met 表达量低于模型组,干预后3 d 电针组高于模型组,且不同时间点变化显示3 d 表达量高,提示电针干预后3 d肌卫星细胞中的c-Met 增加,但随着腰多裂肌组织再生,肌卫星细胞减少致c-Met 减少。
c-Myc 参与细胞周期、细胞增殖等变化。 c-Myc蛋白在增殖细胞中的表达较高,随细胞分化而降低,并失去促进增殖的能力[18]。 c-Myc 的水平得以提高在很大程度上依赖于生长因子[3,19]。研究发现,HGF 诱导髓母细胞瘤细胞中的c-MycmRNA 和蛋白质水平。当被生长因子刺激时,c-Myc 迅速积累并在整个细胞周期中保持高含量[20]。本实验结果显示,模型组1 d 腰多裂肌c-Myc 阳性表达高于空白组,模型组3 d 和7 d 表达与之基本一致,提示多裂肌损伤早期刺激c-Myc 参与细胞周期、细胞增殖等活动。 电针组腰多裂肌c-Myc 阳性表达高于模型组,且不同时间点变化趋势显示1 d 表达较之高,提示电针干预多裂肌损失模型引起c-Myc 早期作用,促多裂肌损伤后细胞增殖,进而有助于损伤后的修复。
综上所述,本实验通过建立大鼠腰多裂肌损伤模型,观察电针委中穴后不同组间的HGF 及相关因子表达情况,发现电针委中穴干预早期大鼠腰多裂肌HGF、c-Met、c-Myc 均上调,促肌卫星细胞修复损伤的腰多裂肌。

