复方丹皮酚纳米乳中丹皮酚和灵芝多糖的含量测定
苏酩,袁敏,孙晓彤,隋在云*
(1.山东省中医药研究院,山东 济南 250014;2.潍坊弘景中医药学校,山东 潍坊 261057)
癌症是目前世界公认的医疗难题,治疗难度高,发病率逐年上升。其中,肺癌死亡率居于首位,其恶性程度高,严重威胁人类健康与生命[1-2]。随着对癌症的深入研究,治疗药物剂型不断改进,治疗效果不断提高。复方丹皮酚纳米乳是本课题组研制的一种新型抗肺癌药物,其研究开发对于延长患者生命、改善患者的生活质量具有非常重要的临床意义。
丹皮酚的抗肿瘤作用显著[3-4],灵芝多糖也具有明显的抗肿瘤及免疫调节作用[5-6],得到国内外学者的广泛关注。复方丹皮酚纳米乳是由脂溶性的丹皮酚与水溶性的灵芝多糖制成的纳米乳剂,既解决了丹皮酚水溶性差、药物含量低、物理性质不稳定的问题,又解决了与灵芝多糖不能混合溶解的难题,能够提高药物的稳定性,增强抗癌活性。课题组前期研究发现,该制剂对人肺癌A549细胞具有抑制增殖和促进凋亡的作用[7]。
丹皮酚在药材、中药制剂中的含量测定方法有紫外分光光度法、胶束荧光法、差示分光光度法、气相色谱法、高效液相色谱法等,这些方法各有优缺点。而中药制剂的药味较多,成分复杂,多选用高效液相(HPLC)或气相色谱法进行定量分析,操作简单,结果理想。丹皮酚是复方丹皮酚纳米乳剂的主要有效成分,但其为脂溶性,难溶于灵芝多糖水溶液[6]。本制剂将丹皮酚包封制成纳米乳,以提高水溶性差的丹皮酚的溶解度,故丹皮酚的含量及包封率直接影响制剂的质量。
本研究参照相关文献[8-12],分别采用HPLC法、硫酸蒽酮比色法对本制剂中的丹皮酚、灵芝多糖含量进行测定,建立了复方丹皮酚纳米乳制剂中丹皮酚、灵芝多糖的含量测定方法,并对包封率的测定进行了研究。本方法简便、快速、准确,为制定复方丹皮酚纳米乳剂可行可控的质量标准提供了试验基础。
1 仪器与试药
1.1 仪器
Ultimate 3000高效液相色谱仪,Ultimate 3000紫外检测器,Chromeleon7工作站(美国Thermo公司);FA2004B型电子天平(上海精密科学仪器有限公司);JP-010洁盟牌超声波清洗机(深圳市洁盟清洗设备有限公司);TDL-40B型台式离心机(上海安亭科学仪器厂)等。
1.2 试药
丹皮酚(中国食品药品检定研究院,批号110708-201407);D(+)-无水葡萄糖对照品(上海源叶生物科技有限公司,批号S08J6G1);蒽酮(国药集团化学试剂有限公司);葡聚糖凝胶G-50(上海源叶生物科技有限公司);水(娃哈哈公司);甲醇、硫酸等所用试剂均为色谱纯或分析纯。三批复方丹皮酚纳米乳(批号20170201、20170202、20170203)由本课题组提供。
2 方法与结果
2.1 丹皮酚的含量测定
2.1.1 色谱条件

2.1.2 供试品溶液的制备
取本品0.2 mL置于100 mL量瓶中,加甲醇至刻度,过0.45 μm滤膜,即得。
2.1.3 对照品溶液的制备
取丹皮酚对照品加甲醇配成浓度为22.6 μg/mL的对照品溶液,即得。
2.1.4 色谱柱的筛选
使用色谱柱Lichrospher C18(150 mm×4.6 mm,5 μm,江苏汉邦科技公司)、ODS Hypersil C18(150 mm×4.6 mm,5 μm,美国Thermo公司)、ODS-2 Hypersil C18(250 mm× 4.6 mm,5 μm,美国Thermo公司),参照2.1.2项下方法进行测定。结果前两者色谱峰峰形不佳,有拖尾现象,最终选择色谱柱ODS-2 Hypersil C18(250 mm×4.6 mm,5 μm,美国Thermo公司),色谱峰对称性良好。
2.1.5 专属性试验
取缺丹皮酚空白纳米乳按2.1.2项下方法制得缺丹皮酚阴性对照溶液。取对照品溶液、供试品溶液、阴性对照溶液,按选定色谱条件进行分析,结果发现缺丹皮酚阴性对照的色谱图中无干扰峰。表明该方法专属性好,见图1。
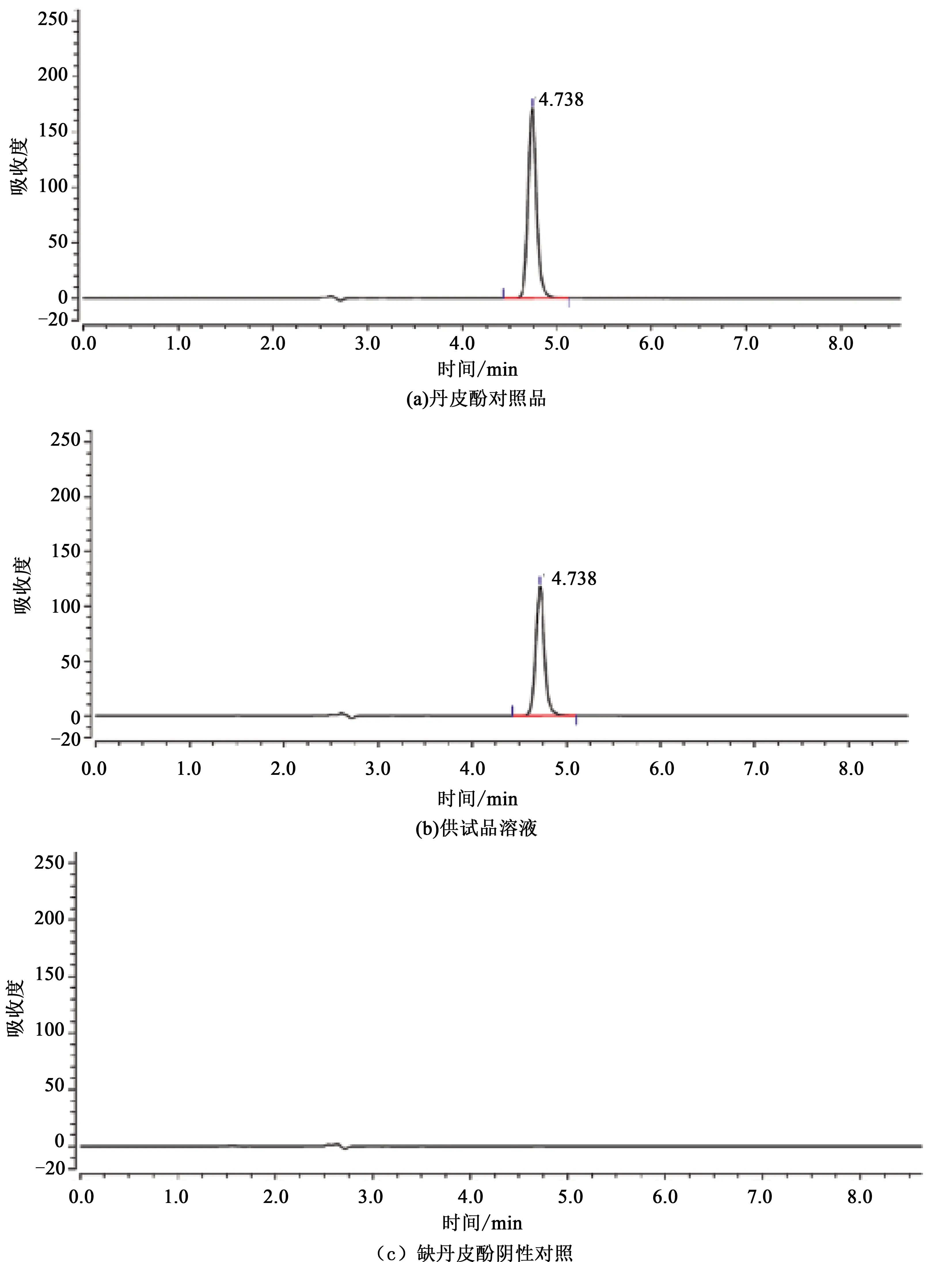
图1 丹皮酚 HPLC色谱图
2.1.6 线性关系考察
将对照品溶液分别进样1、3、5、10、15 μL,按选定色谱条件进行分析。得线性回归方程为y=77.255x+0.030 5(r=1.000 0),表明丹皮酚进样量在0.022 6~0.339 0 μg范围内线性关系良好。
2.1.7 精密度试验
取对照品溶液连续测定6次,峰面积的相对标准偏差(RSD)为0.175 %。
2.1.8 稳定性试验
取供试品溶液分别于0、2、4、8、12、24 h进行测定,峰面积的RSD为1.33 %,表明本品24 h内稳定性良好。
2.1.9 重复性试验
取本品(批号20170201)0.2 mL,平行6份,按2.1.2项下方法制备供试品溶液,丹皮酚含量的RSD为0.233%。
2.1.10 加样回收率试验
精密量取本品(批号20170201)0.1 mL,平行6份,分别加入丹皮酚对照品0.801 mg,混匀,按2.1.2项下方法制备,结果平均回收率为99.80 %,表明该方法回收率良好,见表1。

表1 回收率试验结果
2.1.11 样品含量测定
将对照品溶液与3批供试品溶液按选定色谱条件进行测定,结果表明3批制剂中丹皮酚的含量稳定,差别较小,见表2。
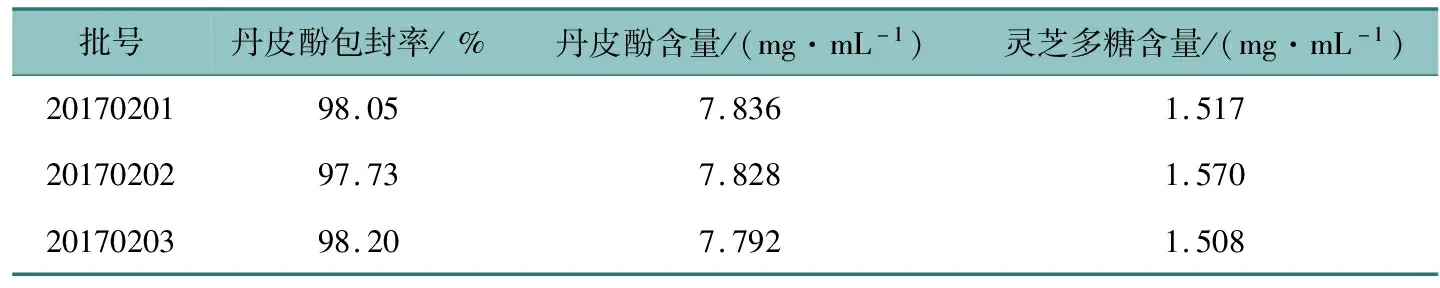
表2 测定结果
2.2 灵芝多糖的含量测定
2.2.1 供试品溶液的制备
分别取本品10 mL于3个锥形瓶中,边搅拌边缓慢滴加乙醇60、80、100 mL,于4 ℃放置12 h后,加入60 mL与100 mL乙醇的锥形瓶中液体呈浑浊状态,而加入80 mL乙醇的锥形瓶中液体沉淀明显,因此确定乙醇加入量为80 mL。确定的制备方法为:取本品10 mL于锥形瓶中,边搅拌边缓慢滴加乙醇80 mL,于4 ℃放置12 h后,离心10 min(4000 r/min),将沉淀物加水溶解后转移至50 mL量瓶中,加水至刻度,备用。精密量取1 mL置于50 mL量瓶中,加水定容,即得。
2.2.2 对照品溶液的制备
取无水葡萄糖对照品加水配成浓度为0.139 5 mg/mL的溶液,即得。
2.2.3 缺灵芝多糖阴性对照溶液的制备
取缺灵芝多糖空白纳米乳10 mL于锥形瓶中,按2.2.1项下方法制备,即得。
2.2.4 专属性试验
取供试品溶液、对照品溶液及缺灵芝多糖阴性对照溶液,按《中国药典》[11]中的蒽酮硫酸比色法进行检测,分别在400~700 nm波长范围内扫描,结果缺灵芝多糖阴性对照无干扰,最大吸收波长为625 nm。见图2。
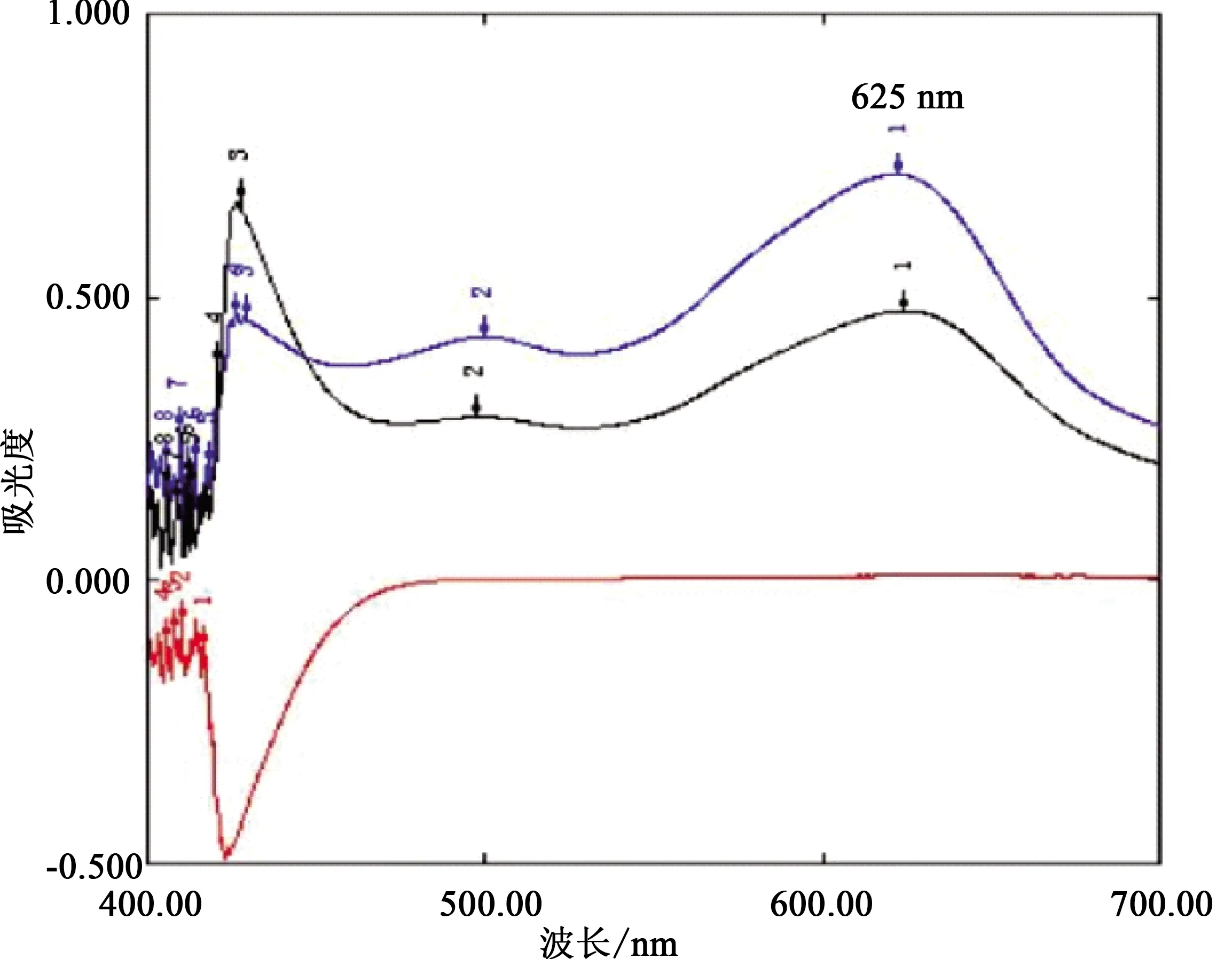
1—为无水葡萄糖;2—为供试品;3—为缺灵芝多糖空白。
2.2.5 标准曲线的制备
按照《中国药典》[11]方法得回归方程为y=0.041 02x-0.013 96(r=0.999 6),线性范围0~16.74 mg/L。
2.2.6 精密度试验
取供试品溶液连续测定6次,吸光度的RSD为0.168%。
2.2.7 稳定性试验
取供试品溶液每间隔10 min测定1次,50 min内的吸光度的RSD为1.09 %。
2.2.8 重复性试验
取供试品溶液平行测定6份,灵芝多糖含量的RSD为1.78 %。
2.2.9 加样回收率试验
取2.2.1项下的备用溶液0.5 mL置于50 mL量瓶中,平行6份,加入无水葡萄糖对照品0.148 mg,加水至刻度,按药典中检测法测定结果平均回收率为 98.23%。表明该方法回收率良好,结果见表3。
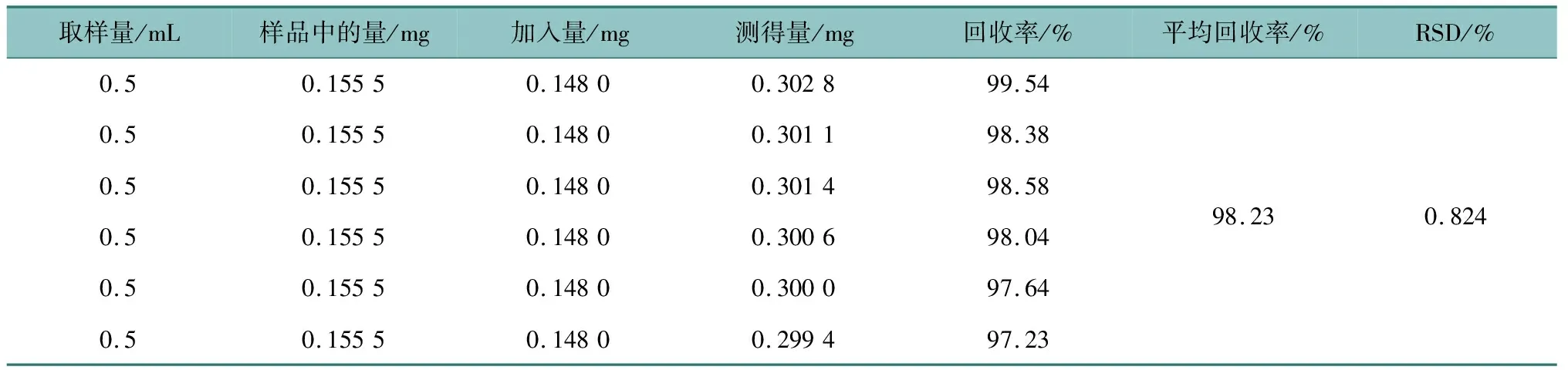
表3 回收率试验结果
2.2.11 样品含量测定
取对照品溶液与3批供试品溶液测定灵芝多糖的含量,结果表明3批制剂中灵芝多糖的含量稳定,差别较小,见表2。
2.3 包封率的测定
2.3.1 纳米乳洗脱曲线的制备
称取葡聚糖凝胶G-50 1.1 g,加水200 mL溶胀24 h,湿法装柱(内径1.0 cm,柱长40 cm),精密吸取本品0.2 mL上样,洗脱速度为0.5mL/min,收集洗脱液于离心管(1 mL/管)中,共收集80管。将每管洗脱液分别转移至2 mL量瓶中,加甲醇定容。按2.1.1项下的色谱条件进样测定,以管数为横坐标,丹皮酚峰面积为纵坐标绘制洗脱曲线。结果见图3。

图3 复方丹皮酚纳米乳洗脱曲线
结果显示,本品通过葡聚糖凝胶柱后,游离丹皮酚与纳米乳分离,前20管为复方丹皮酚纳米乳流出曲线,从第21管为游离丹皮酚的流出曲线,即纳米乳先被洗脱出,游离丹皮酚后被洗脱出。
2.3.2 包封率的测定方法
分别精密吸取3批复方丹皮酚纳米乳0.2 mL,按2.3.1项下方法制备,收集洗脱液前20管至50 mL量瓶中,加甲醇定容,按2.1.1项下的色谱条件进样测定,计算含量,得被包封的丹皮酚浓度c1。精密吸取本品0.2 mL至100 mL量瓶中,加甲醇定容,按2.1.1项下的色谱条件进样测定,计算含量,得本品中丹皮酚的总浓度c2。包封率计算为:丹皮酚的包封率=(c1/c2)×100%。结果3批制剂中丹皮酚的包封率均大于97%(见表2),包封率高。
3 结论
本研究采用HPLC 法对复方丹皮酚纳米乳制剂的丹皮酚进行含量测定研究,采用硫酸蒽酮比色法测定灵芝多糖的含量,并对该制剂中丹皮酚的包封率进行了评价。结果3批复方丹皮酚纳米乳中丹皮酚、灵芝多糖的平均含量分别为7.612、6.127 mg/mL,平均包封率为97.99%,含量稳定均一,包封率高。本研究建立的含量测定方法简便可行,快速准确,可作为复方丹皮酚纳米乳的质量标准,为同类新型乳剂的研究提供参考,为开发治疗肺癌的中药新药提供科学依据。

