氧化铀在离子液体中溶解及铀的分离
郭 纵,褚泰伟
北京大学 化学与分子工程学院,放射化学与辐射化学重点学科实验室,北京分子科学国家实验室,北京 100871
目前最成熟的乏燃料后处理流程是以PUREX(plutonium and uranium reduction extraction)流程为代表的湿法后处理流程,使用传统有机稀释剂和萃取剂进行乏燃料的分离和纯化[1]。湿法后处理虽是比较成熟的工艺,但仍存在一些缺点,难以满足新的生产需求,比如湿法后处理工艺难以处理燃耗深、冷却期短的乏燃料。干法后处理临界安全性高、放射性废物少、耐辐照性更好,近年来得到了广泛关注[2]。干法后处理常需要使用高温熔融盐,这种方法具有一些缺点,如成本高、对材料耐腐蚀性要求高、安全性风险高等。因此具有低熔点的离子液体在乏燃料后处理领域逐渐得到重视[3-7],其中使用离子液体溶解乏燃料形成非水溶液,为后处理技术提供了新的思路和机遇。本文综述了离子液体用于溶解氧化铀的相关工作,并对溶解后溶液的表征及铀的分离进行了总结。
1 离子液体与氧化铀溶解
离子液体(ionic liquids,ILs)是在室温及相邻温度下完全由离子组成的物质[8]。离子液体一般具有高的热稳定性和化学稳定性、宽的电化学窗口和可设计性[9]。离子液体的低挥发性和不可燃性,可以避免传统可燃性、易挥发溶剂燃烧而引起的危险,是一种具有应用前景的新型溶剂[8]。
UO2具有萤石型(CaF2)晶体结构,其中U(Ⅳ)离子占据八面体位置,而氧离子(O2-)占据四面体位置[10-11]。已有研究将离子液体用于溶解过渡金属氧化物[12-17],相比于过渡金属和很多镧系金属氧化物,UO2具有相对更高的晶格能,溶解难度更大[18]。U3O8含有多种晶型,最主要的为α型具有面心斜方结构,U3O8中铀的价态为U(Ⅴ)和U(Ⅵ)[19]。UO3有六种晶型,其中只有γ型在常压下较稳定,α、β、γ、δ四种晶型在常压下加热时均分解生成U3O8。此外,由于大多数金属氧化物均具有亲水性表面,体系中水的存在常能促进金属氧化物在离子液体中的溶解[20]。干燥的疏水性离子液体对金属氧化物的润湿性差,这也提高了无水体系中离子液体溶解氧化铀的难度。
离子液体溶解氧化铀具有以下几个优势:(1) 离子液体体系直接溶解氧化铀可以避免传统硝酸溶解元件产生的大量放射性废水;(2) 离子液体可以在更加温和的条件下溶解氧化铀[21-22],不需要高温下形成熔融盐从而降低了能耗,并减轻了对设备的腐蚀;(3) 由于离子液体体系的可设计性,使其在选择性溶解和分离方面具有更大优势[23-24];(4) 由于离子液体具有较大的电化学窗口,为使用电化学方法选择性沉积金属、金属氧化物提供了更大的可能性[25-26]。总结来说,离子液体溶解氧化铀在缩短处理流程,减少处理过程中的能源、材料的消耗等方面具有很大的发展潜力,为乏燃料后处理提供更加绿色的方法。
2 离子液体溶解氧化铀及铀的分离
2.1 含氯铝酸盐的离子液体体系
2.2 含质子酸的离子液体体系
Fan等[18]尝试用含水质子化[Hbet][Tf2N]离子液体溶解模拟乏燃料,UO2在其中溶解度很低,40 ℃时溶解不足1%,但相同条件下该体系可以高效溶解M2O3和MO型氧化物(M为金属离子)。利用1 mol/L的HCl溶液反萃98.18%(摩尔分数)的钕和94.17%(摩尔分数)的铀,反萃后去离子水洗涤实现[Hbet][Tf2N]的重复利用。该方法可以将裂变产物溶解在离子液体中,而UO2等保留在残渣中,从而实现裂变产物与UO2等的分离。根据分析,离子液体中金属氧化物的溶解行为主要取决于MxOy晶格破裂所需能量的相对值,以及金属-bet-水配合物形成过程中释放的能量。但Fan等[18]认为晶格的破坏和晶格能量的差异是导致溶解差异的主要原因。作者引入MxOy型化合物的晶格能/x值(晶格能/x为部分破坏晶格和形成一个自由金属离子所需的能量)。结果表明,晶格能/x的变化趋势与溶解性能相符,晶格能/x值相对较大(>10 000 kJ/mol)的氧化物无法溶解在[Hbet][Tf2N]体系,而晶格能/x值较小(<7 000 kJ/mol)的氧化物可以溶解。
在排除水的条件下,Richter等[15]检测了无水[Hbet][Tf2N]对Al2O3、BaO、Bi2O3、CaO、Co3O4、Cr2O3、Cu2O、CuO、Fe2O3、Ga2O3、GeO2、In2O3、MgO、MnO、MnO2、MoO3、Nb2O5、NiO、PbO、PbO2、ReO3、Sb2O3、SnO、SrO、ThO2、TiO2、V2O3、V2O5、WO3和ZnO的溶解效果,发现了与Fan等[18]提出的规则不符的例外。Richter等[15]认为晶格能/x并不是预测溶解性的唯一标准,溶解温度、溶解产物的配位能力、金属氧化物的酸碱度等因素也应该被考虑在内。
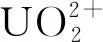
Tomioka 等[35]在超临界二氧化碳介质中通过加入HNO3-磷酸三丁酯(TBP)复合物实现了UO2和U3O8的溶解,结果表明,溶解速率随着 HNO3/TBP比例升高而增加。HNO3-TBP复合物具有多种功能,可促进溶解反应中的基本反应步骤,例如氧化物的质子化、U(Ⅳ)的氧化,形成UO2(NO3)2(TBP)2以增溶U(Ⅵ)。Tomioka 等[35]提出的溶解过程如式(1、2)所示:

(1)

(2)
Wai等[36]借鉴Tomioka等[35]的方法,利用TBP(HNO3)1.8(H2O)0.6复合物在室温下即可将UO2直接氧化溶解在[Bmim][Tf2N]离子液体中。3.6 mL含有TBP(HNO3)1.8(H2O)0.6复合物(体积分数为16.7%)的[Bmim][Tf2N]离子液体中,UO2的最大溶解量约为320 mg。超临界CO2萃取的传质过程很迅速,在10 min内即可完成UO2(TBP)(NO3)2·HNO3复合物的回收,在离子液体溶解过程和超临界CO2反萃过程中均未形成水相。
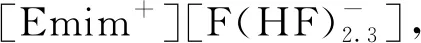
(3)

(4)
常规工业方法合成UF4时需在高温条件下使用大量HF,而这种使用含氟离子液体的方法条件更温和,提供了更安全、经济的转化方法。
为了更好地优化门诊服务管理,2015年,李红副院长和林茜主任开始建立专责小组,采用信息系统数据采集和现场调查两种方式追踪医生、患者行为,力图发现门诊管理的一些问题。
2.3 含氧化剂的离子液体体系
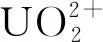
Freemantle等[39]在1998年时提出在离子液体中加入Bronsted酸或Lewis酸将乏燃料溶解于离子液体的方法,使乏燃料中的铀从+4价转变为+6价、钚从+4价转变为+6价从而溶解。HNO3作为Bronsted酸和氧化剂能够有效地氧化溶解UO2,但是由于溶解时会反应生成水,使络合剂的酸度难以控制,不利于后续的处理和回收利用。在离子液体体系中预先溶解非质子性的Lewis酸,比如氧化性的气体、氧化性金属离子,为溶解UO2提供了新的思路。
何辉等[40]公开了将UO2、PuO2或乏燃料溶解于含有N2O4或NO2强氧化剂的离子液体中的方法。加入的N2O4或NO2的物质的量是金属氧化物的1.5~4倍,在45 ℃以上搅拌溶解UO2、PuO2或乏燃料。该方法具有溶解速率快(1 h内完全溶解)、经济性好、适合各种离子液体体系的特点。


(5)
虽然氧化性气体可以有效氧化溶解二氧化铀且不向溶解体系中引入杂质,但气体毒性较大,对研究人员的健康构成威胁。在离子液体体系中,引入无毒或者少毒的氧化剂更具有实用意义。本课题组的姚爱宁等[43]对咪唑氯盐和相应的咪唑-FeCl4混合离子液体体系氧化UO2进行了比较深入的探究。1 mL铁基离子液体中以1∶1摩尔比加入相应咪唑氯盐,在140 ℃下,[Bmim]FeCl4/[Bmim]Cl和[Emim]FeCl4/[Emim]Cl混合离子液体体系中0.5 h内即可完全溶解25.3 mg UO2。改变咪唑阳离子,[Bdmim]FeCl4/[Bdmim]Cl([Bdmim]+=1-甲基-2,3-二甲基咪唑阳离子)体系则需要更长的溶解时间。逐渐增加体系中[Bmim]Cl占比后,可提高UO2最大溶解量,如表1[42]所示。
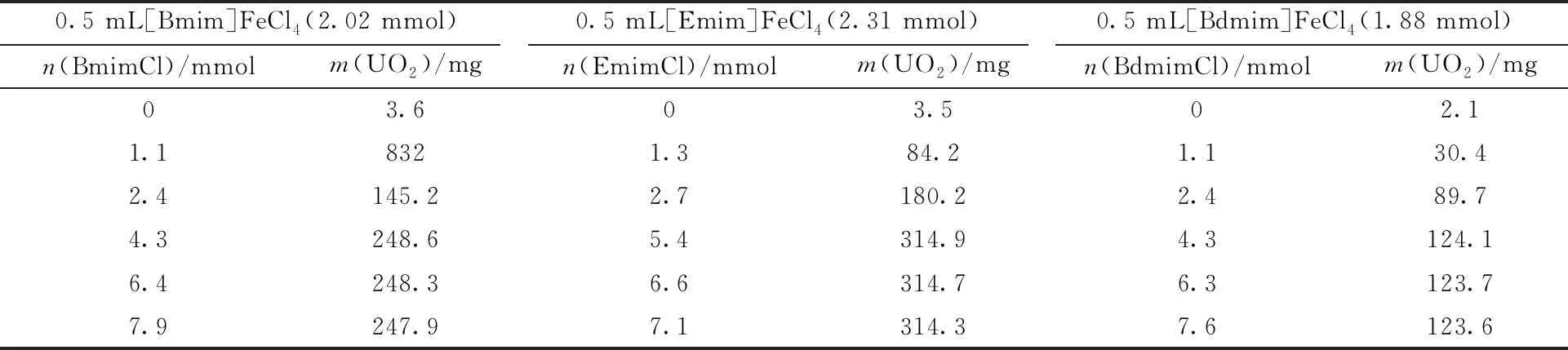
表1 UO2在含铁离子液体中的最大溶解量[42]Table 1 Maximum dissolved amount of UO2 in iron-containing ionic liquid[42]
(6)
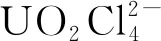
综上所述,对含氯铝酸盐的离子液体体系、含质子酸的离子液体体系和含氧化剂的离子液体体系溶解铀的氧化物及三类离子液体体系的优缺点进行小结,分别列入表2和表3。
3 溶解后溶液的表征方法
对于离子液体体系中铀的配位化学已经有比较丰富的研究工作,研究方式也比较多样。如上所述,用于溶解氧化铀的离子液体体系中大多含有卤素离子、硝酸根、羧基官能团等配位基团。这里主要讨论了常见的与离子液体溶解铀氧化物相关的表征手段,以确定溶解液体系中铀的物种存在形式。
3.1 紫外可见吸收光谱
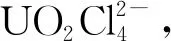
3.2 红外光谱和拉曼光谱


表2 不同离子液体体系溶解铀的氧化物小结Table 2 Summary of dissolved uranium oxides in different ionic liquid systems

表3 不同离子液体溶解UO2优缺点小结Table 3 Summary of advantages and disadvantages of different ionic liquids for dissolving UO2
3.3 扩展X射线吸收精细结构谱(EXAFS)
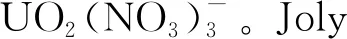
3.4 质谱
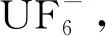
3.5 电化学

4 总结与展望
离子液体作为一种新型溶剂,具有蒸气压低、电化学窗口宽、可修饰等优点。相比于传统有机溶剂体系和熔融盐体系,离子液体体系在提高UO2溶解效率和溶解选择性、降低溶解条件要求、提高安全性等方面具有优势,在溶解氧化铀方面具有一定的发展前景。但离子液体价格更高,黏度较大,对环境的影响也需要进一步测评,离子液体用于溶解UO2仍处于初步探究阶段,缺少辐照稳定性等实验探究,投入工业化生产前仍需要进行大量的研究工作。目前已有几类离子液体用于溶解氧化铀,如含氯铝酸盐的离子液体体系、含质子酸的离子液体和含氧化剂离子液体溶解铀的氧化物。目前这些体系仍存在一些需克服的因素,比如:
(1) 体系仍含水或溶解过程中产生水,如含质子酸离子液体体系;这会影响溶解过程中对体系酸度的控制,也会影响后续电化学回收分离铀等;
(2) 一些非氧化性离子液体体系溶解UO2的效率较低,比如含羧酸离子液体;U(Ⅳ)的溶解性明显差于U(Ⅵ),在体系中引入氧化性物质对于溶解UO2非常重要;
(3) 目前离子液体体系中引入的氧化性物质为气体和金属离子。虽然可以高效溶解UO2并通过加热降压等操作直接从体系排出,但氧化性气体对操作人员的安全造成威胁,且可操作性较液体差;金属基离子液体虽然可以高效溶解并回收UO2,但向体系中额外引入了金属离子;
(4) 对溶解过程的热力学、动力学过程和机理研究不够透彻,大多数研究仍止步于溶解效果的检测。
鉴于以上这些问题,仍有必要继续开发新的离子液体体系,保证在无水条件下利用更加安全、经济环保的氧化剂来实现UO2的溶解,并进一步加深对溶解机理和溶解过程的理解。

