α放射性金属药物的研究现状与展望
崔海平,沈浪涛,2,3,*
1.原子高科股份有限公司,北京 102413;2.中国同辐放药研发中心,北京 102413; 3.中国原子能科学研究院 国家同位素工程技术研究中心,北京 102413
在元素周期表中89—103号元素被称为锕系元素(actinoid element)。锕系元素均具有放射性。在自然界中仅存在锕、钍、镤和铀这4种锕系元素。锕和镤在地球中的含量极低,但是钍和铀以较大的量(钍的地壳元素丰度约为6 ppm(1 ppm=1×10-6),铀的地壳元素丰度约为1.8 ppm)存在,因此可以采用常规的开采方法进行提取。其它的锕系元素只能通过人工方法合成[1-2]。从Becquerel放射性的发现(1896年),Hahn等实现铀的裂变(1938年)到人类第一个核反应堆的建成(1942年),标志着人类已进入了原子能时代[3]。到目前为止,锕系元素中的铀、钚等元素已在核能等领域得到了广泛应用[4]。在2018年年底,全世界运行中的核电站共有450座。在这些核电站中使用的核燃料均为铀、钚元素的氧化物[5]。一方面,铀、钚等锕系元素在核电、核武器等方面的应用已广为人知;另一方面,尽管锕系元素在人类疾病、尤其是恶性肿瘤治疗方面已显示出了很有希望的应用前景[3, 6-8],但相对来说,人们对此还是了解得较少。因此,本文将从与靶向α治疗(targeted alpha therapy, TAT)相关的锕系元素以及其放射性金属衰变子体(225Ac、227Th、223Ra、212/213Bi和212Pb)着手,对这些放射性金属核素的基本性质、制备方法、双功能螯合剂、TAT药物的研究现状、所面临的挑战性问题和前景展望等方面进行评述。
1 肿瘤的疗法、靶向放射性核素治疗和靶向α治疗
目前,治疗肿瘤的方法主要有手术、全身化疗和放疗(包括外部射线照射)、免疫治疗、抗激素治疗、靶向放射性核素治疗(targeted radionuclide therapy, TRNT)等[9]。具体选择哪种治疗方法要根据肿瘤所在的部位、分期以及病人的状态而定。在许多肿瘤的治疗中,化疗越来越多地与手术结合使用。化学疗法与细胞周期或细胞代谢的重要过程相互作用,因此阻止或抑制肿瘤的生长。化疗药物不能区分某些健康细胞和肿瘤细胞,因此,化疗是非特异的治疗方法。外部射线放疗不适用于已转移的肿瘤。免疫疗法通常需要解决特定的耐药性问题[10]。
靶向放射性核素治疗(TRNT)通过使用优化的载体把细胞毒性的放射性传送到肿瘤细胞,从而对肿瘤细胞实行选择性的辐射,而对周围健康组织产生最小的毒性。TRNT是正在增长且有利的治疗肿瘤的方法。在TRNT中,一般利用β粒子、俄歇电子和α粒子这三种辐射。长期以来,TRNT主要使用发射β粒子的放射性药物。例如,131I ([131I]NaI)用于分化型甲状腺肿瘤的治疗,89Sr([89Sr]SrCl2)和153Sm([153Sm]Sm-EDTMP)用于骨转移瘤的治疗,177Lu标记的奥曲肽([177Lu]Lu-DOTATATE)用于神经内分泌肿瘤的治疗,90Y标记的单抗(Zevalin)用于非霍奇金淋巴瘤的治疗等。直到2013年5月,世界上第一种α核素药物([223Ra]RaCl2)才获准上市。与同类药物[89Sr]SrCl2和[153Sm]SmEDTMP比较,[223Ra]RaCl2不但改善了病人的生活质量,而且延长了病人的生命[3]。首个α核素药物的成功上市,激发了人们对靶向α治疗(TAT)的浓厚兴趣[11-12]。
靶向α治疗(TAT)被定义为将发射α粒子的放射性药物选择性地传送到癌细胞和肿瘤微环境,以控制肿瘤并同时最大程度地降低毒性的治疗方法[13]。关于TAT的临床前研究历史可以追溯到几十年前,但第一位患者于1995年接受治疗,TAT在1999年才首次出现在临床研究文献中[14]。
表1[15]列出了目前常用的β粒子与α粒子在物理和辐射生物学等方面性质的差异。
α粒子和β粒子在质量、能量、电荷等方面的显著差别将导致它们与生物材料作用时产生显著不同的后果。α粒子的质量约为β粒子的7 300倍。β粒子在生物组织中的行进距离可达1.5~19 mm,而α粒子的行进距离约为16~75 μm。动物细胞为真核细胞,其直径为10~30 μm。这意味着α粒子只能穿过几个细胞,而β粒子能穿过几百个细胞。

表1 α粒子与β粒子的性质比较[15]Table 1 Physical property of α particles and β particles[15]
线性能量传递 (linear energy transfer, LET,单位keV/μm)是单位长度原子电离/激发的量度,指粒子穿过单位长度传递给被作用物质的能量。高的LET是高电离辐射的典型特征并表示能量的密集沉积,对生物组织的生物和化学损伤大[16]。对于大肿瘤的治疗,能产生长射程组织作用的粒子是有利的,然而,人们越来越多地认识到,长射程组织作用是不可取的,因为它与脱靶毒性直接相关。粒子的LET和在生物组织中的作用范围与放射性核素相关并受衰变类型和能量的影响较大。β粒子的LET约为0.2 keV/μm,其作用范围为1.5~19 mm,相当于约50~1 000个细胞的直径;而α粒子的LET高达约50~230 keV/μm,其作用范围约为16~75 μm,相当于约2~10个细胞的直径[13, 15-17]。
不同种类的辐射产生不同的生物效应,这被定义为相对生物学效应(relative biological effectiveness, RBE)。它通过将剂量乘以加权因子(WT)得到。粒子的LET越大,产生的生物效应越大,因此,赋予它的加权因子就越高。光子或电子的WT被定义为1,而具有高电荷的α粒子的WT为20。与β粒子相比,α粒子的相对生物学效应更大[18]。放射生物学细胞存活研究表明,杀死哺乳动物细胞的最有效LET约为100 keV/μm。在此最佳的LET下,电离事件与DNA双链的直径(≈2 nm)一致,导致细胞中致命的DNA双链断裂[15]。当细胞被低LET的β粒子以低的剂量率辐照时,在辐照期间细胞就能修复损伤,因此,杀死细胞是困难的。同样,如果氧的浓度低或无氧状态,比如在乏氧和坏死组织中,用辐照杀死细胞也是很困难的。但是,具有高LET的α粒子具有强大的细胞杀伤效率,即其杀伤作用与辐射剂量率和氧的浓度无关。假设1个横穿单个细胞的α粒子就可以将该细胞杀死的话,要达到同样的效果,则需要有400个横穿该细胞的β粒子才行。
总之,当通过适当的方法把α粒子靶向到疾病部位,其巨大的能量就沉积到此局部位点,通过细胞核中DNA双螺旋链的断裂引起细胞的凋亡。α粒子杀死细胞的效率与细胞中的氧浓度无关。因此,在标准放化疗中具有抗药性的乏氧肿瘤细胞在α粒子治疗中却是脆弱的。α粒子在相对较小的范围内对细胞产生直接的损伤作用。此外,α粒子还通过辐射诱导的旁观者效应对相邻细胞造成额外的损伤。但是,与长射程的β粒子相比,α粒子的旁观者效应更小,对邻近肿瘤微环境中的正常细胞的间接损害较小,即毒副作用低。
2 源自锕系元素的α放射性金属核素
如上所述,从辐射生物效应等方面考虑,α粒子的治疗效果应该比β粒子更好且副作用小,到目前为止,已发现100多种放射性核素在放射性衰变过程中发射α粒子[13]。但在这些核素中,只有极少的一部分可用于医学治疗。当选择合适的医用α放射性核素时,应当综合考虑以下因素:(1) 发射α的丰度;(2) 物理半衰期;(3) 它所产生的子体以及子体的半衰期;(4) 生产的成本。与高α丰度的核素相比,低α丰度的核素需要采用更高活度的核素才能获得同样的α剂量,而更高活度的放射性将产生大的非靶毒性。核素的半衰期也很重要,太短(如小于30 min),未到达体内靶点前大部分的放射性药物就会衰变,另外,过短半衰期的核素很难制备放射性药物并很难在药物大量衰变前完成质控工作。过长的半衰期(如超过1个月)也不利,会给病人带来更多的辐射损害。核素发生衰变时所产生的子体的性质也是需要考虑的重要因素。最理想的情形应该是,该放射性核素衰变成一种稳定的同位素,而没有其它放射性物质产生。但实际情况多是,放射性核素衰变成另一种放射性核素,而这种新产生的放射性核素再继续衰变成另一种放射性核素,等等。如果一种发射α的放射性核素产生于母体核素,那么所产生的子体在体内可能重新分布并产生有害的毒性。
现已被用于放射性药物研究中的α放射性核素有223Ra、225Ac、212/213Bi、212Pb、227Th、211At和149Tb等。本文仅讨论有望用于TAT的源自锕系元素的α放射性金属核素,其性质列于表2[19]。

表2 源于锕系元素用于靶向α治疗的放射性核素[19]Table 2 α-emitting radionuclides from actinides for use in TAT[19]
表2中,225Ac和227Th本身就是锕系元素中的核素,而其它核素均是锕系元素衰变产生的子体。这些α核素的共同特点均是放射性金属核素。除223Ra药物外,其它α核素构建靶向放射性药物时均需考虑其配位化学性质。
2.1 锕(Ac)元素及其同位素225Ac
2.1.1锕的基本化学性质 Ac是第89号元素,于1899年被法国化学家Andre-Louis Debierne在沥青残渣中首次发现;1902年德国化学家Friedrich Oskar Giesel也独立发现了Ac元素并研究了Ac的化学性质。到目前为止,人们已经发现或人工合成了32种Ac的同位素。在这些同位素中,只有227Ac和228Ac在自然界中存在,它们分别来自235U和232Th的衰变。由于所有Ac的同位素都是放射性的,并且来源有限,因此,人们对Ac的基本性质的了解并不完整。在水溶液中,Ac3+是最稳定的。Ac3+具有与La3+相似的化学性质。在元素周期表中Ac3+是最大的+3价离子。在pH=8.6~10.4之间,可以观察到Ac3+的水解。在Ac的配合物中,金属与配体的键合主要取决于静电相互作用和空间位阻。大离子半径的Ac3+形成动力学不稳定的配合物。Ac3+为硬的路易斯酸,根据软硬酸碱理论,它倾向于与非极化、带负电荷的路易斯碱如氧供体的阴离子配位[1,20]。
2.1.2225Ac的衰变性质和主要来源
1)225Ac的衰变性质
225Ac (T1/2=240 h)是最有前景的治疗放射性核素之一,为α发射体。图1为233U的衰变链。从图1可知,225Ac在衰变过程中释放4个α粒子成为稳定的209Bi。这一连串的α衰变使得225Ac具有强大的细胞杀伤能力。225Ac在最初释放1个α粒子后(Eα=5.79 MeV),紧接着释放2个α粒子(Eα=6.30 MeV和Eα=7.07 MeV),产生短半衰期的中间子体放射性核素221Fr(T1/2=4.9 min)和217At (T1/2=32.6 ms)。217At产生213Bi (T1/2=45.6 min)。213Bi本身就是一种治疗放射性核素。因此,225Ac被视为213Bi的体内发生器。在225Ac的α衰变中,具有4个高的LET(80、75、64、61 keV/μm)。这使得这些α粒子在软组织中的最大射程为85 μm。221Fr和213Bi释放适合于SPECT显像的低/中能γ射线(221Fr:Eγ=218 keV,分支比Iγ=11%;213Bi:Eγ=440 keV,Iγ=26%)。225Ac具有长半衰期,因此,适合用于体内循环缓慢的生物偶联物,如抗体等的研究。但是,目前人们也把它用于体内循环较快的多肽药物的研究中[21]。此外,与213Bi相比,由于多了3个α衰变,因此,225Ac的细胞杀伤力要比213Bi大得多[21]。
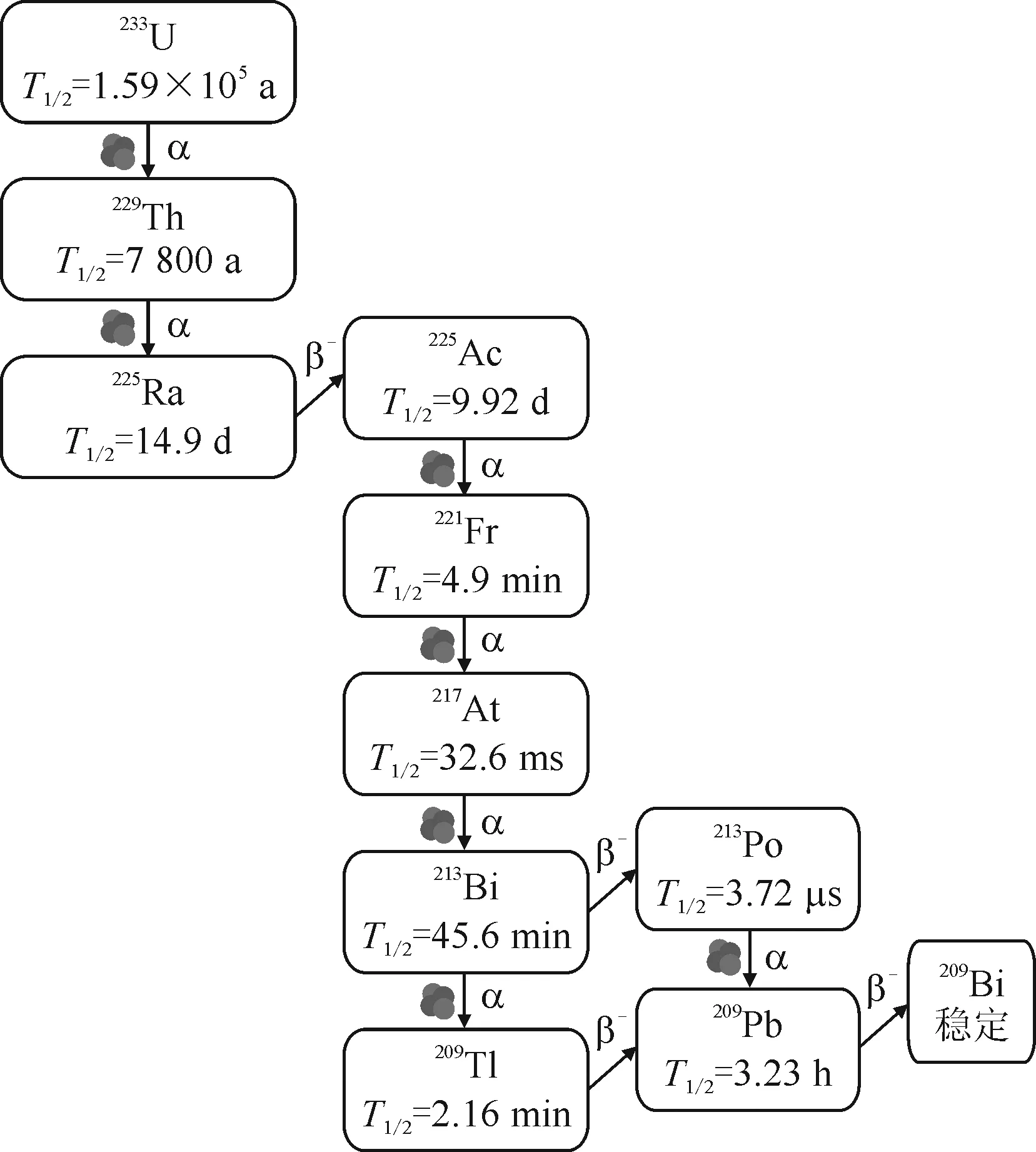
图1 233U的衰变链Fig.1 233U decay chains
2)225Ac的来源
目前,获得225Ac主要有两种途径:一是从229Th中提取获得,二是通过加速器制备。
长期以来,生产225Ac和213Bi的主要过程是通过从233U衰变产生的229Th中进行放射化学提取[22](图1)。至今为止,所有的临床试验和绝大多数临床前试验中所使用的225Ac/213Bi均来自于229Th的衰变。从229Th生产用于临床的225Ac/213Bi仅能从美国橡树岭国家实验室(Oak Ridge National Laboratory, ORNL)、德国卡尔斯鲁厄(Karlsruhe)的欧盟核安全与保障联合研究中心(Directorate for Nuclear Safety and Security of the Joint Research Centre, JRC)及俄罗斯奥布宁斯克(Obninsk)物理和动力工程研究所(Institute of Physics and Power Engineering, IPPE)获得[23-24]。而229Th一直从久置的233U中分离获得。最近,加拿大核实验室也报道了229Th的分离[25]。从1990年代中期起,JRC就向临床研究单位提供了225Ac/213Bi。目前,JRC每年生产约12 987 MBq(351 mCi)的225Ac。ORNL的225Ac的最大年产量约为33 004 MBq(892 mCi)。IPPE每年225Ac的年产量约为22 015 MBq(595 mCi)。但到目前为止,IPPE生产的225Ac在临床中的直接应用未见报道。
225Ac的全球年产量约为66 600 MBq(1 800 mCi)。当使用225Ac药物治疗时,每次的治疗剂量范围为3.996~49.987 MBq(0.108~1.351 mCi)。然而,目前的供应量不能满足在全球医院的广泛使用和常规治疗应用。因此,各种大规模生产225Ac的替代方法正在研究中[26]。
生产225Ac的方法包括用中子、质子、氘核或γ射线辐照226Ra靶以及用高能质子辐照232Th靶和天然铀靶(natU)[26]。在这些方法中,通过232Th的散裂生产225Ac是目前最先进的。该制备工艺的可行性已被美国等多国的研究机构证明[27-28]。2015年,美国能源部通过国家同位素项目促进了布鲁海文(BNL)、洛斯阿拉莫斯(LANL)和橡树岭国家实验室(ORNL)联合研发团队的建立,共同研发225Ac生产的新途径。232Th靶的辐照分别在BNL (200 MeV, 165 μA)和LANL (100 MeV, 275 μA)进行,而辐照后靶的处理和最终产品225Ac的配送由ORNL承担[29]。该生产方法的主要缺点是同时产生了微量(0.1%~0.2%)的长半衰期同位素227Ac(T1/2=21.8 a)。由于225Ac和227Ac不能通过化学方法分离,因此,在临床应用中采用该法制备的225Ac产品时应该考虑227Ac杂质的影响。初步研究表明,227Ac杂质对患者剂量学的影响可以忽略不计[30]。目前,美国这三个实验室组成的研发团队已可以给用户日常提供225Ac产品。现在每次批量为1 850~3 700 MBq(50~100 mCi),在今后4年内,研发团队将把每次批量提高到3 700~37 000 MBq(100~1 000 mCi)。用这种加速器方法制备的225Ac产品已于2020年1月份在美国食品和药品管理局(FDA)备案[31]。
2.2 铋(Bi)元素和其同位素213/212Bi
Bi是第83号元素,为最重的稳定元素。Bi经常被分类为半金属(semi-metal)或准金属(metalloid)。Bi的基态电子构型为[Xe]4f145d106s26p3,通常在形成化学键时,3个6p电子参与成键,而2个6s电子不参与成键(惰性电子对)。因此,在大多数的铋化合物中,Bi的氧化态为+3价。在某些情形下,如一些有机铋化合物中,2个6s电子也参与成键,Bi显示了高氧化态,为+5价[32]。根据软硬酸碱理论,Bi(Ⅲ)为交界路易斯酸。当配位数为6和8时,Bi(Ⅲ)的离子半径分别为1.03 Å(1 Å=0.1 nm)和1.17 Å;而在配位数为6的配合物中,Bi(Ⅴ)的离子半径为0.76 Å。三价铋是最常见和稳定的,在水溶液中Bi(Ⅴ)是强氧化剂。Bi(Ⅲ)在水溶液中容易水解。Bi(Ⅲ)对含氧、氮的多齿配体有高亲和力[33]。但是,Bi(Ⅲ)也倾向于与硫醇盐基团(SR)配位,如配体为半胱氨酸和谷胱甘肽。大多数Bi(Ⅴ)的配合物是五配位的[34]。
1)213Bi
如图1所示,213Bi的半衰期为45.6 min。213Bi衰变的主要途径是先经一次β-衰变产生半衰期仅为3.72 μs的子体213Po;213Po再经一次α衰变产生半衰期为3.23 h的子体209Pb;209Pb最后经β-衰变成为稳定的209Bi。213Bi衰变的另一条途径是先经一次α衰变产生半衰期为2.16 min的子体209Tl;209Tl再经一次β-衰变产生209Pb;最后209Pb经β-衰变成为稳定的209Bi。
213Bi从225Ac/213Bi发生器获得[35]。在225Ac/213Bi发生器中采用AG MP-50阳离子交换树脂。德国卡尔斯鲁厄的JRC研发了一款高活度的发生器。该发生器的225Ac活度可高至4 GBq。该发生器的特点是225Ac的活度在2/3的树脂中均匀分布,使得有机树脂的辐射分解最小化并保证了数周以上发生器的可靠运行。这种发生器已被成功用作2.3 GBq213Bi-P物质类似物的制备,进行脑瘤的局部治疗[36]。
2)212Bi
图2为232Th的衰变链。半衰期很长的天然钍(232Th:T1/2=1.4×1010a)经过一次α衰变产生228Ra(T1/2=5.75 a)。228Ra经过一次β-衰变产生子体228Ac(T1/2=6.15 h)。228Ac再经过一次β-衰变产生228Th (T1/2=1.91 a)。
从图2可知,212Bi是228Th衰变产物的一部分,而且是212Pb衰变的直接子体。212Bi通过两条独立的途径衰变为稳定的208Pb。主要的途径是212Bi发射高能β-(Eβ-=771 keV,Iβ-=64%)先变成212Po(T1/2=0.30 μs),然后再经过一次α衰变(Eα=8 780 keV,Iα=100%)成为208Pb。次要的衰变途径涉及到212Bi先经过一次α发射(Eα,avg=6 210 keV,Iα=36%)产生208Tl(T1/2=3.05 min),随后通过一次高能β-粒子衰变(Eβ-,avg=560 keV,Iβ-=100%)成为208Pb。中间子体208Tl产生的低能γ可以用于显像;然而,208Tl也发射高能、高强度的γ射线(Eγ=2 614 keV,Iγ=99%),因此,对核医学工作人员必须进行更高标准的屏蔽防护。这是在临床应用中212Bi的一个主要缺点[37]。

图2 232Th的衰变链Fig.2 232Th decay chains
212Bi是通过发生器生产的短半衰期放射性同位素。212Bi由半衰期为3.63 d的224Ra获得,而224Ra是半衰期为1.91 a的228Th的子体放射性核素[38]。首先用8 mol/L的硝酸溶解钍,然后把溶解液加到一种阴离子交换树脂上淋洗。该树脂保留硝酸钍阴离子,而淋洗下224Ra以及伴生子体核素。如图2所示,224Ra经过一次α衰变产生220Rn(T1/2=55.6 s)。220Rn再经过两次α衰变产生212Pb(T1/2=10.6 h)。212Pb衰变产生212Bi。将224Ra加载到一种阳离子交换树脂上制备212Bi发生器。采用0.5~2 mol/L HCl或HI淋洗发生器获得212Bi。通过使用较低酸度的酸可以使淋洗液中的212Pb最小化,但是,常常把212Pb和212Bi这两种放射性核素淋洗并标记[39-41]。由于212Bi的子体208Tl发射高能、高强度的γ射线,需要更高标准的辐射防护。这一缺点使得在Bi的放射性核素中,213Bi的应用前景可能更好。
2.3 铅(Pb)元素和其同位素212Pb
铅(Pb)是第82号元素。铅有4种稳定同位素(204Pb、206Pb、207Pb和208Pb)和多种放射性同位素。206Pb、207Pb和208Pb 是天然放射性衰变系的稳定终产物(206Pb来自铀系衰变,207Pb来自锕系衰变,而208Pb来自钍系衰变),因此,铅的同位素组成取决于其地质成因。Pb原子的电子构型为[Xe]4f145d106s26p2。Pb有两种常见的氧化态即Pb(Ⅱ)和Pb(Ⅳ)。在无机化合物中,Pb一般以Pb(Ⅱ)形式存在,而在有机铅化合物中,Pb一般以Pb(Ⅳ)形式存在。Pb(Ⅱ)的稳定性大于Pb(Ⅳ),在环境中Pb一般以Pb(Ⅱ)形式存在。根据软硬酸碱理论,Pb(Ⅱ)属于交界路易斯酸。由于Pb(Ⅱ)的离子半径较大,Pb(Ⅱ)可以形成各种几何构型的配合物。Pb(Ⅱ)配合物的配位数可以是1~12。在水中,Pb(Ⅱ)以水合离子形式存在,估计在内水合层中有9个水分子。当pH约为5,在非常稀的水溶液中(铅离子的总浓度小于10-6mol/L),Pb(Ⅱ)形成[Pb(OH)]+、Pb(OH)2和[Pb(OH)3]-等单核的氢氧配合物[42-43]。
212Pb具有较长的半衰期(T1/2=10.6 h)。它是212Bi的母体核素。如图2所示,212Pb经过一次β-衰变生成子体212Bi,212Bi再通过两条途径继续衰变,最终产生稳定的208Pb。
与212Bi一样,212Pb源自228Th的衰变链,从224Ra(228Th的子体)的发生器获得。在发生器中,采用DOWEX-50×8阳离子交换树脂,在0.01 mol/L HCl中,228Th被吸附到树脂上,用1 mol/L HCl或0.5 mol/L HI淋洗可获得212Pb。为了除去树脂本身辐射分解的副产物,有时需要进行进一步的纯化处理。处理过程是在pH=5的醋酸缓冲溶液中将212Pb加载到Chelex-100树脂上,然后用5 mol/L HNO3淋洗得到212Pb[44]。
2.4 钍(Th)元素和其同位素227Th
Th是第90号元素。它是在自然界中发现的含量最高的放射性元素。Th最常见的同位素是半衰期为1.4×1010a的232Th。232Th是长衰变系中最顶端的元素,通过α衰变,并伴随着γ辐射,其最终衰变产物为稳定的208Pb。大多数的Th是天然的,但是Th的一些同位素可以通过衰变过程在核反应堆中生产[1]。
Th的基态电子构型为6d27s2。在水溶液中,Th唯一稳定的氧化态是Th(Ⅳ)。在pH=7.4(接近生理pH),钍盐水解形成Th(OH)4胶体颗粒。在9配位的环境中,Th(Ⅳ)的离子半径是1.09 Å,为最大的、稳定的四价金属离子。由于Th(Ⅳ)具有最小的电荷与离子半径的比值,因此,与大多数金属离子相比,它的水解性较差,可以在pH≤4的范围内进行研究。水溶液中的Th(Ⅳ)发生多核反应、胶体形成并容易形成碳酸盐配合物。此外,含水的氧化物或氢氧化物是很难溶的[45]。Th(Ⅳ)离子属于路易斯硬酸,可以多种配位数与各种配体形成配合物,已发现的配位数为4~15。Th(Ⅳ)与小配体配位时可以达到很高的配位数[46]。

图3 231Pa的衰变链Fig.3 231Pa decay chains
227Th是铀-锕衰变系的中间产物之一,半衰期为18.72 d。227Th的衰变过程示于图3。如图3所示,经过5次α衰变,最终生成稳定的207Pb[15]。227Th首先经α衰变,放出5.9 MeV的能量,生成半衰期为11.43 d的子体223Ra。223Ra经α衰变,放出5.7 MeV的能量,产生半衰期为3.96 s的子体219Rn。219Rn经α衰变,放出6.8 MeV的能量,生成半衰期为1.78 ms的子体215Po。215Po经α衰变,放出7.4 MeV的能量,生成半衰期为36.1 min的子体211Pb。211Pb为β-发射体,经过衰变后产生半衰期为2.14 min的子体211Bi。211Bi最主要的衰变是通过α衰变,放出6.6 MeV的能量,生成半衰期为4.77 min的207Tl。207Tl最后经过β-衰变产生稳定的207Pb。211Bi另一条次要的衰变途径是先经β-衰变产生半衰期为516 ms的子体211Po。最后211Po经α衰变,放出7.4 MeV的能量,生成终产物207Pb。
在过去的几十年中,227Th主要来源于天然衰变链或使用后储存的核材料。最初获得227Th的方法是将它从天然存在的放射性核素227Ac(半衰期为21.77 a)中分离得到[15],但是用这种方法获得的227Th的量很有限,因为母体核素231Pa(半衰期为32 760 a)衰变生成227Ac的速度很缓慢。现在研发中制备227Th的方法是利用核反应堆、带电粒子加速器和高能加速器进行生产。使用100、200、800 MeV的强质子束流和天然钍靶可以较大规模生产227Th、223Ra、225Ac等核素[47-48]。通过227Ac的β-衰变可以获得大量的227Th。而227Ac可以通过在反应堆中用热中子辐照226Ra来制备。目前,美国橡树岭国家实验室就采用226Ra靶和高通量同位素生产堆生产227Ac。因为227Ac有较长的半衰期(21.77 a),因此,它可以用来生产227Th几十年。
2.5 镭(Ra)元素和其同位素223Ra
Ra是第88号元素,为碱土金属元素,具有高的化学反应性。Ra有33种已知的同位素,没有稳定同位素。最常见的同位素是224Ra(以3.63 d的半衰期经α衰变为220Rn)、226Ra(以1 600 a的半衰期经α衰变为222Rn)和228Ra(它先以5.7 a的半衰期经过两次β-衰变生成228Th,然后再经过两次α衰变生成220Rn)。各种各样的镭同位素由铀和钍的衰变形成,226Ra在238U的衰变系中,而228Ra和224Ra在232Th的衰变系中。Ra以极低的含量存在于几乎所有的水、土壤、岩石、动物和植物中[49]。
Ra的化学性质与Ba非常相似[50]。Ra的电子构型为7s2。Ra2+的离子半径约为1.4 Å。Ra一般形成离子型化合物,不易形成稳定的配合物。
与227Th类似,223Ra是235U(235U先经过一次α衰变产生231Th,再经过一次β-衰变生成231Pa,之后的衰变图如图3所示)的衰变产物。227Th是223Ra的母体核素。227Ac又是227Th的母体核素。因此,可用227Ac/227Th/223Ra发生器系统获得223Ra。223Ra获得途径同227Th。一种方法是从存放很久的天然铀样品中分离获得223Ra,但所获得的223Ra活度低。另一种方法是在反应堆中通过中子辐照226Ra获得223Ra。该法取决于226Ra靶材的多次中子俘获,需要在高通量反应堆中进行。227Ac再经由227Th(半衰期为18.72 d)衰变为223Ra。
3 与α放射性金属核素和生物靶向分子结合的双功能螯合剂
α放射性金属核素本身的辐射毒性很大,要取得治疗肿瘤的良好效果并且对肿瘤周围良性组织的毒副作用最低,TAT药物的靶向性至关重要。
在TAT中,实现药物到肿瘤的靶向有两种策略。第一种策略是利用放射性核素本身内在的分子性质,即放射性核素自然地在肿瘤组织中积聚,从而实现肿瘤靶向。例如,223Ra是与Ca性质很相似的同位素,它与Ca一样被结合到增加骨转换和成骨活性的部位[51-52],但是,具有这样幸运、能自然靶向于肿瘤的α放射性金属核素不多。人们需要精心设计并合成TAT药物。第二种策略是将α放射性金属核素与生物靶向载体,如多肽、单克隆抗体或小分子偶联,这样偶联的放射性药物就能靶向到多种类型的肿瘤[21, 53]。采用双功能螯合剂通过共价连接靶向载体并螯合α放射性金属核素药物的一般结构示于图4。
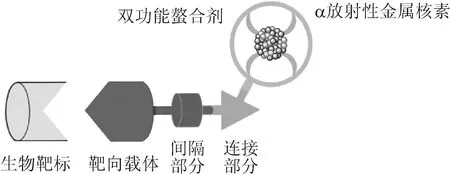
图4 α放射性金属核素靶向药物的一般结构Fig.4 General structure of targeted radiometallic radiopharmaceutical with α emitter
在TAT药物中,双功能螯合剂的作用一方面是与生物靶向载体偶联,另一方面是与α放射性金属离子发生配位反应,生成放射性标记物。对双功能螯合剂的主要要求是:(1) 标记反应快速、定量,具有热力学稳定性;(2) 标记反应的条件温和,如在常温下进行(因为这有利于生物大分子如抗体、蛋白等敏感物质的标记);(3) 生成的标记物配位结构单一、明确,最好无其它配位异构体;(4) 生成的标记物具有动力学稳定性;(5) 生物靶向载体偶联时定量、快速、反应条件温和;(6) 双功能螯合剂易于合成或已有商品。
双功能螯合剂的设计与合成时要充分考虑α放射性金属的化学性质、优先的氧化态和优先的配位数等因素。关于α放射性金属螯合剂已有一些评述[21, 54-55]。到目前为止,虽然许多螯合剂已被合成并被标记研究,但是仅有一小部分的螯合剂被用来标记α放射性金属的靶向分子。在金属放射性药物中使用较为广泛的有代表性的螯合剂示于图5。
在这些螯合剂中,常用来偶联靶向分子的活性基团是与胺基能发生反应形成酰胺键的活性酯,如N-羟基琥珀酰亚胺或四氟苯基酯和能形成硫脲键的异硫氰酸苯酯。在实际标记操作时有两种方法。第一种方法是先用α放射性金属标记双功能螯合剂,然后再与靶向分子偶联。第二种方法是先把双功能螯合剂与靶向分子偶联,然后再用α放射性金属标记。第二种方法一般更为优先,因为该法的标记率更高并且易对连有靶向载体的分子进行表征和靶向结合性质的评价。
DTPA是无环的八齿多胺基多羧酸螯合剂,它通过5个解离的羧酸根中的氧阴离子和3个叔胺基中的氮原子与金属离子进行配位。DTPA是最早用于美国FDA批准的放射性药物([111In]In-DTPA-octreotide)中的一种螯合剂。DTPA类螯合剂能与多种金属离子迅速形成热力学稳定的配合物,但是,其不足之处是大多数DTPA金属螯合物由于在人体内发生放射性金属离子的解离和转络合,因此,放射性标记物的体内稳定性不够好。目前已研发了多种DTPA衍生物的螯合剂,提高了放射性金属标记物的体内稳定性,如1B4M-Bn-NCS等。
在放射性药物化学研究中,DOTA是使用最广泛和最普及的螯合剂。该螯合剂的普及使用是由于DOTA和它的多种类似物已商品化。DOTA是大环多胺基多羧酸螯合剂,当它与金属离子配位时通过大环中的4个叔胺氮和4个臂上的羧酸氧来实现。在美国FDA最近批准的[68Ga]Ga-DOTATATE和[177Lu]Ga-DOTATATE这两种放射性药物中的双功能螯合剂就是DOTA。研究表明,DOTA对于212/213Bi、212Pb和225Ac等α放射性金属离子是合适的双功能螯合剂。
(Me-2,3-HOPO)4-Bn-NCS是一种由4个2,3-HOPO(羟基吡啶酮)官能团构成的八齿双功能螯合剂。它通过羟基氧和酮氧与金属离子进行配位。该螯合剂最适合与硬的、亲氧的金属离子如Th4+形成配合物。在用放射性金属标记时,该螯合剂的优点是在温和的条件下(如常温、温和的pH下)具有快速的标记动力学。
到目前为止,DOTA仍然是225Ac双功能螯合剂的金标准。212/213Bi最常用的双功能螯合剂是CHX-A″-DTPA-Bn-NCS和DOTA。212Pb最常用的双功能螯合剂是TCMC-Bn-NCS。227Th最常用的双功能螯合剂是DOTA和(Me-2, 3-HOPO)4-Bn-NCS。目前还没有找到适合223Ra的双功能螯合剂。
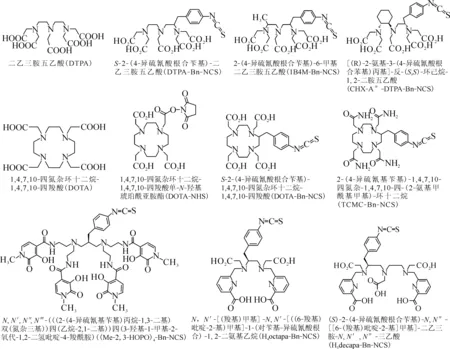
图5 典型的双功能螯合剂的结构Fig.5 Selected representatives of bifunctional chelators
4 TAT药物的研究现状和最新进展
2013年,美国食品药品管理局(FDA)批准了第一种TAT药物,即[223Ra]RaCl2。这也是目前为止已被美国FDA批准并在临床中应用的唯一TAT药物。[223Ra]RaCl2是利用Ra离子与Ca离子的相似性,在药物注射到人体内后能自然地靶向到骨基质的成骨细胞区,因此,它已被用于治疗去势抵抗性前列腺癌并发生骨转移的患者。该药能延长患者的生命[3]。除了前列腺癌以外,该药对其他癌症中的可能用途(如乳腺癌发生的骨转移、骨肉瘤等)正在研究中[56-57]。由于难以找到与223Ra螯合并形成热力学和动力学均稳定的双功能螯合剂,以配合物形式存在的223Ra药物的研究没有明显进展。
近几年来,人们的研究兴趣在于利用225Ac/213Bi、212Pb/212Bi和227Th设计合成各种针对神经内分泌肿瘤、前列腺癌、脑肿瘤、膀胱癌和白血病的TAT药物[13, 21],尤其是以利用核素225Ac/213Bi为主的药物。
4.1 以多肽或小分子为靶向分子的TAT药物
已被用于TAT药物研究中的一些多肽或小分子示于图6。
在神经内分泌肿瘤中,生长抑素受体(somatostatin receptors, SSTR)被过表达。DOTATOC和DOTATATE中分别含有能与SSTR选择性结合的生长抑素类似物多肽。基于此,68Ga标记的DOTATOC和DOTATATE药物已被美国FDA和欧洲药品管理局(EMA)批准上市用于神经内分泌肿瘤的PET显像诊断。此外,177Lu标记的DOTATATE药物也已被美国FDA和欧盟EMA批准上市用于神经内分泌肿瘤的治疗。Kratochwil等[58]用213Bi-DOTATOC研究了25例已用β发射体标记药物90Y-/177Lu-DOTATOC

图6 用于TAT药物中的多肽或小分子Fig.6 Peptides or small molecules in TAT radiopharmaceuticals
治疗但产生了抗药性的病人,结果发现213Bi-DOTATOC的TAT可以产生大量持久的抗肿瘤反应,包括1例病人的完全缓解。血液毒性与药物剂量相关,后续的工作将是对血液毒性和长期的肾毒性进行深入研究。Kratochwil等[59]开展了225Ac-DOTATOC治疗神经内分泌肿瘤患者的研究。结果表明,在39名患者中,2个月内分别给予18.5 MBq的药物,累积剂量为75 MBq时是安全的,并在一些患者中发现了治疗效果。Ballal等[60]研究了已用177Lu-DOTATATE治疗后病情稳定或进展的32名患者,再用225Ac-DOTATATE治疗的情况。结果发现其中15例患者部分缓解,9例患者疾病稳定。中位随访8个月(2~13个月)未发现疾病进展或死亡。
在所有类型的前列腺肿瘤中,前列腺特异性膜抗原(prostate specific membrane antigen, PSMA)被高表达,因此,PSMA成为了前列腺肿瘤显像诊断和治疗的重要靶点。PSMA-617等PSMA小分子抑制剂能与PSMA特异地结合。目前用68Ga/177Lu标记的PSMA-617诊断和治疗药物已进入了临床试验阶段。到目前为止,已有400多名前列腺肿瘤患者用225Ac-PSMA-617进行了治疗,该药物显示了明显的治疗效果,而口干症(口干综合症)被认为是导致10%的患者中止治疗的主要不良反应[61-63]。为了进一步提高治疗效果并减少口干的副作用,Kelly等[64]合成了预期能通过增强与血清白蛋白的结合来增加清除半衰期的药物225Ac-RPS-074并在荷瘤鼠中验证了该药物可提高治疗效果。Sathekge等[65]报道了在去势抵抗性前列腺癌患者中首次使用213Bi-PSMA-617进行治疗的情况。11个月后使用68Ga-PSMA PET/CT重新分期,显示出明显的分子成像响应。此外,患者还表现出生化反应(前列腺特异性抗原(prostate-specific antigen,PSA)水平从237 μg/L降低至43 μg/L)。该研究表明213Bi-PSMA-617适用于临床转化研究,因此,有必要在更大范围的患者群中进行更详细地研究以确定该方法的有效性。
多形性胶质母细胞瘤(GBM)是最常见的恶性脑肿瘤,主要表现为原发性新生,较少表现为继发性神经胶质瘤。GBM过表达NK-1受体。NK-1受体的主要配体为P物质(substance P),因此放射性治疗核素标记的P物质类似物可用作靶向治疗。波兰的Krolicki等[66]研究了213Bi-DOTA-[Thi8,Met(O2)11]-substance P (即213Bi-DOTA-SP) 治疗继发性胶质母细胞瘤的效果。他们发现,当使用活度范围为1.4~9.7 GBq(中位数5.8 GBq)213Bi-DOTA-SP时,治疗耐受性良好,仅出现轻度的短暂不良反应,主要是由于短暂性水肿反应而引起的头痛。开始α治疗后肿瘤无进展的平均生存期和总生存时间分别为5.8个月和16.4个月。首次诊断后的中位总生存时间为52.3个月。
促进肿瘤生长和进展的成纤维细胞活化蛋白(fibroblast activation protein, FAP)在许多人上皮癌(如乳腺癌、结肠癌和胰腺癌等)相关的成纤维细胞中过表达,而在正常器官中为低表达,因此,FAP是肿瘤诊断和治疗的绝佳靶标。近年来,已有多个FAP的小分子抑制剂FAPI(fibroblast activation protein inhibitor)的68Ga显像剂被研发并成功应用于多种肿瘤的PET显像诊断[67]。最近,大阪大学的Watabe等[68]制备了225Ac-FAPI-04并在荷瘤鼠中研究了该药物的治疗作用。他们发现,与对照组相比,225Ac-FAPI-04注射液明显抑制了肿瘤的生长,而治疗后荷瘤鼠的体重没有显著变化。
总的来说,到目前为止以生长抑素类似物为靶向小分子,针对神经内分泌肿瘤的TAT药物研究得最多。研究结果表明,即使对于177Lu-DOTATATE等β治疗药物已产生抗药性、难以治疗的病人,TAT药物仍然是有效的。然而,由于治疗的病人数仍然有限,这些TAT药物的广泛疗效、毒性和长期耐受性,需要在更大的患者群体中进行进一步评估。针对前列腺肿瘤的治疗,虽然以225Ac-PSMA-617为代表的TAT药物的研究起步较晚,因其初步治疗效果令人鼓舞,并且由于具有良好市场前景的预期,这类药物的研发步伐正在加速。
4.2 以单克隆抗体或蛋白为靶向分子的TAT药物
除了以多肽或小分子为靶向分子的TAT药物,以单克隆抗体为靶向分子的TAT药物也在研究中,特别是利用227Th、225Ac 和212Pb等半衰期较长的核素。
目前227Th抗体偶联药物的研究重点是乳腺癌、淋巴癌、肾癌、卵巢癌、急性粒细胞白血病和前列腺癌的新型放射性药物。Dahle等[69]的研究表明,227Th-rituximab(利妥昔单抗)每单位吸收剂量的治疗效果优于90Y-tiuxetan-ibritumomab(Zevalin)或外部射线放疗。227Th-曲妥珠单抗治疗人类表皮生长因子受体2(HER2+)阳性的卵巢癌和乳腺癌的临床前研究显示了令人鼓舞的抗癌作用但没有严重的毒性[70-71]。227Th-PSMA偶联物(PSMA-TTC)在体外和体内均有选择性和强抗癌活性[72]。间皮素(MSLN)靶向的227Th偶联物在体内具有显著的抗肿瘤作用、良好的耐受性并显示出癌细胞活力降低,免疫应答上调[73]。这些研究结果推动227Th偶联药物进入了临床研究阶段。
225Ac标记的抗CD33抗体的临床Ⅰ期试验表明,该药物对急性粒细胞白血病有抗癌作用和安全性[74]。225Ac-lintuzumab(林妥珠单抗)与化疗药物阿糖胞苷(cytarabine)联合使用的Ⅰ/Ⅱ临床试验表明其能导致肿瘤的缓解[75]。采用225Ac-lintuzumab治疗晚期骨髓性白血病的临床试验表明,56%的患者具有治疗响应,而只有中等的副作用[76]。
212Bi与肿瘤特异性抗体标记的药物已有一些研究,与对照组相比,这些药物延长了生命[77-78]。采用212Pb-trastuzumab(曲妥珠单抗)进行了人类表皮生长因子受体2阳性(HER2+)的卵巢癌、结肠癌和胰腺癌治疗的临床Ⅰ期试验,结果表明毒性低[79]。
213Bi标记的抗体对于白血病的治疗具有潜力[78]。依次使用化学疗法(阿糖胞苷(cytarabine)和213Bi-lintuzumab)的Ⅰ/Ⅱ期试验研究证明:该治疗方法具有良好的耐受性并且能够诱导急性粒细胞白血病患者病情的缓解[80]。在一项前瞻性研究中,对12例已对标准疗法有抗药性的膀胱癌患者采用了213Bi标记的抗EGFR药物在膀胱内给药,结果显示了显著的肿瘤缓解作用和低毒性[81]。
以单克隆抗体为靶向分子的TAT药物在多种肿瘤的治疗中已显示了一定的效果。单克隆抗体TAT药物的主要优势在于它对肿瘤细胞上肿瘤相关抗原表位的特异性和亲和力。但是,单克隆抗体TAT药物也有一些缺点,如由于其分子量大,它到达肿瘤靶点的速度慢(通常需要十几小时甚至几天),从血液等正常组织中清除的时间长;容易在肝等正常组织中累积;药物在实体瘤中的渗透性较差、分布不均匀等。由于血液和骨髓中的恶性肿瘤细胞对放射性特别敏感,而且单克隆抗体TAT药物容易接近这些恶性肿瘤细胞,因此,单克隆抗体TAT药物对于血液和骨髓恶性肿瘤的治疗是最有希望的。为了改善实体肿瘤的治疗效果,通过采用小抗体或抗体片段等组成的TAT药物是主要研发趋势。
5 TAT药物研发的挑战和前景展望
2013年获得美国FDA批准的第一种TAT药物([223Ra]RaCl2),也是至今为止唯一的TAT药物,目前已在50多个国家临床应用。尽管在过去的多年中,人们已对其它源于锕系元素的α发射核素(如225Ac、212/213Bi、212Pb和227Th)的放射性药物进行了许多研究,但是这些药物均还处于临床前或临床Ⅰ/Ⅱ期的研究。这些TAT药物治疗肿瘤的初步研究结果令人振奋。然而,目前TAT药物研究存在着一些挑战性的问题。(1) α发射放射性核素的供应短缺。不管是已成药的223Ra核素,还是处于研究中、但已显示很有应用前景的225Ac/213Bi核素均不足以在全球进行常规临床使用。只有美国、德国、加拿大等少数国家能够生产或提供少量的这些核素。经过前几年的部署和努力,美国能源部所属的某些国家实验室已攻克了一系列核素生产和分离的技术难关,能批量生产223Ra和225Ac等核素。我国应当加快和加强TAT药物所需核素制备技术的研究并形成批量生产能力。只有这样才能在我国开展TAT药物的研发并推动未来药物的产业化。(2) 缺乏一些TAT金属核素合适的双功能螯合剂。双功能螯合剂除了需要稳定母体金属核素以外,还需稳定螯合在发生α衰变过程中产生的多个子体的金属核素。这个问题目前仍难以解决。(3) 由于发生α衰变时所产生的反冲能很大,远大于金属核素与双功能螯合剂之间的化学键能。这可能导致TAT药物的脱靶和子体核素在体内的再分布。这些问题有待于深入研究并予以解决。(4) 为了最大程度地降低TAT药物的脱靶毒性,需要研发具有肾脏或肝胆代谢产物的高选择性TAT药物。
由于已有多个TAT药物已处于临床Ⅰ或Ⅱ期的研究阶段,预期新的TAT药物可能在5~10年内获得美国或欧盟药监部门的批准上市。除了针对恶性肿瘤的治疗以外,TAT药物还可能用于诸如病毒、细菌感染等其它疾病的治疗,造福于人类。总之,TAT药物具有良好的应用前景。
致谢:在论文插图的制作中,周旭博士提供了帮助,在此表示衷心的感谢。

