女性类风湿关节炎DNA甲基化特征
彭勇,黄娴倩,张可悦,应颖,褚赞波,吴玉寒,潘迎紫,陈勇
类风湿关节炎(rheumatoid arthritis, RA)是一种慢性的以关节滑膜炎为特征的自身免疫性疾病,可导致关节的进行性破坏,最终导致残疾,全球人群的患病率大约 1%[1]。迄今为止,对于RA的病因及发病机制尚未完全明确,且目前尚无根治方法。临床上治疗的主要目标是控制症状和延缓疾病进展,而现有的治疗方法对部分患者无效[2]。
RA是由环境因素和遗传因素等多种因素导致的一种复杂疾病,其中遗传因素起主要作用,但传统的遗传学并不能完美的解释RA的发病过程。表观遗传是指不涉及DNA序列改变的情况下,基因功能发生可逆、可遗传的改变。DNA甲基化是最早发现的,也是被研究最多的基因表观修饰方式之一。DNA甲基化是指在DNA甲基转移酶(DNA methyItransferases, DNMTs)的作用下,由S-腺苷甲硫氨酸(SAM)提供甲基基团,将CpG岛二核苷酸的胞嘧啶(C)甲基化为5-甲基化胞嘧啶(5-mC)的过程。DNA 甲基化在维持基因组及染色体结构稳定性、基因激活及沉默中具有重要作用。近年来,DNA甲基化在RA的发病、诊断和治疗中的作用已逐步被发现[3]。疾病与候选基因甲基化状态的关联研究受研究者主观因素、基因数量、统计效应等影响,容易遗漏真正的疾病关联基因。本研究通过高通量DNA甲基化基因芯片检测技术(illumina human methylation EPIC BeadChip 850 K)对早期RA患者和健康人群全血的全基因组DNA进行差异甲基化位点分析,筛选出2组差异甲基化位点,根据差异甲基化位点寻找相关差异基因;通过分析相关基因参与的生物学过程、分子功能、细胞组成及信号通路,进一步探索DNA异常甲基化与RA发病机制之间的关系,为DNA甲基化在RA的诊断及治疗方面提供线索和依据。
1 对象与方法
1.1 对象
随机选取2018年6月至2019年8月就诊于中国科学院大学宁波华美医院门诊的12例女性类风湿关节炎患者为RA组。RA组纳入标准:(1)诊断符合2010年 ACR/EULAR 制定的类风湿关节炎分类标准[4];(2)初治(1个月内未接受过糖皮质激素、免疫抑制剂及生物质制的治疗),病程≤6月;(3)疾病处于活动期,RA疾病活动评分:DAS 28评分>3.2。选取年龄及性别配对的体检中心体检的12名健康者作为对照组,无类风湿关节炎家族史。排除标准:两组均排除其他风湿性疾病、癌症、精神病等疾病,且均无血缘关系。本研究已通过中国科学院大学宁波华美医院伦理委员会批准,所有研究对象均签署了知情同意书。
1.2 方法
1.2.1 DNA提取及浓度测定:获取RA组和对照组晨起、空腹8 h以上的外周静脉血2 mL于EDTA抗凝管中,采用QIAamp DNA试剂盒(德国QIAGEN公司)提取全基因组DNA;运用Thermo Nanodrop 2000分光光度仪测定DNA浓度及纯度。检测DNA浓度并记录(OD260/OD280 比值应在 1.8~2.0),-80 ℃保存。
1.2.2 DNA修饰:应用Zymo EZ DNA Methylation Kit试剂盒(美国Zymo公司)对DNA进行亚硫酸盐修饰,使DNA甲基化。
1.2.3 DNA扩增、断裂、杂交:本部分由上海欧意生物医学科技有限公司提供技术支持,完成实验并分析。采用PCR技术扩增后将DNA片段化,片段化的DNA沉淀回溶,采用Illumina Human Methylation EPIC BeadChip 850 K 甲基化基因芯片(美国Infinium公司)进行杂交。应用芯片扫描软件iscan对芯片灰度扫描,扫描结果使用GenomestudioV2011.1(美国 Illumina 公司)进行分析。
1.2.4 原始数据的质控:为确保实验结果的可靠性,实验中对甲基化芯片杂交过程进行了严格的质控分析。对每样品提供12 332个probe作为质控项目,主要包括两部分:(1)sample-independent control:Staining Control、Hybridization Control、Target Removal Contro、Extension Control;(2)sample dependent control: Bisulfite conversion control、Stringency Control、Non-sepecific Binding Control、Non-ploymorphic Control等,结果符合Infinium正常实验的结果,芯片状态正常。
1.3 差异甲基化基因的筛选方法和标准
用于比较的2组DNA都设置3次重复及以上则采用T-Test Model,比较每个基因甲基化位点在RA组与正常对照组间的差异(P<0.05),可获得甲基化水平发生改变的基因位点;再将得到的P值转化为Diff score值[Diff score=10×sgn(βref-βcond) ×log10(P);对照组的Diff score为0],Diff Score取正值代表RA组相对对照组甲基化程度升高,负值相反。设定RA组样本Diffscore值<-13或>13;且Delta_Beta>0.17或<-0.17,即为显著差异甲基化基因;其中Delta_Beta值的计算,即为对照组与RA组Avg_Beta相差的结果,即RA组与对照组在每个位点的甲基化差异程度。
1.4 数据处理
芯片经iSCAN灰度扫描后,应用GenomestudioV2011.1软件行数据转换与数据归一化,可以得到芯片上每个甲基化点非甲基化探针和甲基化探针强度的原始信号值。经过美国Illumina公司提供的方法进一步标准化,得到甲基化点的水平值(Avg-Beta),DetectionPvalue等。
1.5 统计学分析
采用SPSS 18.0统计软件,应用t检验比较每个基因甲基化位点在RA组与正常对照组间的差异。采用R2.15.0统计软件,对差异CpG点进行聚类分析;对差异甲基化点所在的基因作Gene Ontology分析;并采用京都基因和基因百科全书(KEGG)数据库进行Pathway分析。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象基本信息
2组研究对象的基本临床信息,包括性别、年龄、民族、血沉、C反应蛋白、病程、DAS-28评分等见表 1。健康对照组的性别、年龄及民族与RA组基本匹配,且差异均无统计学意义(P>0.05)。
2.2 差异甲基化点分析
RA组与对照组相比,共有24 183个CpG位点甲基化水平发生改变(P<0.05),其中有13 672个高甲基化位点,10 511个低甲基化位点,RA组全基因组的高甲基化位点约占差异性位点的56.5%。进一步根据差异甲基化基因筛选标准,RA组显著差异甲基化位点共191个,其中上调的差异表达基因有106个,下调的差异表达基因有85个(图 1)。191个甲基化位点共对应着115个基因,根据Beta-Difference值大小展示了高甲基化(表2)和低甲基化(表3)程度差异最明显的一些基因位点的信息。通过筛选发现其中15个差异化基因可能与RA相关,其中高甲基化基因如IL-26、PCSK6、MICB、NCF4、GALNT9、PHF19、ACTN1等,低甲基化基因如CYP2E1、SMAD3、SLC1A1、CD44、AGPAT1、KCNQ1、AHRR等。对191个差异甲基化位点进行聚类分析(图2),RA 组和对照组被清晰正确地聚类,说明筛选出的差异甲基化位点有良好的鉴别力。在191个显著差异的甲基化位点中,RA组较对照组存在更多的高甲基化位点,而对照组存在较多低甲基化位点。

表1 RA组与对照组人群的基本信息表Table 1 Basic information of RA group and control group
2.3 Gene Ontology分析
对差异甲基化位点对应的115个基因进行注释分析,通过运用Database for Annotation, Visualiza-tion and Integrated Discovery 6.8(DAVID数据库)对差异甲基化区域的分子功能生物学过程进行富集度分析(Gene Ontology enrichment analysis, GO分析),包括生物学过程、细胞组成以及分子功能,结果按P值排序排列(padj<0.05)。差异甲基化基因参与生物学过程富集于:细胞因子介导的信号通路、炎症反应、核转录因子-κB(NF-κB)信号通路、免疫反应调节、T细胞活化、透明质酸的代谢等方面(图3)。

图 1 RA组中差异甲基化基因火山图Fig 1 Volcano map of differentially methylated genes in RA group
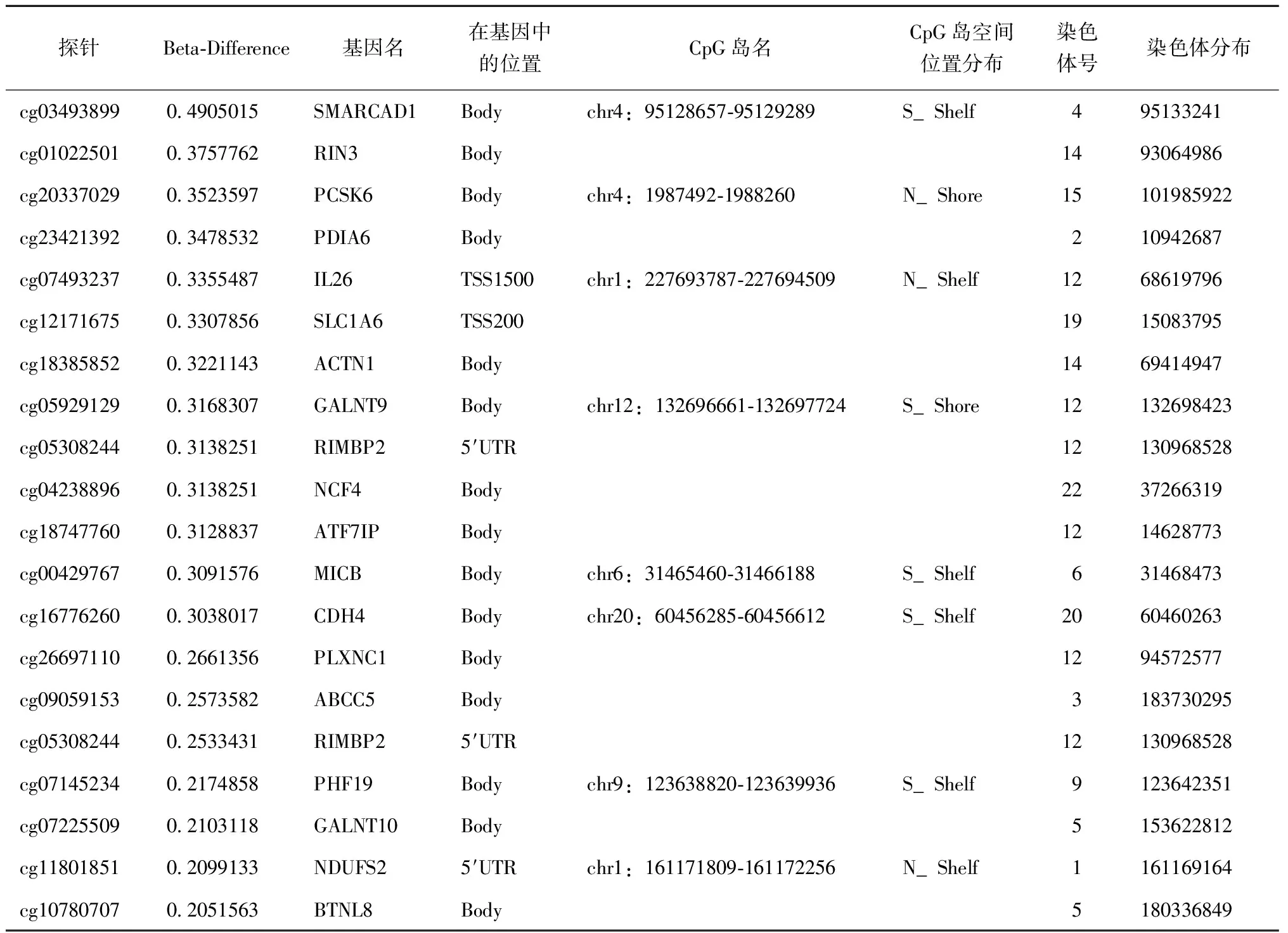
表2 Beta-diff Top 20 高甲基化基因位点Table 2 Beta diff top 20 hypermethylation gene loci
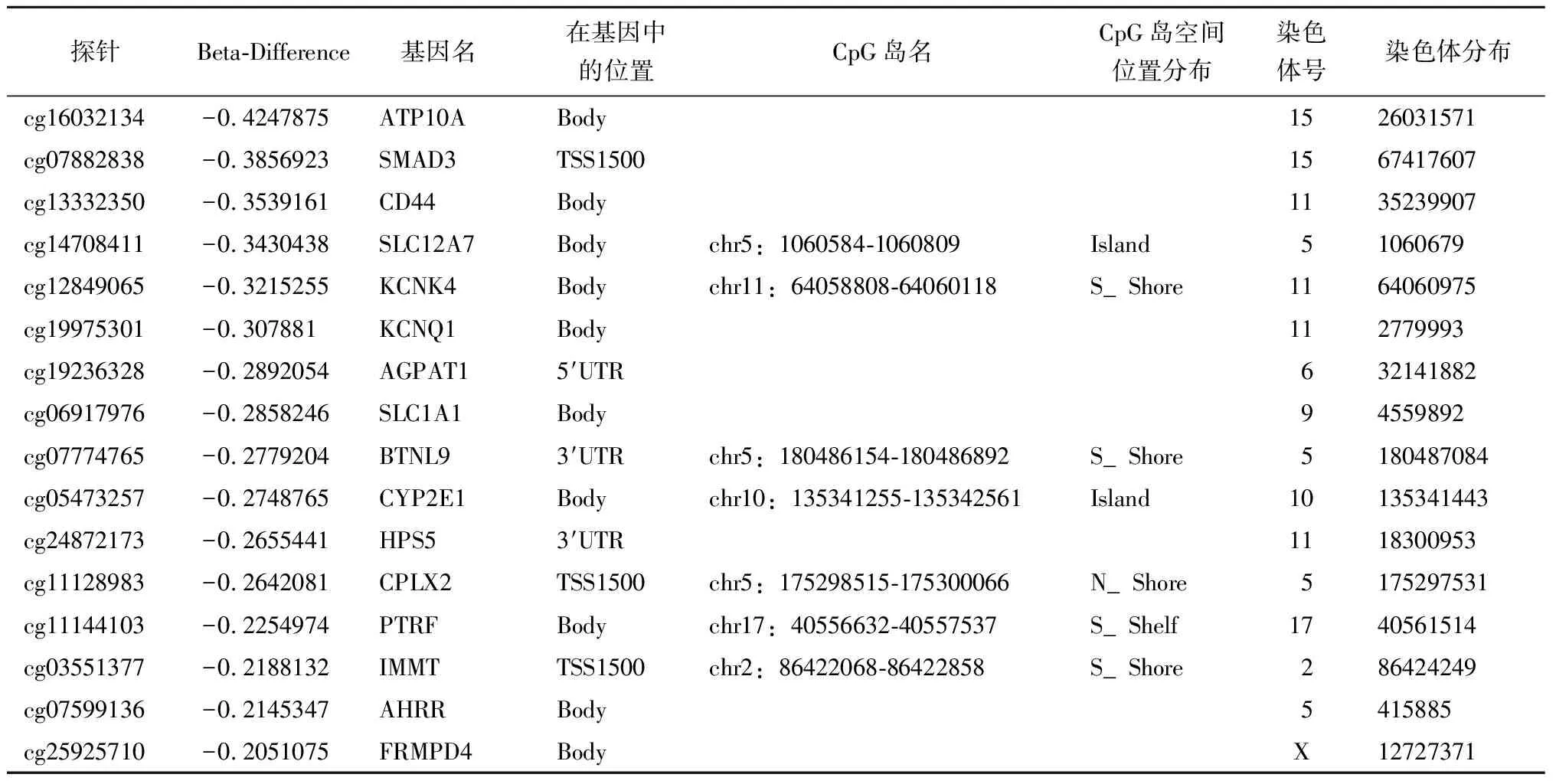
表3 Beta-diff Top 16 低甲基化基因位点Table 3 Beta diff top 16 hypomethylation gene loci

图 2 RA组和对照组191个差异甲基化位点聚类图
2.4 Pathway分析
利用KEGG数据库对差异甲基化位点对应的基因进行Pathway分析,RA组特异的差异甲基化基因与沙门菌感染、Toll样受体信号通路、炎性肠病、NF-κB信号通路、TRP通道的炎性介质调节、趋化因子信号通路、TNF信号通路、破骨细胞分化、系统性红斑狼疮等信号通路有关,共计18个通路具有统计学意义(padj<0.05)(图 4)。
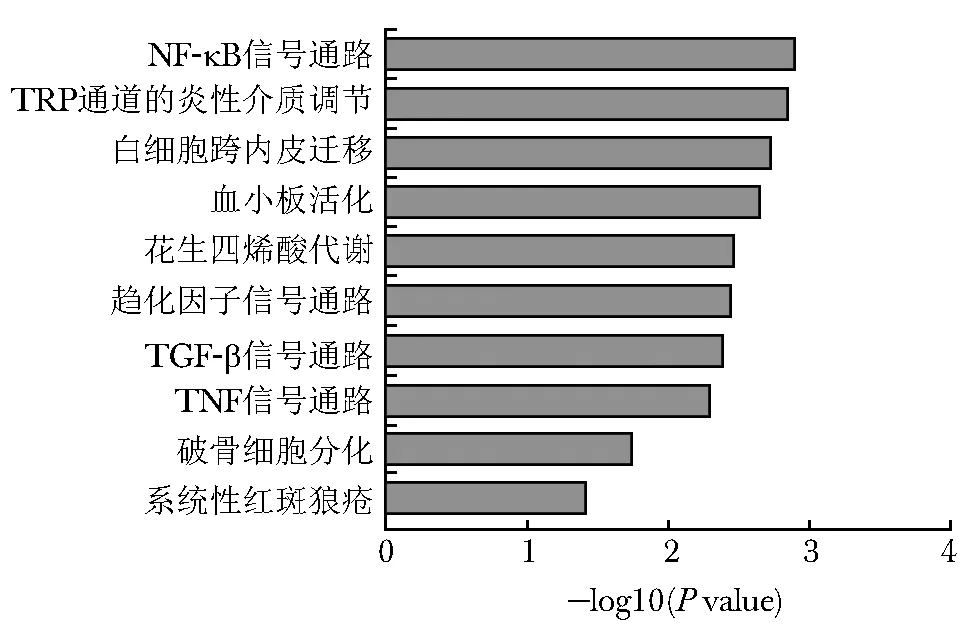
图 4 RA组与对照组差异甲基化基因Pathway分析结果Fig 4 Pathway analysis results of different methylation genes between RA group and control group
3 讨论
DNA甲基化几乎只存在于人类DNA的CpG岛,在人类基因组中大约有30 000个CpG岛;而约60%~70%的基因启动子与CpG岛相关,这表明CpG岛甲基化是基因表达调控的重要组成部分[5]。因此,异常的DNA甲基化可在不改变DNA核苷酸序列的情况下使基因失活及转录抑制。DNA甲基化具有遗传稳定的特性,在经历多次细胞分裂后仍可被稳定地遗传;此外,DNA甲基化也是唯一一种在DNA提取和纯化后仍存在的表观遗传修饰[6];与基因突变相反,DNA甲基化这一表观遗传修饰同时是可逆的。因为这些特征,DNA甲基化是目前被研究的最多的一种表观遗传修饰方式。目前与DNA甲基化相关的疾病包括各种肿瘤、神经系统疾病、心脏疾病及免疫系统疾病[7]。
国内学者发现,RA患者外周血单个核细胞(PBMCs)和RA成纤维样滑膜细胞(RA-FLS)的DNA存在广泛的低甲基化[8],而最新的国外研究则发现,早期RA患者的T-淋巴细胞和B-淋巴细胞中DNA存在广泛的高甲基化[9]。另一些研究表明,RA患者外周血单个核细胞中IL-6基因的启动子甲基化水平明显低于健康对照组,IL-6表达激活将促进关节炎症的发生[10];在RA-FLS中也发现趋化因子配体基因CXCL12的启动子区域存在低甲基化,这将导致RA患者MMPs表达增加以及关节破坏[11];此外,与骨关节炎患者相比,RA患者FCRLA、CCDC88C、BCL11B、APOL6四个基因存在低甲基化和表达下调,而表达下调的CCDC88C基因可通过Wnt信号通路促进RA疾病的进展[12]。笔者前期研究也发现部分候选基因(c-Myc、mTOR、HIF-1α)的低甲基化可能增加RA的发病风险[13],以上研究均表明DNA甲基化可能参与了RA的发病。
本研究发现,RA组与对照组相比DNA甲基化水平存在明显差异,其中RA组全基因组的高甲基化位点约占差异性位点的56.5%。同时发现了15个与RA相关的差异基因,其中高甲基化基因如IL-26、PCSK6、MICB、NCF4、GALNT9、PHF19、ADAMTS4、ACTN1等,低甲基化基因如CYP2E1、SMAD3、SLC1A1、CD44、AGPAT1、KCNQ1、AHRR等。在高甲基化基因中,有文献报道中国汉族类风湿关节炎患者CD4+T细胞中GALNT9基因高甲基化改变[14],这与本研究结果一致。MICB及NCF4的基因多态性参与了RA的发病[15-16]。IL-26基因表达的IL-26属于IL-10家族,RA患者血清中IL-26的浓度高于健康人,RA滑液中IL-26的浓度显著高于RA血清;IL-26可诱导RA患者单核细胞产生促炎细胞因子IL-1β、IL-6和肿瘤坏死因子(TNF-α),同时上调多种趋化因子的表达,还可促进Th17细胞的分化[17]。体外细胞实验证实,IL-26可通过增加RA-FLS中NF-κB受体活化因子配体(RANKL)的表达和直接刺激破骨细胞分化,促进RA破骨细胞的形成[18]。在RA-FLS中前蛋白转化酶枯草溶菌素6 (proprotein convertase subtili-sin/kextin type 6, PCSK6)表达明显增减,PCSK6可通过NF-κB等信号通路,促进RA-FLS的增殖、迁移、侵袭和炎症反应[19];而沉默PCSK6基因可能在RA的发生发展中起保护作用[20]。PHF19、ADAMTS4及ACTN1基因表达产物均参与或促进了RA的发生发展[21]。在低甲基化基因中,Mok等[22]发现RA患者T淋巴细胞CYP2E1基因的启动子区域存在显著的低甲基化,且与RA疾病活动和骨侵蚀相关,这与本研究结果一致。CD44基因表达的CD44蛋白是一种多形性跨膜蛋白,已有研究证实RA患者关节滑膜中存在大量CD44亚型及其配体透明质酸,两者结合可促进RA的滑膜炎症及关节软骨的破坏[23]。KCNQ1和SMAD3的基因多态性则是RA的遗传危险因素[24-25]。此外,转化生长因子β(TGF-β)1/Smads信号通路参与了RA-FLS的迁移和侵袭,促进了关节损伤和病理改变[26]。目前已知吸烟会增加患RA的风险,而吸烟的RA患者AGPAT1基因启动子区存在显著的低甲基化,该基因表达与RA炎症密切相关[27]。吸烟还可增加RA患者滑膜组织中芳香烃受体抑制因子(AHRR)基因的表达[28]。目前对于RA基因甲基化的研究还处于早期,本研究通过检测分析发现15个差异甲基化的基因可能与RA的发生发展密切相关,这将有助于揭示DNA甲基化在RA发病机制中的作用,上述差异甲基化位点对应的基因也有望成为RA发病、疾病进展和疾病严重程度的生物标记物或预测因子。
RA以女性多发,男女患病比例约为1∶3。因此,本研究以女性患者为研究对象,以期了解女性类风湿关节炎患者DNA甲基化的特征。有研究发现,女性RA患者CD4+T细胞中X性染色体上的CD40L启动子区发生了低甲基化,并且发现CD40L mRNA表达上调,而在男性RA患者的CD4+T细胞没有发现这种改变[29];这可以部分解释RA在女性中高发的原因。本研究对象均为女性,发现RA组中存在115个甲基化显著差异的基因,其中X性染色体上存在一个低甲基化基因FRMPD4,深入研究该基因甲基化改变在RA发病中的作用,可能有助于揭示女性更易患RA的遗传背景。
通过GO分析发现差异甲基化的基因参与生物学过程富集于:细胞因子介导的信号通路、炎症反应、NF-κB信号通路、免疫反应调节、T细胞活化、透明质酸的代谢等方面;通过Pathway分析发现差异甲基化的基因与Toll样受体信号通路、炎性肠病、NF-κB信号通路、TRP通道的炎性介质调节、趋化因子信号通路、TNF信号通路、破骨细胞分化、系统性红斑狼疮等信号通路有关。RA是一种以侵蚀性关节炎为主的自身免疫病。免疫细胞如巨噬细胞、T和B淋巴细胞向炎症关节迁移、聚集并活化,同时多种炎症通路如Toll样受体信号通路、NF-κB信号通路等,促使多种促炎细胞因子如IL-1β、IL-6和TNF-α等高表达,促使关节炎症的发生[30]。因此,认为上述差异甲基化基因可促使各种炎症因子产生,诱导免疫细胞的活化,通过多种信号通路导致RA骨质侵蚀及关节破坏,从而参与RA的发病和促进疾病进展。
DNA甲基转移酶(DNMTs)是DNA甲基化的关键酶。有研究证实DNMTs的抑制剂如阿扎胞苷(5′-AZA)可下调RA小鼠FLS的多种炎症因子的表达,从而抑制RA的进展[31]。Svenden等[27]发现传统的抗风湿药物(如甲氨蝶呤)可以诱导RA炎症相关基因AGPAT1启动子的低甲基化区域逆转为高甲基化。总之,DNA的异常甲基化参与了RA的发病过程,而抑制DNA异常甲基化可能可以抑制RA发生及发展。因此,笔者推测这些差异基因可能成为RA治疗的潜在靶点。
本研究不足之处:首先选取的样本量较少,且仅选了女性作为研究对象,设计存在一定的局限性;其次,仅对差异化甲基基因进行了分析,未对相关基因表达水平进行测定及验证;在今后的研究中,笔者将扩大样本量进行研究,同时对这些基因所表达的mRNA和蛋白质进行分析,对相关基因进行深入验证,从而为探讨DNA甲基化在RA发生发展中及治疗中的作用提供依据。