青斑样血管病发病机制
高祎濛,晋红中
青斑样血管病(livedoid vasculopathy, LV)由Milian于1929年首次报道,本病病名多样,既往曾被称为青斑样血管炎、节段型透明变性血管炎、下肢网状疼痛性紫癜性溃疡、网状青斑伴夏季溃疡等。该病临床表现易与变应性皮肤血管炎、淤积性皮炎等相混淆,主要表现为累及双侧小腿中下部、足踝部、足背伸侧的慢性复发性红斑、紫癜及疼痛性溃疡,皮肤溃疡愈后形成瓷白色卫星状萎缩性瘢痕,局部还可出现毛细血管扩张与色素沉着等表现。该病目前发病机制及病因不清,尚无特效治疗方法,严重影响患者生活质量,现将其发病机制的相关研究进展综述如下。
1 高凝易栓因素
正常生理情况下,血小板、凝血与抗凝系统、纤维蛋白溶解系统共同参与生理性止血和异常血凝块、血栓的清除,它们共同作用维持动态平衡,从而保证正常的血液循环。Hairston等[1]的回顾性研究表明在45例LV患者的皮损组织病理学检查中44例患者均出现真皮血管管腔内血栓形成改变,且实验室检查发现多种遗传性与获得性的凝血功能异常,为LV的发病涉及高凝易栓因素提供依据。同时结合临床治疗经验,抗凝血药物是目前最常应用于治疗LV的药物[2],并且取得一定疗效,进一步提示血液高凝易栓因素与LV的发病密切相关。LV病因及机制复杂,不一定是单纯继发于凝血功能紊乱,潜在的引起凝血功能异常原因是多种多样的。
1.1 血小板
血小板在机体止血、血栓形成中发挥重要作用,特别是初期阶段,血管内皮损伤胶原纤维暴露诱导血小板的黏附、聚集与活化,并分泌产生血栓素等促进血小板凝聚、血管收缩[3]。有病例报道LV患者同时合并黏性血小板综合征(sticky platelets ayndrome, SPE)[4],SPE是一种常染色体遗传性疾病,在受到二磷酸腺苷和(或)肾上腺素刺激的情况下血小板表现出高聚性,体外血小板聚集实验可以辅助诊断SPE,但SPE的常见临床表现以动静脉血栓形成为主[5],LV合并SPE病例提示血小板高聚性引起血液高凝易栓状态,证实异常的血小板功能参与LV的发病。此外,在LV患者中检测到血小板P选择素表达水平增加[6],高表达的血小板P选择素反映血小板活性增加的活化状态,有研究表明血小板P选择素通过与抗P选择素糖蛋白配体-1结合,促进中性粒细胞胞外陷阱的释放诱导血栓前信号通路[7],同时血小板-单核细胞聚集物也可以反应血小板的活化状态[8],血小板-单核细胞聚集物水平升高可能会增加血栓性事件的风险[9],推测这些可能与LV的发病机制相关。
1.2 凝血与抗凝系统
1.2.1 凝血因子:凝血因子Ⅷ、Ⅸ活性增加、凝血因子V的Leiden突变(factor V leiden, FVL)均有报道参与LV的发病[10-11]。正常生理情况下,活化蛋白C(activated protein C, APC)可以抑制活化的凝血因子Ⅴ、Ⅷ,FVL点突变引起的APC抵抗,导致血栓形成。FVL是常见的易栓症原因,据统计由它引起静脉血栓形成的风险大约增加7倍[12],在美国LV患者进行的相关凝血筛查中约有22.2%的患者合并FVL[1],而在中国台湾的56例LV患者中均未检测到相应的FVL[13]。受人种因素、遗传背景等影响,针对亚洲人群FVL筛查结果显示,印度人群表现出相对更高的FLV突变率(10.74%),而中国与马来西亚人群筛查发现FVL突变人数分别占检测人群的0.36%与1.83%[14]。
1.2.2 凝血酶原:Gotlib等[15]于2003年首次报道一例伴杂合型凝血酶原G20210A基因突变的LV病例。凝血酶原基因在20210位点出现单核苷酸改变,原有的鸟嘌呤被腺嘌呤替换,构成凝血酶原G20210A基因突变。研究表明87%携带G20210A等位基因的个体具有较高表达水平的血浆凝血酶原,这一基因型的存在增加3倍静脉血栓形成的风险[16],在18%静脉血栓形成的患者中出现凝血酶原G20210A基因突变,而正常健康对照人群中仅有1%携带G20210A等位基因[16]。除凝血酶原G20210A基因突变外,凝血酶原A19911G基因多态性改变同样作为静脉血栓形成的危险因素,可以引起凝血酶原活性轻度升高[17],但目前尚没有LV合并凝血酶原A19911G基因多态性改变的报道。
1.2.3 抗凝物质:为保证血液循环稳态,机体内还存在着抗凝系统,通过灭活凝血因子及相关的酶类,维持凝血、止血与血栓形成的平衡,主要的自身抗凝物质包括抗凝血酶III、蛋白C、蛋白S等,蛋白S是蛋白C的一种辅助因子,通过协同APC作用,结合形成APC-蛋白S复合物使凝血因子Ⅴ、Ⅷ等灭活。有多中心研究结果发现,与蛋白C、蛋白S缺陷或缺乏相比,在LV患者中抗凝血酶III异常诱发血液高凝状态相对更为多见[18]。国外有报道LV患者的蛋白S活性下降,但蛋白S抗原水平在正常值范围内,经蛋白S-alpha基因测序分析后发现存在由蛋白S基因的Tokushima突变所致的遗传性蛋白S缺乏[19],国内张钰等[20]也曾检测到伴蛋白S的PROS1基因p.S501F突变的LV。
1.3 纤维蛋白溶解系统
纤维蛋白溶解系统简称纤溶系统,由纤溶酶、纤溶酶原、纤溶酶原激活物、纤溶酶原激活物抑制剂等组成,包括纤溶酶原激活与纤维蛋白溶解两个过程,这一系统主要参与纤维蛋白分解液化、血栓形成后血管再通。已有研究在LV患者中发现以低水平的组织型纤溶酶原激活物为表现的纤维蛋白溶解系统紊乱[21]。近年来纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-1)在LV发病机制中的作用逐渐引起人们重视,PAI-1通过与纤溶酶原激活物特异性结合形成复合物,从而抑制纤维蛋白溶解系统的激活,增加血栓形成的风险。PAI-1基因位于人7号常染色体,在PAI-1启动子-675区域存在由单个鸟苷酸插入或缺失引起的4G/5G基因多态性[22],这一基因多态性会影响PAI-1的表达水平及活性。前期测序结果与分子生物学研究表明,纯合的4G/4G基因型中PAI-1表达活性最高,4G/5G、5G/5G基因型中PAI-1表达活性依次减低,4G/4G与5G/5G基因型相比PAI-1表达活性大约高出25%[23]。在国外开展的LV患者PAI-1基因4G/5G基因多态性研究中,受试者中25%表现为4G/4G基因型,大约超过一半的患者表现为4G/5G基因型[24],但部分中国台湾LV患者的PAI-1基因4G/5G多态性并没有表现出显著差异[13],可能是由于基因表型的多态性受到人种等遗传学背景因素的影响所致。除PAI-1基因4G/5G多态性,PAI-1的表达水平增加也已在LV患者的血浆与皮损组织中证实,Agirbasli等[24]在20例LV患者中检测到显著升高的PAI-1抗原、中度升高的PAI-1活性水平,免疫组化染色提示PAI-1主要集中在真皮的细胞外基质与血管周围区域,并且后续研究发现在14例LV患者皮损区域PAI-1的mRNA表达水平明显增加[25]。PAI-1经16 h暴露于室温后,LV患者剩余PAI-1活性水平较正常健康对照人群高,提示PAI-1稳定性增加可能参与LV的发病机制[24]。
2 代谢因素
2.1 同型半胱氨酸
同型半胱氨酸属于含硫氨基酸,是由饮食摄入的蛋氨酸甲基化后代谢产生,后者及其代谢产物对血管内皮细胞有一定毒性作用,高同型半胱氨酸血症是一种血栓前状态,同时也作为心血管疾病、动静脉血栓形成的高危因素[26]。引起高同型半胱氨酸血症的原因很多,目前已有的研究发现在合并高同型半胱氨酸血症的LV患者中主要是由于编码参与其代谢过程的酶的基因产生突变所致,其中包括亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase, MTHFR)的MTHFR-C677T、MTHFR-A1298C基因多态性。MTHFR-C677T基因多态性是由于677位点的单核苷酸点突变引起第222号密码子翻译产物由缬氨酸转变为丙氨酸所致,这一基因多态性导致MTHFR的活性减低[26]。MTHFR涉及叶酸代谢过程,为核苷酸、蛋白质甲基化等细胞新陈代谢所必需,同型半胱氨酸的代谢也需要叶酸、维生素B12的参与[27]。Marsch等[28]分别对合并及不合并高同型半胱氨酸血症的LV患者分组进行MTHFR-C677T、MTHFR-A1298C基因多态性检测,其中16例合并高同型半胱氨酸血症的LV患者中12例(75%)出现引起MTHFR的活性减低的基因改变,而在9例不合并高同型半胱氨酸血症的LV患者中仅5例(56%)发生类似MTHFR基因改变。数个病例报道合并高同型半胱氨酸血症及杂合型MTHFR-C677T的LV患者对常规治疗药物效果不佳,但外源性补充叶酸、维生素B6、维生素B12后皮损明显改善[29]。在心血管疾病患者中,MTHFR-C677T的TT基因型较CC基因型表现出更高的同型半胱氨酸水平[30],但在我国台湾进行的MTHFR基因多态性研究中,LV患者主要是以MTHFR-C677T的CC基因型为主,MTHFR-A1298C基因在中国台湾LV患者中未表现出显著差异[13]。
2.2 脂蛋白a
脂蛋白a [Lipoprotein(a),Lp(a)]主要由肝脏合成分泌,结构是由一个富含胆固醇的低密度脂蛋白通过二硫键与载脂蛋白B100及载脂蛋白a链接构成[31],作为一种血浆脂蛋白,它参与皮肤伤口愈合的过程。前期流行病学研究表明大于600mg/L的Lp(a)是动脉粥样硬化、心血管疾病等重要的独立危险因素,提示着动脉粥样硬化性疾病的不良预后[32],并且Lp(a)也是高凝状态的相关因素[33]。LV本质上是一种血栓闭塞性脉管疾病,其患者血浆、皮损组织中发现类似的Lp(a)表达水平升高,其中通过免疫组化染色法检测LV皮损组织中Lp(a)表达水平较正常对照组织升高10倍,但Lp(a)在皮损组织与血浆中的表达水平缺乏显著的相关性[34-35]。Lp(a)水平随治疗反应也出现波动,有研究报道在应用达那唑治疗后LV患者皮损及疼痛改善的同时,Lp(a)水平较治疗前出现70%的下降[36]。Lp(a)在LV发病机制中的作用可能与其结构和纤溶酶原具有同源性,通过竞争性的发挥抗纤维蛋白溶解的作用,同时改变并调节血管内皮细胞的功能,诱发免疫反应,产生自身免疫性抗体,导致血栓形成的风险增加[37]。此外Criado等[37]还推测与Lp(a)的相互作用可能是引起PAI-1活性及稳定性增加,进一步增强抗纤溶作用的原因,并建立Lp(a)是否作为桥梁连接LV发病机制中炎症反应与血栓闭塞的猜想。
3 炎症和免疫因素
炎症因素在LV发病中的作用推测可能划分为2个方面,一方面LV疾病发生发展过程中除起到主要作用的血栓形成、血管腔闭塞外,可能伴随着一个与之平行的、潜在的炎症反应过程;另一方面炎症性因素与凝血机制密切相关,多种炎症细胞因子通过与凝血机制产生交联,促进真皮血管内血栓形成从而导致LV的发病。LV皮损直接免疫荧光检查在血管周围可以见到纤维蛋白、补体、免疫球蛋白M及其他免疫球蛋白复合物的沉积[1],且部分LV病例同时合并自身免疫性疾病,如干燥综合征、抗磷脂抗体综合征等,甚至早期有学者提出猜想LV是否为系统性免疫性疾病的皮肤表现[38-39]。其中特别是中国的LV患者,在中国LV好发于青年女性,有回顾性研究分析中国24例LV患者免疫学检查结果,发现中国LV患者抗磷脂抗体阳性率较高,约为58.3%[40]。目前应用人免疫球蛋白方案治疗LV的理论基础推测除了抗炎作用外,可能与人免疫球蛋白中和抗心磷脂抗体,抑制血小板聚集,调节血管内皮细胞功能等作用有关[41]。作为引起易栓症的常见原因,抗心磷脂抗体、抗β2糖蛋白1抗体、狼疮抗凝物等自身免疫性抗体会增加机体形成动静脉血栓的风险,但是这些自身免疫性抗体是单一通过促进血液高凝易栓状态发展参与LV发病,还是存在其他未知的自身免疫反应机制诱发皮肤、血管改变,有待进一步研究探讨。
3.1 可能的潜在炎症反应
Lee等[42]的病例系列研究发现单一应用己酮可可碱或阿司匹林治疗的LV患者并不能取得很显著的效果,多数患者后续还需要糖皮质激素、秋水仙碱、硫唑嘌呤等药物控制疾病的活动,而抗血栓药物与免疫抑制剂的联合治疗LV疗效可能更好。Yong等[11]的观点是尽管目前认为高凝血栓性因素在LV发病中起到重要作用,但部分患者在疾病的初始活动阶段还需要强效的免疫抑制剂来控制病情发展,因此推测在疾病发展过程中可能存在一个伴随的炎症反应过程。
治疗方面有个案报道应用利妥昔单抗、阿达木单抗等治疗顽固性LV病例取得良好效果[43-44],本课题组前期应用依那西普治疗难治性LV患者对疼痛、皮损及患者生活质量有不同程度改善[45],由此推测LV的发病可能与B淋巴细胞的激活和肿瘤坏死因子(tumor necrosis factor, TNF)-α等参与的炎症反应有关。Papi等[6]对8例LV患者、20例皮肤小血管炎患者及20例健康对照患者进行外周血炎症细胞因子检测,发现在LV患者和皮肤小血管炎患者中白介素(interleukin, IL)-2、可溶性IL-2受体水平较正常对照人群明显升高,IL-1β、肿瘤坏死因子(tumor necrosis factor, TNF)-alpha、IL-8水平仅在皮肤小血管炎患者中升高,血小板P选择素水平仅在LV患者中升高,提出猜想血小板、淋巴细胞的激活及它们与血管内皮细胞间的交互作用可能在疾病发生发展过程中发挥重要作用,但其具体的作用机制还尚未明确。
3.2 炎症因素与凝血的相互作用
炎症反应与凝血通路的密切关联与相互作用已逐渐被证实,炎症细胞因子可以通过作用于血管内皮细胞、血小板等,凝血因子等也可以通过趋化炎症细胞的聚集、炎症细胞因子的释放而进一步促进该炎症反应过程。既往研究发现,炎症细胞因子可以通过改变血小板的数量、功能影响凝血通路,血小板数量与血浆IL-1β浓度呈正相关,由P-选择素表达诱导的血小板脱颗粒能力也与IL-1β、IL-6水平相关[46]。此外TNF-alpha也具备促进血小板激活与聚集的作用,TNF-alpha还可以引起血浆蛋白的沉积物覆盖在红细胞上,暴露伪足进一步与血小板相互作用[47]。有研究指出IL-17与TNF-alpha具有协同作用,共同作用于血管内皮细胞和血管壁,可以引起凝血、增加血小板聚集,导致血栓形成[48]。蛋白酶激活受体(protease activated receptors,PAR)可以协调局部凝血和血管损伤炎症反应,位于血管内皮细胞的PAR1受到凝血酶激活后,促进炎症细胞因子如IL-1、IL-6、IL-8和单核细胞趋化蛋白-1等的释放,诱导血管黏附分子如P选择素、细胞间黏附分子-1 的聚集,引起白细胞外渗;同时,PAR1的激活也会引起血管性血友病因子的表达和血浆蛋白的渗出,通过血小板黏附和血浆凝血因子与血管内皮下组织因子的接触,间接促进血栓的形成[49]。还有观点认为炎症细胞因子影响血栓性疾病的进程及预后,在弥散性血管内凝血的患者中检测到IL-6、IL-8、IL-10、TNF-alpha表达水平升高,结合炎症指标可以更好的预测弥散性血管内凝血的发病、严重程度及临床预后[49]。高水平的IL-18和超敏C反应蛋白提示踝关节骨折患者远期下肢深静脉血栓形成风险增高[50]。
4 结语
LV作为一种病因尚不明确的慢性复发性皮肤疾病,其可能的发病机制主要涉及高凝易栓因素,炎症、代谢、免疫因素也可能与之产生交联发挥作用(图1)。因此对于临床、皮肤组织病理确诊LV的患者,完善凝血功能、易栓症等可能的原因筛查对于明确潜在病因、是否存在系统性合并疾病及指导后续治疗有一定意义。本文通过LV病因及其发病机制的综述,可以为LV的研究、诊断、治疗提供新的思路与靶点,相信随着后续研究的不断深入,进一步为LV的治疗和控制引入新的方法,不断改善患者的生活质量。
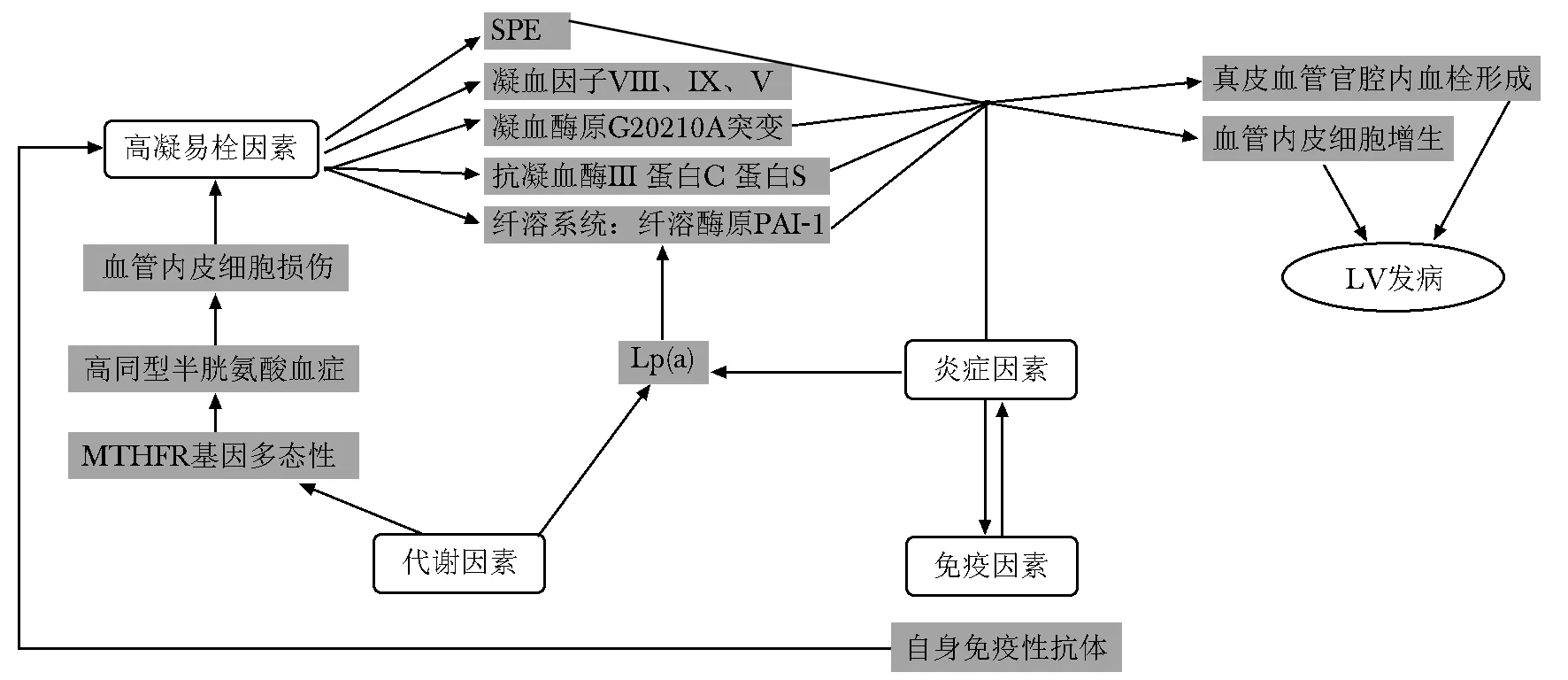
图 1 高凝易栓因素、代谢因素、炎症和免疫因素在LV发病中的关联示意图