基于电活性铁氰化镍和金属模拟酶协同催化的蛋白质电化学检测
张丽娜,谢西月,柴雅琴*
(1.晋城职业技术学院,山西 晋城 048026;2.西南大学 化学化工学院,重庆 400715)
癌症是威胁人类健康的重要疾病之一,临床研究发现甲胎蛋白(α-Fetoprotein,AFP)在肝癌、大肠癌、胃癌、胰腺癌等癌症患者血清中的浓度高于正常值(25 ng/mL)[1],而且患者血清中AFP的浓度变化与病情发展变化有一定的关系,因此AFP作为一种广谱性的肿瘤标志物,对于临床工作者在诊断病情、监测治疗以及预后效果等方面有一定的辅助作用。由于癌症患者体内AFP浓度较低,因此实现AFP的超灵敏检测是一项巨大的挑战。迄今为止,常见的AFP检测方法有酶联免疫法[2]、荧光免疫法[3]、化学发光免疫法[4]以及电化学免疫法[5]等。在众多的检测方法中,构建具有分析时间短、灵敏度高、特异性强、成本低、可微型化等众多优点的电化学免疫检测法一直是生物分析检测领域的研究热点之一[6]。
生物酶作为一类具有催化活性的蛋白质,在催化反应过程中表现出高效、专一的特性。然而传统生物酶易受温度、pH值等环境因素的影响,且存在成本昂贵、易失活变性、生物体内含量低等缺点,限制了其实际应用。近年来,具有生物酶性质的人工纳米模拟酶受到了广泛关注[7]。纳米酶具有成本低、稳定性高、催化性能相对稳定等优点。此外,纳米模拟酶本身作为一种纳米材料,赋予其固有的比表面积大,特殊的光、电等物理化学性能等,因此纳米酶在生物传感、分子检测和疾病诊断等领域具有广阔的应用前景。目前为止,已经发现的纳米材料模拟酶包括贵金属纳米粒子、金属氧化物、碳纳米管、氧化石墨烯等,其应用涉及到抗原、葡萄糖、DNA、细胞等多种目标物的检测,并展现出色的分析性能[8-11]。其中贵金属纳米材料因其表面含有丰富的活性位点、较强的催化活性和良好的生物相容性等特性引起了研究人员的兴趣[12]。而将具有催化活性的贵金属纳米材料引入生物传感领域,发挥其卓越的催化性能对于构建传感性能优异的电化学传感器具有重要意义。
本文以具有优异电化学活性的铁氰化镍(NiHCFNPs)为电活性物质[13],利用传统夹心反应模式固载二抗,结合空心纳米金(HAuNPs)和铂钯纳米颗粒(PtPdNPs)的协同催化在电极上产生不溶性沉淀阻碍电子传递[14],构建了一种超灵敏的“signal-off”型电化学免疫传感器。如图1所示,首先,在空心纳米金的表面通过半胱氨酸(L-Cys)作为连接剂固载铂钯纳米粒子,并将其作为二抗(Ab2)纳米载体。同时该复合纳米材料表现出良好的H2O2催化性能,具有大比表面积的空心纳米金既能充当载体固载更多的辣根过氧化物模拟酶铂钯纳米粒子,也可作为过氧化物模拟酶展现出极佳协同催化能力。其次,将NiHCFNPs通过静电相互作用修饰到沉积金电极上作为电活性基底,然后在电极上沉积金用于捕获抗体(Ab1)。基于夹心免疫模式,将具有辣根过氧化物酶活性的二抗耦合物HAuNPs-PtPdNPs-Ab2固载到修饰电极表面,在H2O2存在下催化4-氯-1-萘酚(4-CN)的氧化,并在铁氰化镍修饰的电极上生成大量不溶且不导电沉淀苯并-4-氯己二烯酮(4-CD),有效地阻碍了电极表面的电子传递,得到急剧下降的电信号。随着AFP的增加,电极上捕获的HAuNPs-PtPdNPs-Ab2的量增多,在电极表面产生的4-CD沉淀导致NiHCFNPs修饰的传感平台电化学响应受到抑制,实现了构建“signal-off”型传感器对AFP的灵敏检测。制备的传感器具有良好的协同催化作用,通过提供一种多重信号放大的有效方法,体现出对AFP的良好灵敏度。
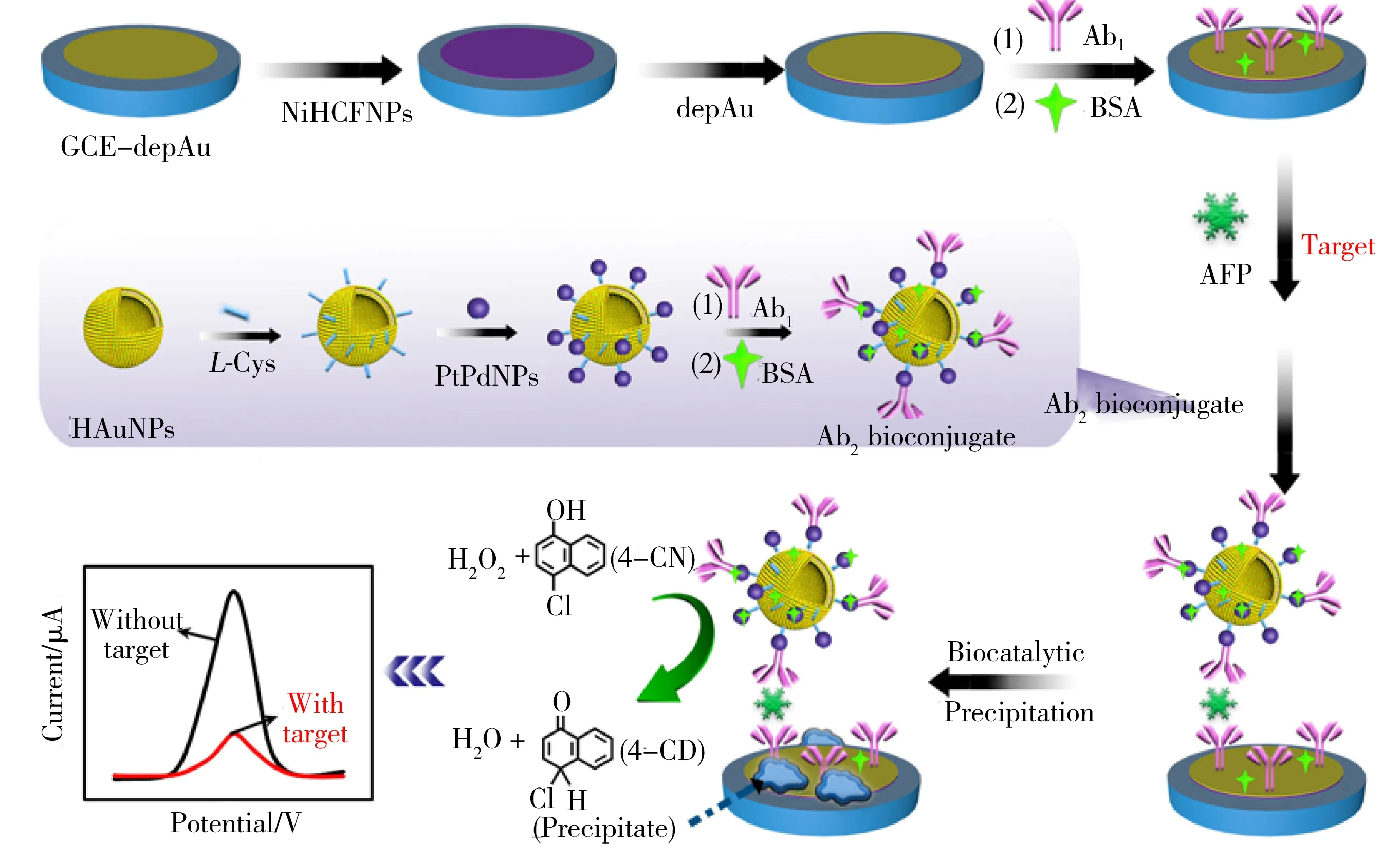
图1 免疫传感器的制备流程Fig.1 Schematic diagram of the immunosensor preparation process
1 实验部分
1.1 试剂与仪器
氯金酸(HAuCl4,Au含量 40%~44% )、四氯钯酸钾(K2PdCl4,≥ 99%)、氯铂酸(H2PtCl6,Pt含量≥ 37.5%)、牛血清白蛋白(BSA)、十六烷基三甲基溴化铵(CTAB,≥ 99%)、抗坏血酸(AA,≥ 99%)、柠檬酸三钠(Na3C6H5O7·2H2O,≥ 98%)、过氧化氢(H2O2,≥ 30%)、4-氯-1-萘酚(4-CN,≥ 99%)购于美国Sigma公司;铁氰化钾(K3Fe(CN)6,≥ 99%)、氯化镍(NiCl2·6H2O,≥ 99%)、氯化钴(CoCl2·6H2O,≥ 98%)、氯化钾(KCl,分析纯)购于成都科隆化学公司;甲胎蛋白(AFP)购于郑州博赛生物试剂公司。实验用水均为去离子水。
CHI 660D电化学工作站(上海辰华仪器有限公司),H600透射电子显微镜(日本日立有限公司)。电化学工作站采用传统的三电极体系:玻碳电极(GCE)及其修饰电极为工作电极,铂丝为对电极,饱和甘汞电极为参比电极。
1.2 铁氰化镍纳米粒子(NiHCFNPs)的制备
根据文献合成NiHCFNPs纳米粒子[15-16]:首先配制含有0.05 mol/L KCl和0.05 mol/L K3Fe(CN)6的混合溶液;取70 mL混合溶液剧烈搅拌,逐滴滴加70 mL 0.01 mol/L NiCl2溶液后,剧烈搅拌5 min。然后高速离心分离并将固体洗涤3次,转到真空干燥箱中干燥10 h。最后将得到的黄色粉末NiHCFNPs分散在PBS溶液中,置于4 ℃冰箱中留存待用。
1.3 二抗耦合物HAuNPs-PtPdNPs-Ab2的制备
空心纳米金HAuNPs的制备参考文献[17]:在N2氛围下持续搅拌,以1 min的时间间隔将200 μL Na3C6H5O7·2H2O溶液(0.1 mol/L)、200 μL新制的NaBH4溶液(1.0 mol/L)、50 μL CoCl2·6H2O(0.5 mol/L)依次加入到50 mL水中。1 h后逐滴缓慢加入150 μL HAuCl4(0.1 mol/L)搅拌15 min,随后在空气中反应30 min直至溶液呈深蓝色后,离心并洗涤得到沉淀,然后用2 mL水分散保存备用。
PtPdNPs的制备参考文献方法[18]:将200 μL 2 mmol/L K2PdCl4溶液和40 μL 10 mmol/L H2PtCl6溶液加至2 mL 0.25 mmol/L CTAB溶液中。在搅拌下将1 mL 0.1 mol/L AA溶液滴加到上述溶液中,快速将所得混合溶液转移至30 ℃水浴中加热5 h。最后将制备的PtPdNPs离心分离并将所得固体洗涤。得到的沉淀重新分散在2 mL PBS溶液中,4 ℃冰箱留存待用。
二抗耦合物的制备过程如图1所示:将上述合成的1 mL HAuNPs与1 mLL-Cys溶液(0.2 mol/L)混合,搅拌8 h获得HAuNPs@L-Cys,然后在HAuNPs@L-Cys中加入1 mL PtPdNPs制得复合纳米颗粒HAuNPs-PtPdNPs。将500 μL AFP抗体(Ab2)加入HAuNPs-PtPdNPs中,在4 ℃下轻微震荡12 h,复合纳米颗粒中的Pt和抗体中的氨基作用形成化学键,再用BSA封闭非特异性位点,从而制得二抗耦合物HAuNPs-PtPdNPs-Ab2。最后高速离心分离并将固体用PBS洗涤、分散,在4 ℃下储存待用。
1.4 电化学夹心免疫传感器的制备
首先,依次用0.3 μm和0.05 μm的氧化铝粉末抛光处理玻碳电极(GCE),在超声浴中用乙醇和水洗涤多次除去电极表面杂质。接着将处理后的GCE在-0.2 V下浸入1% HAuCl4溶液中电沉积30 s,得到纳米金粒子修饰的GCE(GCE-depAu);利用铁氰化镍(NiHCFNPs)和沉积金之间的静电吸附作用,将电活性物质NiHCFNPs直接滴加至电极表面,干燥后形成一层NiHCFNPs膜(GCE-depAu-NiHCFNPs);随后将所得的GCE-depAu-NiHCFNPs电极再次在1% HAuCl4溶液中电沉积30 s,修饰上另一层纳米金粒子层;将此修饰电极浸入200 ng/mL的抗体(Ab1)溶液中,在4 ℃下孵育12 h,Ab1通过Au-N键结合作用被固定在电极表面;用1% BSA封闭非特异性吸附位点,得到GCE-depAu-NiHCFNPs-depAu-Ab1-BSA修饰电极。基于抗原抗体之间的特异性识别作用,在修饰电极上滴加20 μL不同浓度的AFP抗原,在4 ℃下孵育1 h;之后在电极表面滴加20 μL二抗复合物HAuNPs-PtPdNPs-Ab2,4 ℃下孵育1 h,制备好的夹心式免疫传感器储存在4 ℃备用。
测试前将制备的夹心免疫传感器浸入含1.0 mmol/L 4-CN和0.15 mmol/L H2O2的0.1 mol/L PBS(pH 7.4)中15 min,二抗中的HAuNPs和固载的PtPdNPs充当辣根过氧化物模拟酶协同催化4-CN,在电极上产生不溶性沉淀物4-CD,阻碍电子传递,降低电流信号。电化学传感器制备过程及电信号变化示意图见图1。
1.5 夹心免疫传感器的测试方法
本实验采用三电极测定系统,选择自制夹心免疫传感器为工作电极,饱和甘汞电极为参比电极,铂丝电极为对电极,采用微分脉冲伏安法(DPV)进行定量测定,电位扫描范围为0~0.8 V;振幅0.05 V;脉冲宽度0.06 s;采样宽度0.02 s。
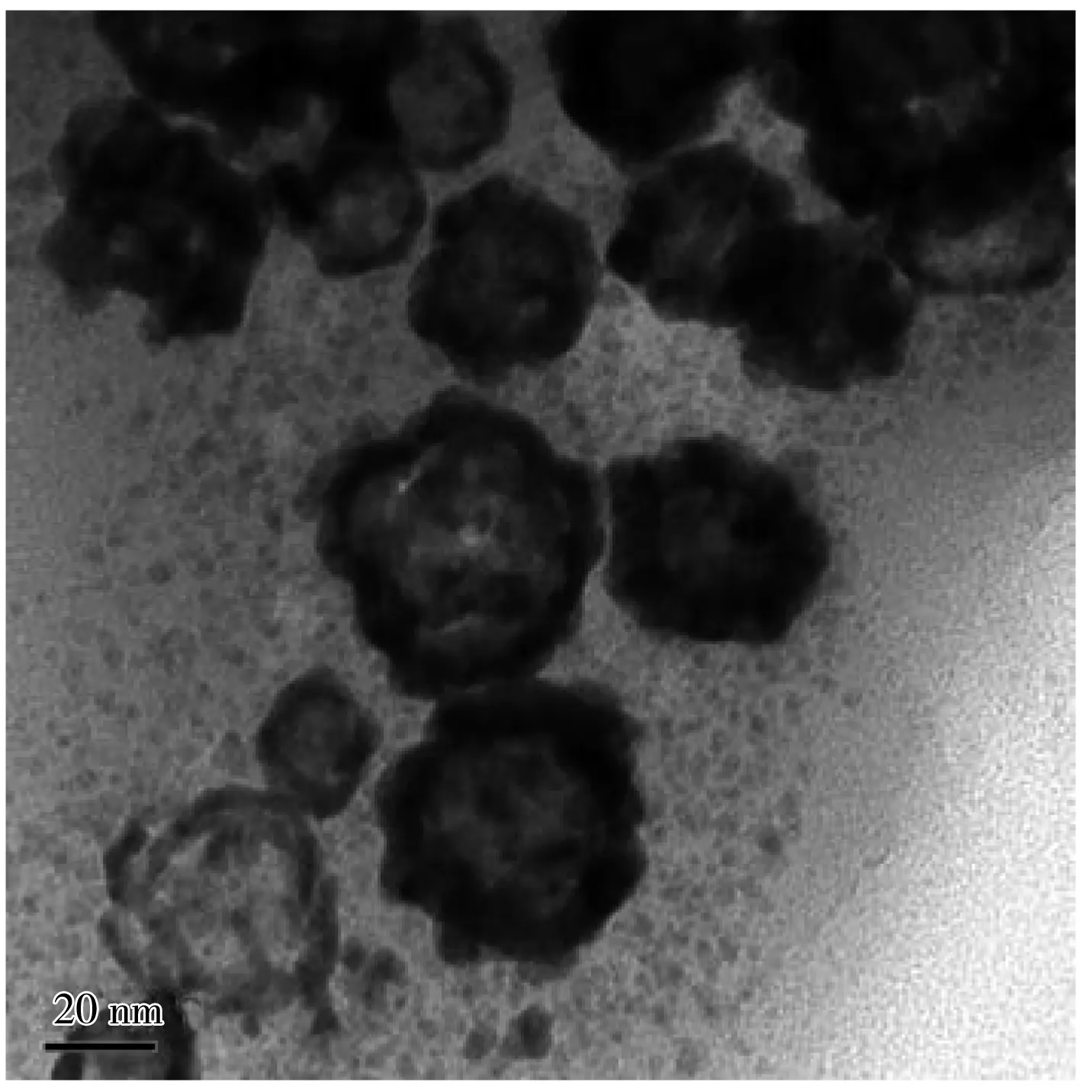
图2 空心纳米金的TEM图Fig.2 TEM image of HAuNPs
2 结果与讨论
2.1 空心纳米金(HAuNPs)的形貌表征
透射电镜(TEM)是表征HAuNPs形貌的有力工具。从图2中可以看出,HAuNPs呈球状结构,内部清亮但边缘较暗,说明合成的HAuNPs应为空心球体结构。
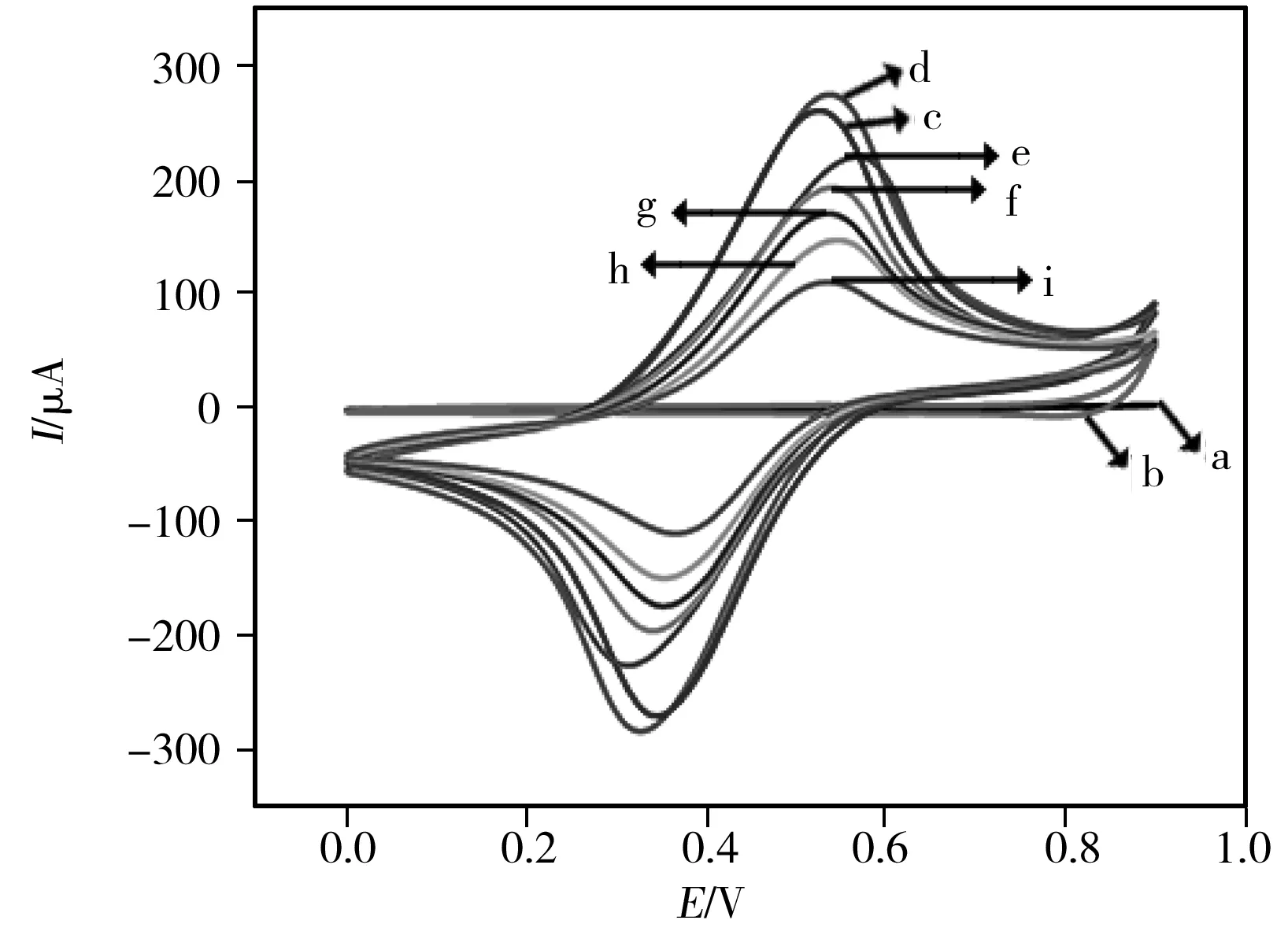
图3 免疫传感器制备过程的CV表征Fig.3 CV responses for each immobilized step a:bare GCE;b:depAu-GCE;c:NiHCFNPs-depAu-GCE; d:depAu-NiHCFNPs-depAu-GCE;e:Ab1-depAu-NiHCFNPs- depAu-GCE;f:BSA-Ab1-depAu-NiHCFNPs-depAu-GCE; g:AFP-BSA-Ab1-depAu-NiHCFNPs-depAu-GCE;h:Ab2 conjugate-AFP-BSA-Ab1-depAu-NiHCFNPs-depAu-GCE; i:h electrode treated by catalytic precipitation reaction in PBS solution (pH 7.4)
2.2 免疫传感器修饰制备过程的界面表征
本文采用循环伏安法(CV)在PBS溶液中测定不同修饰电极的界面特性。如图3所示,裸电极GCE和第一层纳米金电沉积到电极上(depAu-GCE),由于无电活性物质,曲线(a~b)未产生峰值电流;当Au-GCE上滴加电活性物质NiHCFNPs后,曲线c可以观察到1对良好的氧化还原峰;将第二层纳米金电沉积到电极上,由于沉积金的优良导电性,使得曲线d的峰电流增加;电极上依次修饰Ab1、BSA、AFP抗原后,电极氧化还原峰电流连续下降(曲线e-g),这是由于蛋白质层对电子传输的阻碍作用;当二抗复合物HAuNPs-PtPdNPs-Ab2固定于电极表面,电子传输进一步受到阻碍,曲线h可以观察到1个明显的电流降低响应;组装后的电极浸入含有1.0 mmol/L 4-氯-1-萘酚和0.15 mmol/L H2O2的0.1 mol/L PBS(pH 7.4)溶液中15 min,电极表面产生不溶性沉淀物阻碍了电子传递,曲线i显示峰电流值明显下降。综上所述,图3中曲线a-i显示该免疫传感器已成功制备。
2.3 反应条件的优化
为了使免疫传感器对AFP检测表现出良好的性能,本文对实验条件进行了优化。在0.01 ng/mL AFP条件下,测试电活性物质NiHCFNPs的不同修饰时间(20、40、60、80、100 min)对电化学响应的影响。结果显示,峰电流随着时间的增加而逐渐增加。当修饰时间达到60 min时,继续延长修饰时间,传感器的电流响应值基本不变,说明NiHCFNPs在电极表面的修饰已达到饱和。因此,实验选择最优的NiHCFNPs修饰时间为60 min。
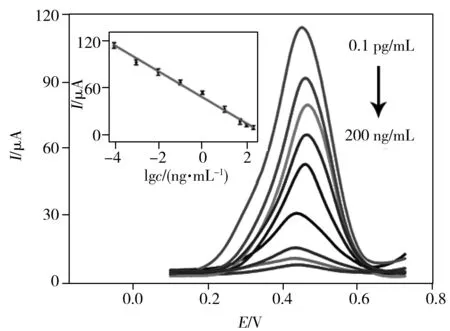
图4 免疫传感器对不同浓度AFP的DPV响应Fig.4 DPV responses of the immunosensor for different concentrations of AFP concentrations of AFP:0.000 1,0.001,0.01,0.1,1, 10,50,100,200 ng/mL;insert:calibration of the immunosensor for detection of AFP
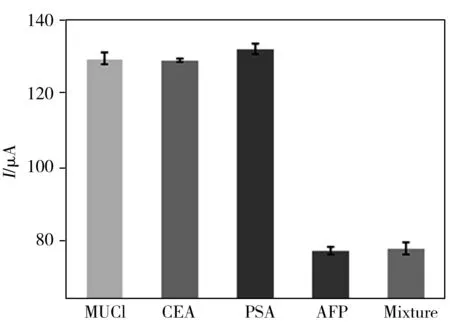
图5 免疫传感器的选择性Fig.5 The selectivity of the immunosensor
2.4 免疫传感器对AFP抗原的响应性能
在优化实验条件下,将制备的免疫传感器在含有不同浓度AFP抗原的标准溶液中孵育1 h,再在PBS溶液中采用DPV进行AFP检测。如图4所示,该传感器的响应电流随目标物AFP抗原浓度的增加而不断减小,这是因为随着AFP浓度的增大,通过夹心免疫模式在电极上结合的二抗耦合物的量越多,从而导致HAuNPs和PtPdNPs协同催化4-CN在电极表面形成更多的不溶性沉淀物,阻碍了电子传递,导致电化学响应降低。研究显示,AFP在0.1 pg/mL~200 ng/mL范围内,该免疫传感器的电化学响应电流(I)对其质量浓度的对数(lgc)具有较好的线性响应,线性方程为:I=-16.78 lgc+46.94(r=0.995 1),检出限(S/N=3)为33 fg/mL。将该免疫传感器的分析性能与之前报道的分析方法进行比较(表1),该传感器显示了更高的灵敏度,能实现AFP的痕量检测。
2.5 免疫传感器的选择性与稳定性
为了测试传感器对AFP的选择性,选用1 ng/mL的粘蛋白(MUC1)、癌胚抗原(CEA)和前列腺特异抗原(PSA)作为干扰物,将孵育上述干扰物的传感器DPV响应信号与孵育0.01 ng/mL AFP的信号进行对比。结果显示干扰物未对该免疫传感器的响应信号造成明显影响(见图5),表明该传感器对AFP具有良好的选择性。
为研究传感器的稳定性,随机选择一支孵育了1 ng/mL AFP的电极连续循环扫描10圈,结果发现DPV响应值的相对标准偏差(RSD)为3.4%,说明该修饰电极具有优异的稳定性。
2.6 加标回收实验
采用标准加入法,将人体血清用pH 7.4 的PBS溶液稀释50倍,配制4个不同质量浓度的AFP溶液考察电化学免疫传感器的性能,结果如表2所示。测得不同质量浓度AFP的加标回收率为98.0%~105%,RSD为1.9%~3.8%。表明该电极可应用于实际样品的初步测定。

表1 本方法和其他AFP检测方法的性能对比Table 1 Performance of this work as compared to some reported AFP analytical methods

表2 免疫传感器在人体血清中的回收结果Table 2 Recovery results of the proposed immunosensor in human serum sample
3 结 论
本文基于金属模拟酶HAuNPs和PtPdNPs的协同催化作用,以NiHCFNPs为电化学信号物质,构建了一种用于超灵敏检测AFP的电化学免疫传感器。该实验成功制备HAuNPs-PtPdNPs复合材料并实现协同催化4-CN在电极表面形成沉淀物,实现对AFP的定量检测。该电化学方法在测定AFP时表现出良好的特异性、灵敏度和稳定性,在癌症临床诊断中具有广泛的应用前景。

