基于DNA四面体纳米结构探针的电化学生物传感器检测DNA甲基化
韩苗苗,王 萍,席守民
(河南科技大学 基础医学院,河南 洛阳 471000)
DNA甲基化是最早被发现、也是研究最深入的表观遗传修饰之一。它是指在DNA甲基转移酶(DNMT)的催化作用下,以S-腺苷甲硫氨酸(SAM)作为甲基供体,将甲基基团结合到胞嘧啶的C-5位,在胞嘧啶-磷酸-鸟嘌呤(CpG)二核苷酸中形成5-甲基胞嘧啶(5-mc)的过程。在真核生物DNA中,约3%~8%的胞嘧啶残基被甲基化[1],而异常的甲基化状态(低甲基化或高甲基化)又与多种疾病的发生密切相关,如糖尿病[2]、冠状动脉疾病[3-4]、帕金森氏症[5]、肿瘤[6-7]等。因此,DNA甲基化的检测对于这些疾病的预测和预后具有重要意义。
目前已经建立了许多用于检测DNA甲基化的方法,常用的方法包括亚硫酸氢盐测序法[8]、甲基化特异性PCR(MSP)[9-10]、甲基化敏感性限制性内切酶-PCR(MSRE-PCR)[11-12]、甲基化敏感的高分辨率熔解曲线分析(MS-HRM)[13-14]和变性高效液相色谱(DHPLC)[15-16]。尽管亚硫酸氢盐测序法被认为是DNA甲基化分析的金标准,但它通常需要大量的基因组DNA作为起始物质,并且在修饰过程中存在DNA降解的固有问题[17]。此外,上述所有方法都依赖于PCR设备的使用,使得这些方法成本昂贵、费力、费时且复杂。为了克服常规DNA甲基化检测方法的缺点,已出现了一些用于DNA甲基化检测的新方法,如比色法[18-19]、基于荧光的生物传感器[20-21]、电化学发光法[22]、表面等离子体共振(SPR)生物传感器[23-24]、电化学法[25-28]等。其中,基于电化学的DNA甲基化分析方法因其操作简便、灵敏度高、成本低且易于自动化和便携化等优点而受到了广泛关注[29]。
电化学生物传感器捕获探针的结构对检测灵敏度和特异性至关重要。在典型的电化学传感器构建过程中,需将巯基修饰的单链DNA(ssDNA)探针[30]、发夹型DNA探针[31]、肽核酸探针[32]和锁核苷酸探针[33]固定在电极表面作为捕获探针与靶标杂交。为了和靶标分子更好地结合,这些捕获探针必须保持垂直排列,因而需要使用封阻剂保持探针的方向性,且这些探针的密度也很难控制,从而影响了捕获探针与靶标分子之间的杂交效率,以及检测的准确性[34-35]。为了解决此问题,开发了DNA四面体纳米结构探针(TSP)作为识别探针。与常规的捕获探针相比,TSP具有优异的性能,如机械刚度、结构稳定性、可控的探针间距和方向性[36-37]。
为了提高检测灵敏度,信号放大也被广泛用于电化学生物传感器。纳米金颗粒(AuNPs)因具有高的比表面积和独特的理化特性而成为最常用的纳米材料之一[38-39],其可与DNA、抗体和酶偶联以增强检测信号。研究表明,用辣根过氧物酶标记的IgG抗体(IgG-HRP)修饰的AuNPs可显著提高免疫分析和电化学分析的检测灵敏度[40-41]。
本研究基于电沉积纳米金颗粒和AuNPs-IgG-HRP复合物的信号增强作用,结合TSP的特异识别功能,建立了一种简单灵敏、易于操作的电化学生物传感器用于DNA甲基化的检测。
1 实验部分
1.1 仪器与试剂
Autolab电化学工作站(荷兰Metrohm Autolab公司),实验采用标准的三电极体系:修饰后的金电极为工作电极,Ag/AgCl 为参比电极,铂丝电极为对电极。
四氯金酸三水合物(HAuCl4·3H2O)、三(2-羧乙基)膦盐酸盐(TCEP)和氢醌(HQ)均购自上海阿拉丁公司;5-甲基胞嘧啶(5-mc)单克隆抗体和山羊抗小鼠IgG-HRP购自美国Abcam公司;牛血清白蛋白(BSA)购自北京索莱宝公司;直径15 nm的AuNPs购自上海水源生物科技有限公司;测试底液为磷酸盐缓冲液(PBS)。所有试剂均为分析纯,实验用水均为超纯水。
实验所用的核酸序列由上海生工生物工程有限公司合成(见表1)。用TE缓冲液(10 mmol/L Tris-HCl,1.0 mmol/L EDTA,pH 8.0)将核酸序列稀释,并保存在-20 ℃备用。

表1 实验所用核酸序列Table 1 The base sequences of nucleic acid used in this experiment
1.2 金电极的处理
依次用粒径为0.3 μm和0.05 μm的Al2O3粉末打磨金电极(AuE,直径2.0 mm),再将AuE放在无水乙醇和水中各超声清洗3 min。待AuE在室温下自然晾干后,将电极插入0.5 mol/L H2SO4溶液中用循环伏安法(CV)清洗活化,扫描范围为-0.3~1.55 V,直至出现标准、重复的CV曲线,随后用水将电极表面彻底淋洗干净并用氮气吹干。将AuE浸入含10 mmol/L HAuCl4的0.5 mol/L H2SO4溶液中,于-0.2 V恒电位下电化学沉积纳米金200 s,再次充分淋洗电极,并用氮气吹干,即得纳米金修饰的金电极,标记为AuNPs/AuE。
1.3 TSP的制备
将S1、S2、S3和S4四条ssDNA溶解在TE缓冲液中,使每条链的终浓度为50 μmol/L。分别吸取1 μL上述ssDNA加入EP管中,再加入 41 μL TM缓冲液(20 mmol/L Tris,50 mmol/L MgCl2,pH 8.0)和5 μL 30 mmol/L的TCEP溶液(现配现用)。振荡混匀后于PCR仪中将混合物加热至95 ℃,并保持2 min,然后在4 ℃下冷却30 s,通过热变性法自组装形成TSP,保存于4 ℃备用,通过琼脂糖凝胶电泳对其进行表征。
1.4 AuNPs-IgG-HRP复合物的制备
根据已有文献制备AuNPs-IgG-HRP复合物[42]。首先,用0.1 mol/L K2CO3将1 mL AuNPs溶液调至pH 8.3。在缓慢搅拌下,将不同体积的IgG-HRP(2.0 mg/mL)加至AuNPs溶液中,室温静置30 min后,将100 μL 10% BSA加至上述溶液中,室温孵育15 min。接着,将混合物在4 ℃以6 000 r/min离心10 min,并将上清液转移至新的离心管中,在4 ℃再次以12 000 r/min离心20 min以除去未结合的IgG-HRP。弃上清,将沉淀重悬于100 μL重悬液(10 mmol/L PBS含5%蔗糖、0.5%BSA、0.5%Tween-20和0.2%PEG 20000,pH 7.4)中,4 ℃保存备用。
1.5 电化学生物传感器的构建
将4 μL新鲜制备的TSP加至AuNPs/AuE电极表面,于4 ℃过夜,使末端巯基化的探针通过Au—S键固定在电极表面。待探针固定后,用10 mmol/L PBS充分淋洗电极以去除多余吸附的探针,并用氮气吹干,此电极标记为TSP/AuNPs/AuE。接着,在电极表面滴加5 μL用杂交缓冲液(10 mmol/L PB中含20 mmol/L MgCl2,1 mol/L NaCl,pH 7.4)稀释的不同浓度靶标甲基化DNA序列,并在37 ℃孵育20 min。电极取出后,用10 mmol/L PBS彻底冲洗,并用氮气吹干,此电极标记为DNA/TSP/AuNPs/AuE。然后,将10 μL 0.05%的BSA滴至电极表面,室温孵育30 min,以封闭电极表面的非特异性结合位点。用10 mmol/L PBS彻底冲洗电极后,氮气吹干,将5 μL 5-mc抗体(2.0 μg/mL)滴至电极表面,在37 ℃下孵育1 h,用10 mmol/L PBS冲洗电极,氮气吹干,此电极标记为antibody/DNA/TSP/AuNPs/AuE。最后,将5 μL AuNPs-IgG-HRP滴至电极表面,并在室温下孵育30 min,将电极用10 mmol/L PBS冲洗后,氮气吹干,此电极标记为HRP/antibody/DNA/TSP/AuNPs/AuE,该修饰完成的电极为工作电极,可用于电化学信号测定。
1.6 电化学信号的检测
采用CV和电化学阻抗谱(EIS)对电极的修饰性能进行表征,CV和EIS的测试溶液均为含5 mmol/L铁氰化钾([Fe(CN)6]3-/4-,1∶1,摩尔比)的0.1 mol/L KCl溶液。CV测定的电压范围为-0.2~0.6 V,扫描频率为0.05 V/s。EIS测量参数如下:频率范围为10-1~105Hz;初始电位为0.24 V;振幅为0.005 V;静置时间2 s。差分脉冲伏安法(DPV)在10 mL含4.0 mmol/L H2O2和1.5 mmol/L HQ的0.1 mol/L PBS(pH 7.4)中执行。检测参数设置为:电压范围为0.2~-0.3 V,脉冲幅度0.05 V;脉冲宽度0.05 s;样品宽度0.016 7 s;脉冲周期0.2 s;静置时间2 s。
2 结果与讨论
2.1 电化学传感器的检测原理
本研究采用TSP作为捕获探针,TSP的3个顶点通过Au—S键组装在AuNPs/AuE电极表面,第4个顶点延伸出一段ssDNA序列可与靶标甲基化DNA杂交。接着,加入5-mc单克隆抗体以识别单链靶标DNA上的5-mc位点。随后,加入AuNPs-IgG-HRP复合物,由于羊抗鼠IgG可以与5-mc抗体特异性结合,因此通过免疫反应可将AuNPs-IgG-HRP信号放大单元捕获到电极上。由于AuNPs具有很大的比表面积,因此可以负载大量IgG-HRP分子。HRP可以在过氧化氢(H2O2)存在下,催化HQ氧化生成苯醌(BQ),产生DPV电流。通过检测电流,可实现对靶标甲基化DNA的检测(见图1)。
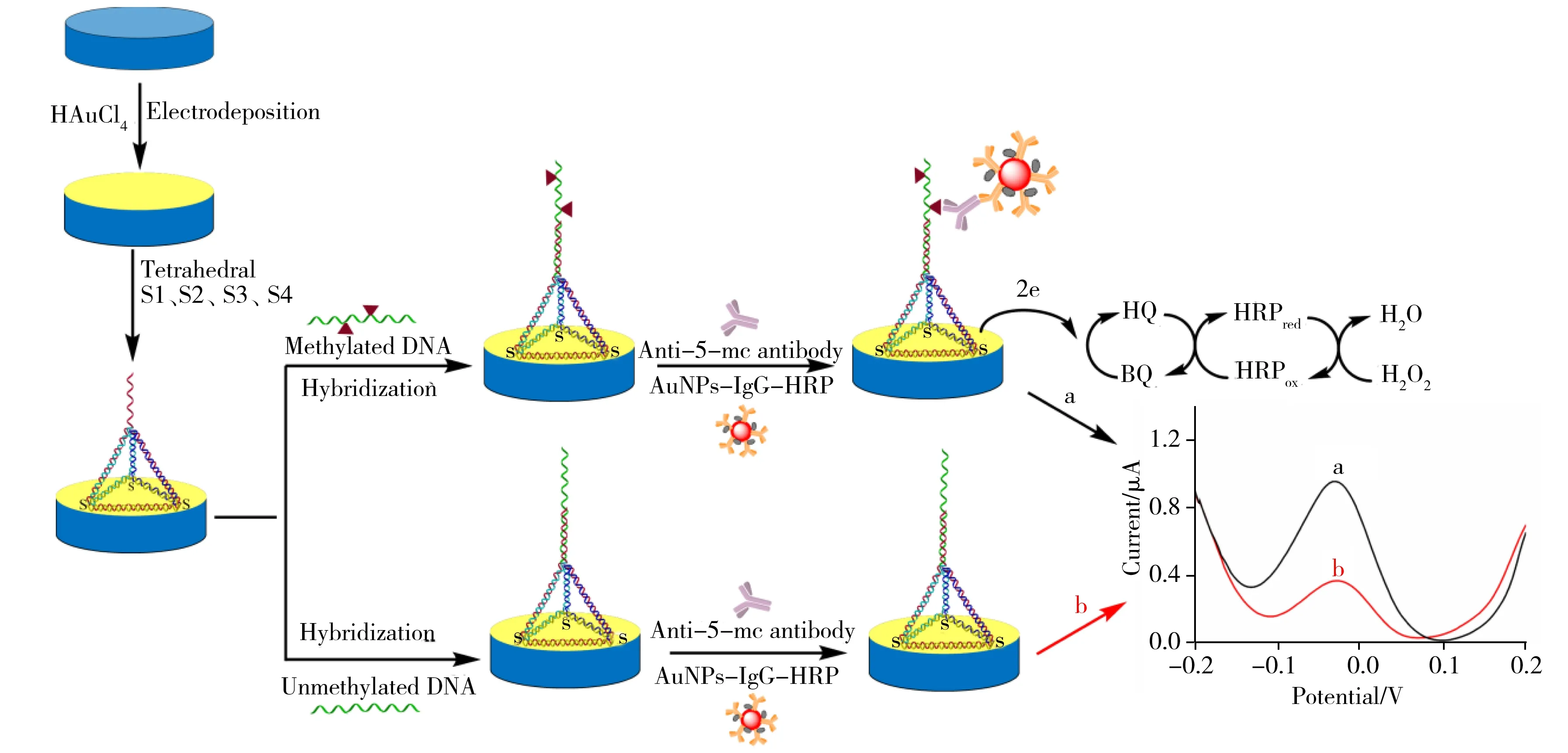
图1 基于DNA四面体纳米结构探针的电化学传感器检测DNA甲基化的原理图Fig.1 Schematic of the electrochemical sensor based on DNA tetrahedral nanostructure probes for detecting DNA methylation
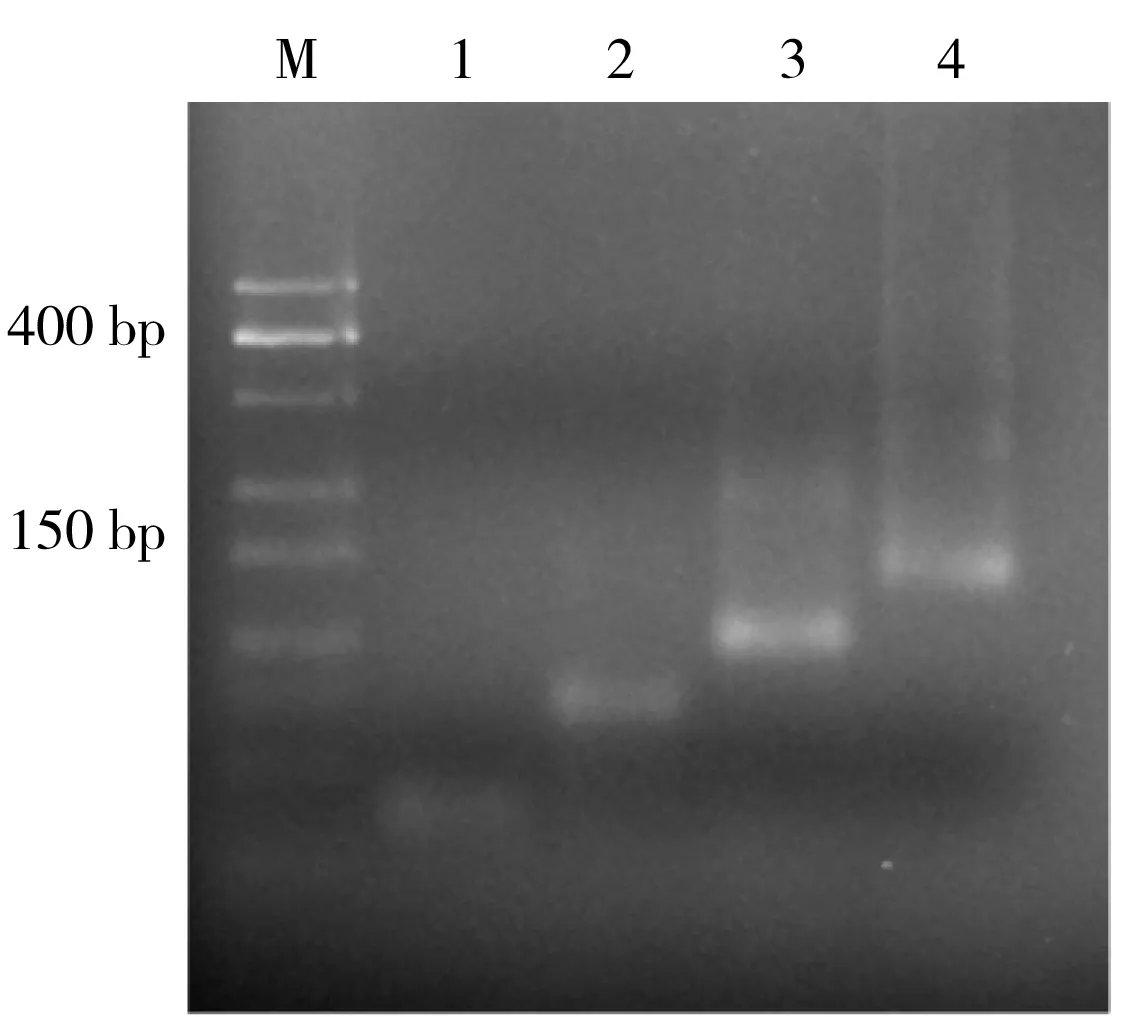
图2 琼脂糖凝胶电泳表征TSP合成Fig.2 Agarose gel electrophoresis to characterize TSP synthesis M:25 bp DNA marker;1:S1;2:S1+S2;3:S1+S2+S3; 4:S1+S2+S3+S4
2.2 TSP合成效果的琼脂糖凝胶电泳表征
图2是单链(S1)、两条链(S1+S2)、三条链(S1+S2+S3)和四条链(S1+S2+S3+S4)DNA通过一步热变性法合成后,在3%琼脂糖凝胶中的电泳结果。从图中可以看出,随着各链复杂程度和碱基数的增加,条带的迁移速率减慢。泳道4是TSP产物,由于它的碱基数最多且具有复杂的三维结构,导致其迁移速率最慢,这与以往报道一致[40],证明TSP已成功组装。
2.3 传感器层层组装的电化学表征
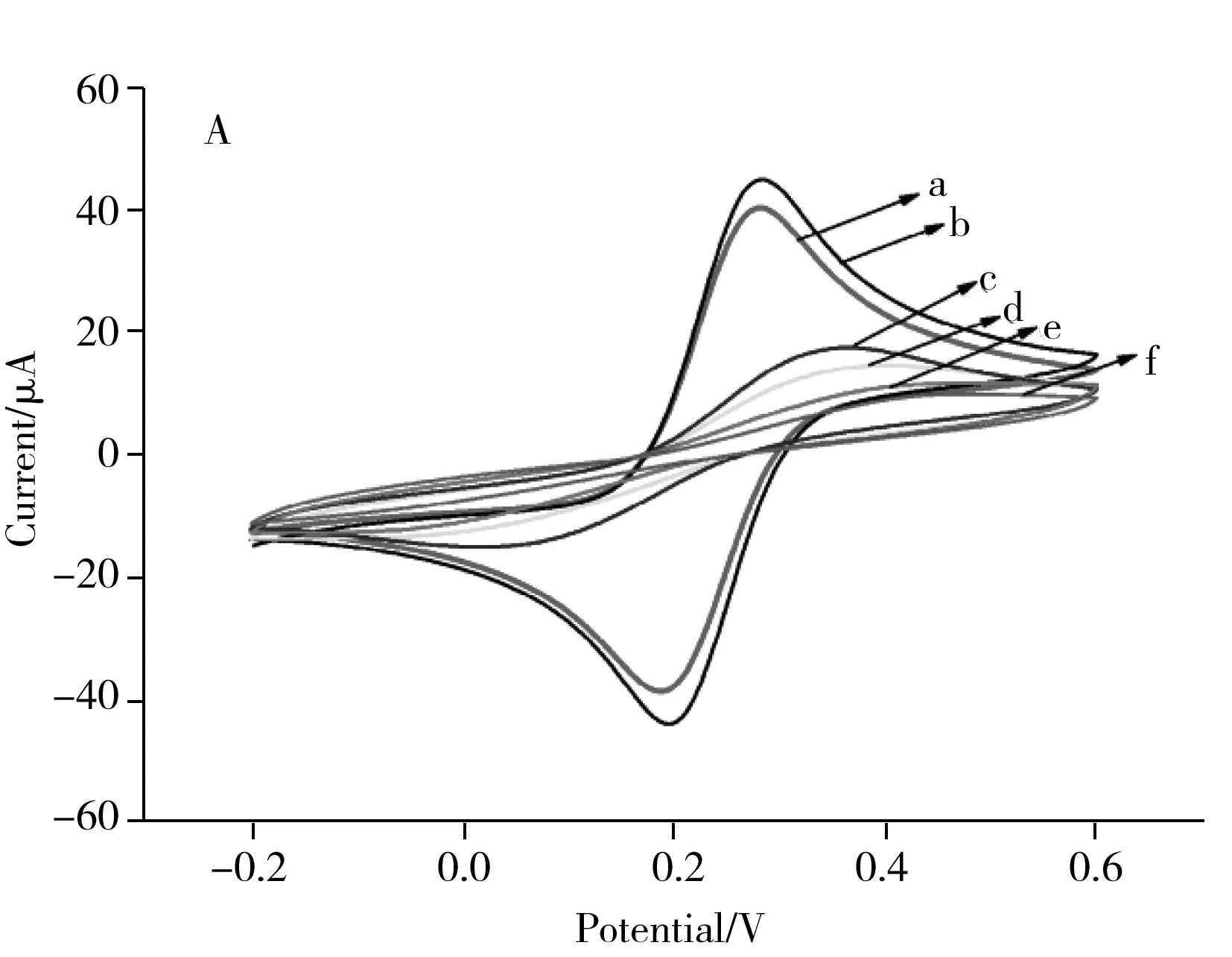
在含5 mmol/L [Fe(CN)6]3-/4-(1∶1)的0.1 mol/L KCl溶液中,考察了不同传感器的CV图(见图3A),其中曲线a为裸金电极的CV曲线,b、c、d、e、f分别为AuNPs/AuE、TSP/AuNPs/AuE、DNA/TSP/AuNPs/AuE、antibody/DNA/TSP/AuNPs/AuE和HRP/antibody/DNA/TSP/AuNPs/AuE的CV曲线。沉积金后电极的氧化还原电流峰值最大(曲线b),这是由于AuNPs具有优异的电导率,可增加电极的有效表面积并促进电子传输速率,而更大的表面积还将有助于固定更多的TSP,为后续的杂交和信号放大奠定基础;随后依次进行TSP的固定、靶标DNA的杂交、一抗的结合和AuNPs-IgG-HRP复合物的组装,得到的氧化还原电流逐渐减小,这是由于在电极表面的层层修饰过程中,阻碍了电子的转移,从而使电流强度逐渐减小。
进一步在含5 mmol/L [Fe(CN)6]3-/4-(1∶1)的0.1 mol/L KCl溶液中,考察了上述不同传感器的EIS图,结果见图3B。从图中可以看出,与裸金电极(曲线a)相比,沉积金后电极(曲线 b)的阻抗值减小,EIS 曲线接近一条直线,这是由于AuNPs能增加电子传递效率;TSP修饰后的电极(曲线c)所产生的阻抗值增加,表明TSP成功固定到电极表面;随后依次进行靶标 DNA 的捕获、一抗的结合和AuNPs-IgG-HRP复合物的组装,得到的阻抗值依次增大,与图3A中CV曲线的变化趋势一致,进一步表明传感器已构建成功。
2.4 实验条件的优化
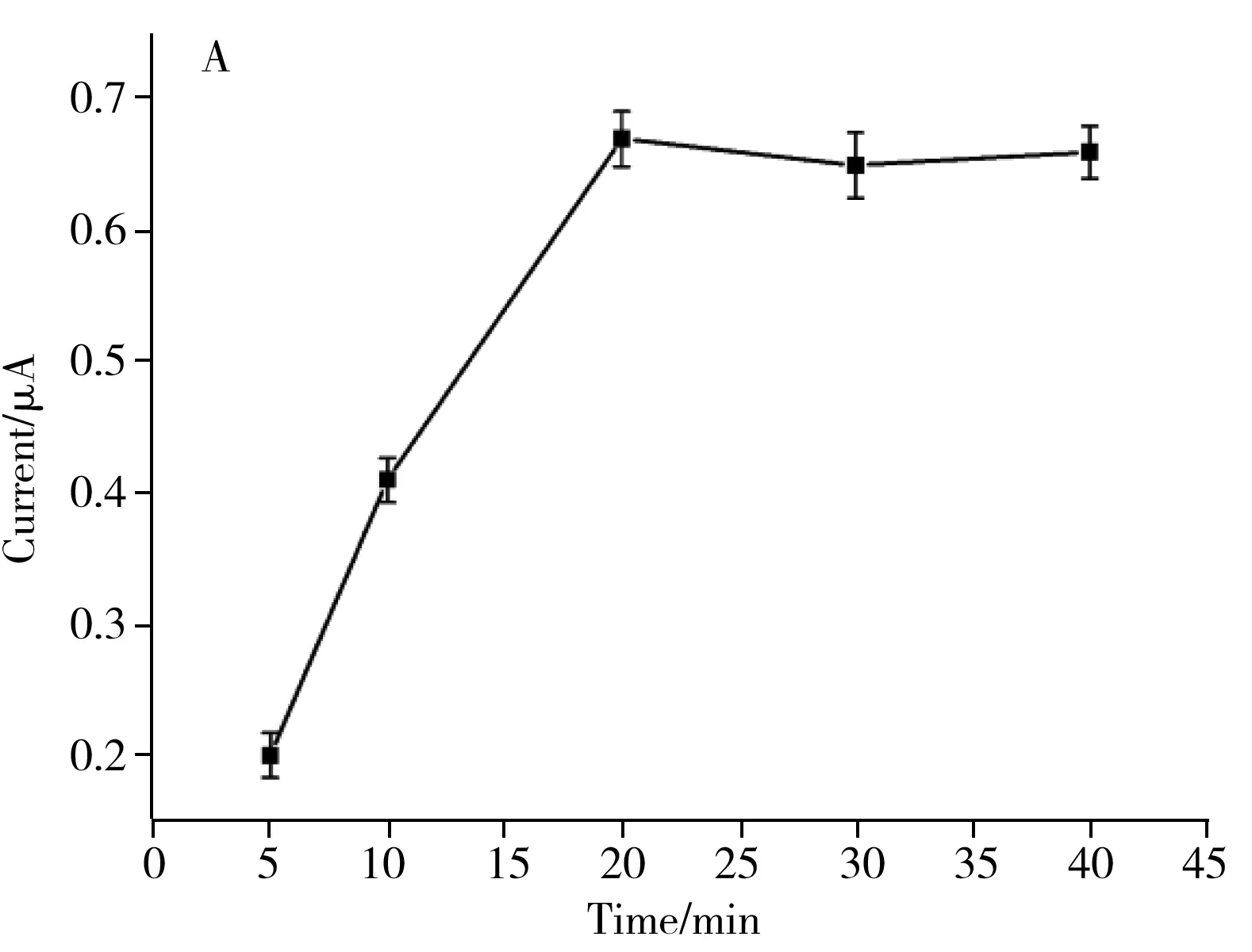
2.4.1 杂交时间的优化杂交时间是影响传感器性能的重要因素,如图4A所示,研究了100 pmol/L靶标甲基化DNA在5~40 min内与TSP的杂交情况。从图中可以看出,随着时间的增加,响应电流值不断增大,并在20 min时达到最高值,之后电流响应值随着时间变化趋于平缓。因此,实验选择20 min作为杂交时间。
2.4.2 5-mc抗体浓度的优化5-mc抗体的浓度直接影响与甲基化DNA中5-mc位点的结合。为了获得最佳的检测灵敏度,对5-mc抗体的质量浓度(0.25、0.5、1.0、2.0、4.0 μg/mL)进行优化,结果如图4B所示。由图可知,当5-mc抗体质量浓度从0.25 μg/mL增至2.0 μg/mL时,响应电流值随着浓度的增加而增加,并在质量浓度为2.0 μg/mL时达到峰值,继续增大5-mc抗体浓度的值,则响应电流降低。因此,实验选择2.0 μg/mL作为5-mc抗体的最佳浓度。

2.4.3 IgG-HRP体积的优化作为信号放大单元,在电极上捕获的AuNPs-IgG-HRP数量越多,传感器的灵敏度就越高。在复合物标记过程中,加入一系列不同体积(2.5、5.0、7.5、10.0、12.5 μL)的2 mg/mL IgG-HRP,对其在AuNPs上的结合进行优化,结果如图4C所示。结果表明,在复合物制备过程中,当IgG-HRP的加入体积为7.5 μL时,电流响应值趋于平衡并达到最大。因此,实验选择7.5 μL作为IgG-HRP的最佳加入体积。
2.4.4 HQ和H2O2浓度的优化考察了不同HQ(0.5、1.0、1.5、2.0、2.5 mmol/L)和H2O2浓度(1.0、2.0、3.0、4.0、5.0 mmol/L)对检测灵敏度的影响。结果显示,体系的电流值随着HQ浓度的增大而增大,并在1.5 mmol/L时达到峰值(见图4D)。随着H2O2浓度从1.0 mmol/L增加到5.0 mmol/L,体系的响应电流值逐渐增加,并在4.0 mmol/L时达到峰值,之后电流响应值变化趋于平缓。因此,实验选择1.5 mmol/L HQ和4.0 mmol/L H2O2作为最佳浓度。
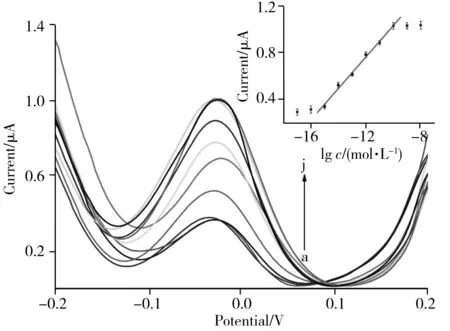
图5 甲基化DNA在不同浓度下的DPV曲线Fig.5 DPV curves obtained in different concentrations of methylated DNA concentration (a-j):1.0×10-17,1.0×10-16,1.0×10-15,1.0× 10-14,1.0×10-13,1.0×10-12,1.0×10-11,1.0×10-10, 1.0×10-9,1.0×10-8 mol/L;insert:relationship between DPV peak current and concentrations of methylated DNA
2.5 电化学传感器的分析性能
在最优实验条件下,研究甲基化DNA浓度与电流响应值的关系。随着甲基化DNA浓度在1.0×10-17~1.0×10-10mol/L范围内不断增大,体系的DPV电流响应值也不断增加,并在高浓度时趋于平稳(图5)。在1.0×10-15~1.0×10-10mol/L范围内,甲基化DNA浓度的对数(lgc)与DPV相应电流(I)之间呈线性关系,其线性方程为I=0.134 5lgc+2.374 3,r2= 0.994(见图5插图),检出限(S/N=3)为4.4×10-16mol/L。
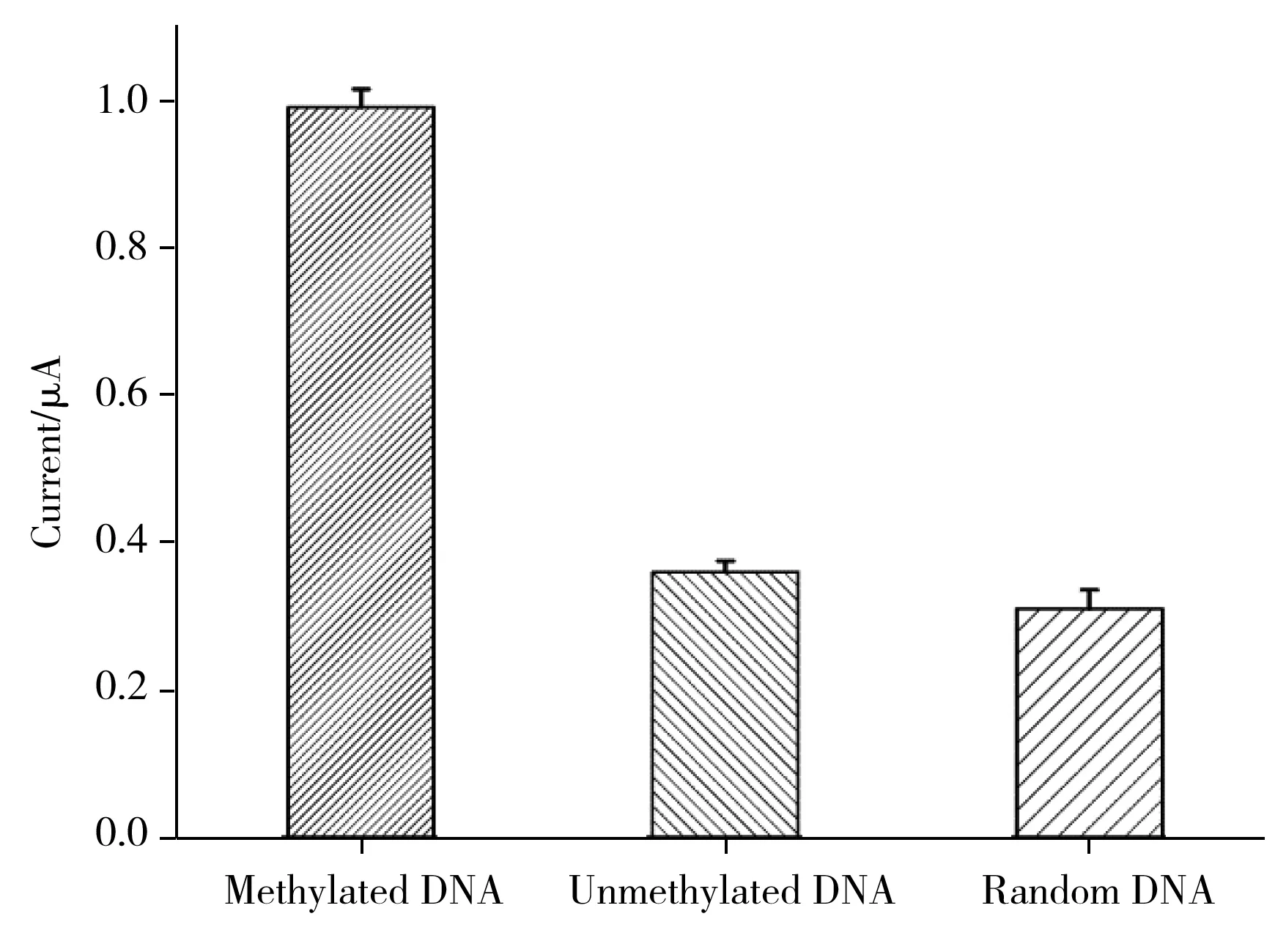
图6 传感器的特异性分析Fig.6 The specificity of the biosensor
2.6 传感器的特异性与稳定性
特异性是电化学生物传感器的一项重要参数。在最优实验条件下,采用所构建的传感器对100 pmol/L的甲基化靶序列、非甲基化靶序列和随机DNA序列的检测信号进行评估(见图6)。由图可看出,所构建的传感器对甲基化靶序列的电流响应值远高于非甲基化靶序列和随机DNA序列,表明构建的传感器具有良好的特异性。
以1.0×10-10mol/L的甲基化DNA作为研究对象,将组装好的传感器在10 mL含4.0 mmol/L H2O2和1.5 mmol/L HQ的0.1 mol/L PBS(pH 7.4)溶液中进行DPV检测,重复检测5次,最终得到的相对标准偏差(RSD)为2.3%,说明该电化学生物传感器具有良好的稳定性。
3 结 论
本文构建了以TSP作为捕获探针和AuNPs-IgG-HRP复合物作为信号放大单元的电化学传感器用于检测甲基化DNA。在最佳实验条件下,该传感器对甲基化DNA的线性范围为1.0×10-15~1.0×10-10mol/L,检出限为4.4×10-16mol/L。所制备的电化学生物传感器对甲基化DNA具有宽的线性范围和良好的特异性,为甲基化DNA的检测提供了一种新思路。

