重组人促卵泡激素对比尿促卵泡素在体外受精/卵胞质内单精子注射-胚胎移植中促排卵治疗的快速卫生技术评估
张若梅 吴斌 金丽


摘 要 目的:比較重组人促卵泡激素(rFSH)和尿促卵泡素(uFSH)在体外受精/卵胞质内单精子注射-胚胎移植(IVF/ICSI-ET)中促排卵治疗的有效性、安全性和经济性,为rFSH和uFSH的临床合理使用提供循证证据。方法:计算机检索PubMed、Embase、Cochrane图书馆、中国知网、维普网、万方数据以及专业的卫生技术评估(HTA)数据库,收集rFSH对比uFSH在IVF/ICSI-ET中促排卵治疗的HTA、系统评价/Meta分析和经济学研究。筛选文献、提取资料、评价质量后,采用定性描述的方法汇总纳入研究的结论。结果:共纳入7篇文献,包括2篇系统评价/Meta分析和5篇经济学评价,未检索到HTA报告,所有研究均来自国外报道。系统评价/Meta分析发现,rFSH组在控制性促排卵中的获卵数较uFSH组多;而两组的持续妊娠率、临床妊娠率、活产率、流产率和卵巢过度刺激综合征发生率比较差异均无统计学意义(P>0.05)。经济学研究显示,rFSH可能更具成本-效果优势。结论:目前可获得的证据支持将rFSH用于IVF/ICSI-ET的促排卵治疗,uFSH的疗效和安全性与其相当,且rFSH可能更具成本-效果优势。
关键词 重组人促卵泡激素;尿促卵泡素;快速卫生技术评估;体外受精/卵胞质内单精子注射-胚胎移植;促排卵治疗;疗效;安全性;经济性
中图分类号 R956 文献标志码 A 文章编号 1001-0408(2020)22-2768-06
DOI 10.6039/j.issn.1001-0408.2020.22.14
ABSTRACT OBJECTIVE: To compare the efficacy, safety and economics of recombinant human follicle stimulating hormone (rFSH) and urin follicle stimulating hormone (uFSH) in the ovulation induction therapy for in vitro fertilization/intracytoplasmic sperm injection-embryo transfer, and to provide evidence-based evidence for rational use of rFSH in the clinic. METHODS: Retrieved from PubMed, Embase, the Cochrane Library, CNKI, VIP, Wanfang database as well as professional health technology assessment (HTA) database, HTA, systematic review/Meta-analysis and economic studies were collected to compare the effects of rFSH versus urine FSH (uFSH) in ovulation induction for in vitro fertilization/intracytoplasmic sperm injectionembryo transfer (IVF/ICSI-ET). After literature screening, data extiaction and quality evaluation, the conclusions of the included studies were summarized by using qualitative description. RESULTS: A total of 7 literatures were included, involving 2 systematic reviews/Meta-analysis and 5 economic evaluations, and no HTA report was retrieved. All the studies were reported from abroad. Systematic evaluation/Meta-analysis showed that the number of oocytes obtained in the rFSH group was higher than that in the uFSH group. There was no statistical significance in persistent pregnancy rate, clinical pregnancy rate, live birth rate, abortion rate and the incidence of ovarian hyperstimulation syndrome (OHSS) between 2 groups (P>0.05). Economic research showed that rFSH may have cost-effective advantage. CONCLUSIONS: Current available evidence support that rFSH has simialr efficacy and safety for ovulation induction of IVF/ICSI-ET, and shows cost-effec- tiveness advantage.
KEYWORDS Recombinant FSH; Urine FSH; Rapid health technology assessment; IVF/ICSI-ET; Ovulation induction therapy; Efficacy; Safety; Economics
根据世界卫生组织的报道,全球范围内约15%的育龄夫妇受不孕不育问题的困扰,2012年的调查数据显示,在发展中国家每4对夫妇中就有1对存在不孕不育的问题[1]。辅助生殖技术(Assisted reproductive technology,ART)的出现和应用为不孕症的治疗提供了新的手段。目前临床常用的ART技术是体外受精/卵胞质内单精子注射-胚胎移植(in vitro fertilization/intracytoplasmic sperm injection-embryo transfer,IVF/ICSI-ET)[2]。在IVF/ICSI-ET治疗中合理应用促性腺激素(Gn)药物进行控制性超促排卵(COS),既能获得适当数量的高质量卵子,又能避免卵巢过度刺激综合征(OHSS)的发生(OHSS是不孕症患者卵巢在过度的Gn刺激下,因卵巢形态改变及产生过多的卵巢激素或激素前体所致的一种综合性病症,严重时可危及生命[2])。
目前临床上广泛应用的Gn药物有两种,一种是重组人促卵泡激素(rFSH),另一种是尿源性促卵泡素(uFSH),其有效单位均为促卵泡激素(FSH)。rFSH是运用基因工程技术将编码FSH的基因导入中国仓鼠卵巢细胞,制备出纯度>99%的FSH制剂,与天然FSH具有完全相同的亚基氨基酸序列和单糖位置,且不含尿源性杂蛋白,具有体内半衰期长、生物活性高、批间差异小等优点[3]。根据组成亚单位不同,rFSH分为α与β两种亚型,两者的糖基化图谱基本相同[4]。20世纪80年代,研究者从绝经期妇女尿液中提取到uFSH,并通过使用单价抗体纯化系统获得高纯度uFSH产品(纯度:>95%),只含有微量的促黄体生成素(LH)蛋白[5]。uFSH包括尿促性素(HMG)、高纯度尿促性素(HP-HMG)、纯化尿促卵泡素(P-FSH)和高纯度尿促卵泡素(HP-FSH)[5]。已有大量的研究对rFSH和uFSH这两种药物进行比较,然而对于这两种促排卵药物的有效性和安全性一直是争论的焦点;而且在经济学方面,与uFSH相比rFSH是否更具经济性仍需进一步评价。
快速卫生技术评估作为一种决策支持工具,可通过简化卫生技术评估(Health technology assessment,HTA)、系统评价方法和流程,系统地检索、收集和评价高质量的证据,从而快速评估药物的有效性、安全性和经济性,为决策者提供证据支持[6]。因此,为更好地指导临床实践以及為卫生政策制定者提供当前最佳决策证据,本研究以uFSH为对照,快速评估了rFSH在IVF/ICSI-ET中促排卵治疗的有效性、安全性和经济性,为rFSH与uFSH等Gn药物的临床应用提供参考。
1 资料与方法
1.1 纳入与排除标准
研究须同时满足以下5项条款方可纳入——①研究对象:接受IVF/ICSI-ET周期治疗的不孕女性患者。②干预措施:rFSH(包括rFSHα和rFSHβ)。③对照措施:uFSH(包括HMG、HP-HMG、P-FSH、HP-FSH)。④结局指标:有效性指标,包括获卵数、胚胎数、优质胚胎数、临床妊娠率(临床妊娠指胚胎移植30天后行阴道B超检查,宫内见孕囊并可见原始心管搏动)、活产率[孕满28周或胎儿出生体质量达1 kg及以上、胎儿娩出后具有4种生命现象(呼吸、心跳、脐带搏动、随意肌收缩)之一者,称为活产]或持续妊娠率、多胎妊娠率(1次妊娠宫腔内同时有2个或以上胎儿时称为多胎妊娠)、流产率(妊娠28周以前,胎儿体质量小于1 kg、胚胎不再发育即为流产,其中妊娠12周及之前胚胎停止发育为早期流产,13~28周胚胎停止发育为晚期流产)、着床率;安全性指标,包括OHSS发生率;相关经济学指标。⑤研究类型:HTA、系统评价/Meta分析和经济学研究。
排除标准:会议摘要;重复发表或同一人群资料重复研究的文献;无法获得全文的文献;动物实验/基础实验;非针对rFSH进行促排卵治疗研究的文献。
1.2 检索策略
计算机检索PubMed、Embase、Cochrane图书馆、中国知网、维普网和万方数据等数据库;同时,检索专业HTA数据库,如INAHTA(The International Network of Agencies for Health Technology Assessment)、DAHTA(The German Agency for HTA of the DIMDI)、NICE(National Institute for Healthand Care Excellence)等数据库。使用以下相关检索词进行全面的文献检索:“Recombinant FSH” “IVF”“systematic review”“Meta-analysis”“Health technology assessment”“Economic*”“Cost-effective*”(注:*表示后面字节省略),“促排卵”“重组人促卵泡素”“尿促卵泡素”“经济学”“成本-效果”“最小成本分析”等。未对语言和发表状态进行限制,检索时限均从各数据库建库起至2020年6月。同时浏览纳入研究或相关研究的参考文献。
1.3 数据提取与方法学质量评价
将检索到的文献去重后,由2位研究者分别依照纳入与排除标准进行独立筛选并交叉核对;同时,按预设的资料提取表格独立提取基本信息,内容包括纳入研究的一般资料,如检索时间、纳入人群、样本量、干预措施、结局指标和结论等。如遇分歧,与第3位研究者协商解决。分别采用HTA 清单(Health technology assessment checklist)、AMSTAR(A Measure Tool to Assess Systema- tic Review)量表和CHEERS(Consolidated Health Economic Evaluation Reporting Standards)量表评估HTA报告、系统评价/Meta分析和经济学研究的方法学质量,其中,AMSTAR量表[7]的条目包括:①提供前期设计;②研究的选择和数据提取无重复;③进行全面的文献检索;④发表情况考虑在纳入标准中;⑤提供纳入与排除清单;⑥描述纳入文献的基本特征;⑦评价和报告纳入研究的科学性;⑧将纳入研究的科学性恰当地运用在结论的推导上;⑨纳入研究的合并方法恰当;⑩评估发表偏倚的可能性;11说明相关利益冲突,针对以上11项条目分别评价为是、否或不清楚。CHEERS量表的评分规则[8-9]:符合标准则评价为“是”(计1分),部分符合则评价为“部分”(计0.5分),不符合则评为“否”(计0分),总分24分;评价结果分为优秀(≥19.5)、良好(16.5~19分)、合格(14.5~16分)、不合格(≤14分)。采用Cochrane 系统评价手册5.1.0偏倚风险评估工具评价RCT的方法学质量,应用Rev Man 5.1软件获得偏倚风险图。
1.4 数据处理
根据纳入研究的数据特征,采用定性描述方法报告研究结果,同时报道研究结果的比值比(OR)和95%置信区间(CI)。
2 结果
2.1 文献筛选结果
通过数据库检索,获取1 229篇文献,按照纳入与排除标准进行逐层筛选,包括文献去重、阅读题目和摘要初筛、阅读全文复筛后,最终纳入7项研究,其中2篇[10-11]为系统评价/Meta分析、5篇[12-16]为经济学研究。文献筛选流程及结果见图1。
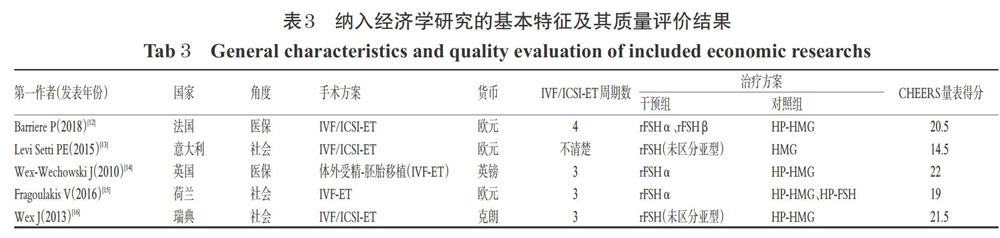
纳入系统评价/Meta分析研究的基本特征见表1,系统评价/Meta分析的质量评价结果见表2;纳入经济学研究的基本特征及其质量评价结果见表3。由于纳入的系统评价/Meta分析和经济学研究均为多项研究的二次分析,随着时间的推移,新的更加有力的研究证据不断涌现,越新的系统评价/Meta分析和经济学研究所得到的结论越具有说服力,因此本文评估时仅展示最新的系统评价/Meta分析结论,对经济学研究也按照纳入系统评价/Meta分析的发表时间选择纳入2010年后的文献。鉴于国内的系统评价/Meta分析质量不高,而经济学评价均只针对促排卵药品费用进行简单的比较分析,故未纳入国内的系统评价/Meta分析和经济学研究。
2.2 系统评价/Meta分析的结果
本文共纳入2项系统评价/Meta分析,其中Van Wely M等[10]的系统评价纳入的42项RCT中覆盖了Alinany HG等[11]的系统评价6项研究中的5项,未纳入的1项研究为回顾性研究。Van Wely M等[10]的系统评价几乎涵盖了已发表的所有相关RCT,且严格按照Cochrane 系统评价手册的原则进行了文献纳入与排除。考虑到发表年限及纳入研究的完整性,本文仅展示Van Wely M等[10]的系统评价的分析结果。
在Van Wely M等[10]的系统评价中,分别将活产率或持续妊娠率、OHSS发生率和临床妊娠率作为首要的结局指标,次要结局指标为累计的活产率或持续妊娠率、獲卵数、多胎妊娠率、流产率、Gn用量和Gn使用天数。每个结局指标中,rFSH与uFSH的比较分别按照rFSH与不同的uFSH药品(HP-HMG/HMG、P-FSH和HP-FSH)之间进行了比较;对不同降调方案(即下调垂体,抑制或减少自发性促黄体生成素激增的发生)——GnRH拮抗剂(GnRH-ant)方案、GnRH激动剂(GnRH-a)长方案 、GnRH-a短方案、无降调方案之间进行了比较;对不同移植周期(鲜胚移植周期和鲜胚+冻融胚胎移植周期)之间进行了比较以及对这些FSH产品的不同生产厂家赞助——默克雪兰诺(Serono)、欧加农(Organon)、辉凌制药(Ferring)、伊伯萨生化研究股份有限公司(IBSA)和无赞助商之间进行了比较。对于生产厂家,考虑到可能存在其对各自公司产品的倾向性,因此本研究只通过描述不同uFSH产品、不同降调方案和不同移植周期之间的各结局指标来进行rFSH和uFSH的组间比较(由于部分研究不涉及,故并非所有指标均报道了组间比较结果)。
2.2.1 活产率或持续妊娠率 活产率或持续妊娠率是Van Wely M等[10]系统评价中的首要结局指标。纳入的文献中活产率的定义为每个妇女1个或多个分娩活产婴儿;如果文献未报告活产,则选择妇女超过20周的持续妊娠率进行统计。
结果显示,按照uFSH产品的不同,rFSH组和uFSH组的活产率或持续妊娠率比较差异无统计学意义[OR=0.97,95%CI(0.87,1.08),P>0.05]。其中,rFSH组与HP-HMG/HMG组比较显示,前者的活产率(或持续妊娠率)显著低于后者,差异有统计学意义[OR=0.84,95%CI(0.72,0.99),P<0.05];而rFSH组与P-FSH组[OR=1.26,95%CI(0.96,1.64),P>0.05],与HP-FSH组[OR=1.02,95%CI(0.86,1.22) P>0.05]比较,差异均无统计学意义。
按照降调方案的不同,rFSH组和uFSH组的活产率或持续妊娠率比较差异无统计学意义[OR=0.97,95%CI(0.87,1.08) P>0.05]。其中,使用GnRH-ant方案[OR=0.88,95%CI(0.53,1.45) ,P>0.05]、使用GnRH-a长方案[OR=0.98,95%CI(0.87,1.10),P>0.05]、使用GnRH-a短方案[OR=0.84,95%CI(0.54,1.31),P>0.05]、无降调方案[OR=1.17,95%CI(0.62,2.20 ,P>0.05] 的rFSH组和uFSH组比较,差异均无统计学意义。
按照移植周期的不同,rFSH组和uFSH组的活产率或持续妊娠率比较差异无统计学意义[OR=0.99,95%CI(0.88,1.10),P>0.05]。其中,新鲜胚移植周期[OR=0.97,95%CI(0.85,1.11),P>0.05]、鲜胚+冻融移植周期[OR=0.97,95%CI(0.84,1.22),P>0.05]的rFSH组和uFSH 组比较,差异均无统计学意义。
2.2.2 OHSS发生率 OHSS是Van Wely M等[10]系统评价中的首要安全性结局指标。
结果显示,按照uFSH产品的不同,rFSH组和uFSH组的OHSS发生率差异无统计学意义[OR=1.18,95%CI(0.86,1.61),P>0.05]。其中,rFSH组与HP-HMG/HMG组[OR=1.00,95%CI(0.58,1.71),P>0.05]、与P-FSH组[OR=1.79,95%CI(0.89,3.62),P>0.05]、与HP-FSH组[OR=1.11,95%CI(0.70,1.75),P>0.05]比较,差异均无统计学意义。
按照降调方案的不同,rFSH组和uFSH组的OHSS发生率比较差异无统计学意义[OR=1.18,95%CI(0.86,1.61),P>0.05]。其中,使用GnRH-ant方案[OR=1.00,95%CI(0.14,7.17),P>0.05]、使用GnRH-a长方案[OR=1.18,95%CI(0.86,1.62),P>0.05]的rFSH组与uFSH组比较,差异均无统计学意义。使用GnRH-a短方案和无降调方案的rFSH/uFSH组患者则无OHSS发生。
2.2.3 临床妊娠率 结果显示,按照uFSH产品的不同,rFSH组和uFSH组的临床妊娠率比较差异无统计学意义[OR=0.99,95%CI(0.91,1.09),P>0.05]。其中,rFSH组的临床妊娠率显著低于HP-HMG/HMG组[OR=0.85,95%CI(0.74,0.99),P<0.05],显著高于P-FSH组[OR=1.27,95%CI(1.01,1.60),P<0.05],差异均有统计学意义;而rFSH组与HP-FSH组比较,差异则无统计学意义[OR=1.05,95%CI(0.91,1.20),P>0.05]。
按照降调方案的不同,rFSH组与uFSH组的临床妊娠率比较差异无统计学意义[OR=0.99,95%CI(0.91,1.09),P>0.05]。其中,使用GnRH-ant方案 [OR=0.89,95%CI(0.55,1.43),P>0.05]、使用GnRH-a长方案[OR=1.00,95%CI(0.90,1.11),P>0.05]、使用GnRH-a短方案[OR=0.92,95%CI(0.70,1.21),P>0.05]、无降调方案[OR=1.23,95%CI(0.77,1.97),P>0.05]的rFSH组与uFSH组比较,差异均无统计学意义 。
按照移植周期的不同,rFSH组和uFSH组的临床妊娠率差异无统计学意义[OR=1.00,95%CI(0.91,1.10),P>0.05]。其中,鲜胚移植周期[OR=0.97,95%CI(0.88,1.07),P>0.05]、鲜胚+冻融移植周期[OR=1.16,95%CI(0.93,1.44),P>0.05]的 rFSH组和uFSH组比较,差异均无统计学意义。
2.2.3 多胎妊娠率 结果显示,rFSH组和uFSH组的多胎妊娠率(按每名妇女计)[OR=0.91,95%CI(0.76,1.09),P>0.05]、多胎妊娠率(按每次妊娠计)[OR=0.96,95%CI(0.78,1.18),P>0.05]比较,差异均无统计学意义 。
2.2.4 流产率 结果显示,rFSH组和uFSH组的流产率(按每名妇女计)比较,差异无统计学意义[OR=1.16,95%CI(0.93,1.44),P>0.05]。
2.2.5 其他结局指标 获卵数、Gn用量和Gn使用天数因为合并研究的数据有异质性,存在偏差,因此未进行合并效应量统计,仅就单个研究结果进行描述说明,结果发现rFSH组的获卵数显著多于uFSH组。
2.3 药物经济学的结果
共纳入5篇经济学研究[12-16]评价药物经济学效益。这些研究分别将rFSH和uFSH用于行IVF/ICSI-ET的不孕妇女进行促排卵治疗的成本-效果进行了分析。
3项研究[13,15-16]认为rFSH较uFSH更具经济性。其中1项研究[13]以获卵数为主要结局指标,仅根据使用的FSH的药品费用进行经济评估,虽然得出了rFSH单价比uFSH高的结论,但由于rFSH组的获卵数较uFSH组多,使用rFSH每获得1个卵子所花费的成本较uFSH低,因此总的治疗费用上rFSH比uFSH低。
1项研究[15]以德国进行的一项大型有代表性的观察研究来量化荷兰医疗保健环境中替代疗法的有效性,采用GnRH-a长方案进行促排卵治疗,以活产率为主要结局指标,比较rFSHα与HP-HMG/HP-FSH的经济性。在该项研究中,成本-效益主张通过意愿支付(WTP)与社会偏好相关联,最大限度地将预算分配给标准化单位的健康收益。研究结果显示,rFSHα的活产率显著高于HP-HMG和HP-FSH;每出生1个新生儿,rFSH的费用为15 674欧元,HP-HMG组的费用为17 636欧元,HP-FSH组的费用为16 878欧元。成本-效果可接受曲线分析显示,rFSHα组有72.5%的可能性低于成本-效果阈值(WTP=20 000欧元) 。因此与HP-HMG和HP-FSH相比,rFSHα更具成本-效果优势。
还有1项研究[16]以Van Wely M等[10]的系统评价为参考,分别纳入使用GnRH-a长方案和GnRH-ant方案的IVF/ICSI-ET治疗周期,采用最小成本分析法对rFSH和uFSH进行经济学评估。研究结果显示,两种FSH组的活产率差异无统计学意义[OR=0.82,95%CI(0.66,1.01),P>0.05],rFSH组的获卵数显著多于uFSH组,差异有统计学意义[OR=1.96,95%CI(1.02,2.90),P<0.05]。在模拟的3个鲜胚移植或冻融胚胎移植的IVF/ICSI-ET周期中,每名使用rFSH的患者可以节省2 767克朗(约相当于315欧元或411美元)[95%CI(1 580,4 057)]。虽然rFSH的药品费用高于HP-HMG/HMG(分别为8 468、7 917克朗),但前者除药品外的周期治疗成本低于后者(分别为31 795、35 112克朗)。
2项研究[12,14]认为HP-HMG更具经济学优势。其中1项研究[12]从法国医疗保险付款人的角度出发,通过建立Markov模型比较了rFSHα+rFSHβ和HP-HMG的成本-效果。研究者分别纳入了RCT[17-19]以及来自法国的一项调查研究[20]。结果表明,纳入的RCT中两种rFSH和HP-HMG比较,每获得1个额外的活产婴儿,将节省11 506欧元;模拟的30 000名患者则节省1 480万欧元。而纳入的调查研结果显示,每增加1个活产儿,HP-HMG的增量成本节省7 621欧元,整个虚拟队列节省840万欧元。Wex-Wechowski J等[14]的研究对Andersen AN等[17]和Plattea P等[21] 的2项研究的延伸进行成本-效果分析,只包含IVF周期,未纳入ICSI周期,来比较rFSHα组与HP-HMG组的经济性。HP-HMG的均次IVF费用为10 046英镑[95%CI(9 238,11 200)],rFSHα组的均次IVF费用为14 055英镑。与HP-HMG组相比,rFSHα组的IVF费用和新生儿费用的增量成本-效益为负值,提示HP-HMG更具成本-效果優势。
3 讨论
3.1 rFSH与uFSH的有效性和安全性
根据系统评价/Meta分析对rFSH与uFSH的比较结果来看,两组不管是妊娠率、流产率还是OHSS发生率均无显著差异,疗效和安全性相当。从获卵数来看,大多数的研究认为rFSH组的获卵数显著多于uFSH组。这可能是因为rFSH可促进次级窦前卵泡发育、颗粒细胞分裂,诱导产生芳香化酶并激活排卵前的颗粒细胞内的LH受体,同时使卵泡细胞膜分化,优化卵泡的募集和筛选[20-22]。Trew GH等[23]的研究认为,rFSH不仅获卵数多,也增加了可移植胚胎数。Zhu D等[24]的研究认为,因为rFSH的获卵数多,导致可移植胚胎数增多,增加了后续冻融胚胎移植的机会,可以更好地改善胚胎和子宫内膜发育之间的同步性,提高临床疗效。
3.2 rFSH与uFSH的经济性
对于rFSH的药物经济学研究显示,虽然有两项研究[12,14]显示HP-HMG较rFSH更具成本-效果優势,但这2项研究纳入的研究数明显少于其余3项研究[13,15-16],且前2项研究[12,14]纳入的研究中均有Anedrsen AN等[17]的研究,因此经济学研究结果类似。总体而言,从rFSH与其他几个uFSH比较的成本结果来看,rFSH更节省医疗成本,更具成本-效果优势。
3.3 本研究的局限性
由于本研究未纳入HTA报告,因此缺少HTA的相关分析结果;其次本研究为快速卫生技术评估,有效性和安全性均基于已发表的HTA报告和系统评价/Meta分析,一些最新的单个研究可能没有被纳入[25-26];此外本研究缺乏国内的经济学评估数据,因此仍需进一步针对我国不孕患者进行更多的经济学研究,以更好地为临床用药提供循证依据。
4 结语
基于目前已发表的证据,rFSH与uFSH的临床疗效和安全性均相当。经济学研究显示,与uFSH相比,rFSH可能更具成本-效果优势,但缺乏国内的相关数据,仍需进一步研究。因此,目前证据支持采用rFSH进行IVF/ICSI-ET促排卵治疗。
参考文献
[ 1 ] 孙文希,胡凌娟.国内外不孕不育症现状及我国的干预策略探讨[J].人口与健康,2019(12):19-22.
[ 2 ] 黄荷凤.使用人类辅助生殖技术[M].北京:人民卫生出版社,2017:3-209.
[ 3 ] 毕晓英,王丹丹,赵瑞钦.体外受精-胚胎移植中三种不同的促排方法临床疗效和经济性的比较分析[J].生殖医学杂志,2013,22(7):509-513.
[ 4 ] Practice Committee of American Society for Reproductive Medicine Birmingham Alabama. Gonadotropin preparations:past,present,and future perspectives[J]. Fertil Steril,2008,90(suppl5):S13-S20.
[ 5 ] SCOBEY MJ,RAIKE E,MARSHALL DC. Mixed protocols:multiple ratios of FSH and LH bio-activity using highly purified,human derived FSH(BRAVELLE)and highly purified hMG(MENOPUR)are unaltered by mixing together in the same syringe[J]. Reprod Biol Endocrinol,2005. DOI:10.1186/1477-7827-3-61.
[ 6 ] 唐惠林,门鹏,翟所迪.药物快速卫生技术评估方法及应用[J].临床药物治疗杂志,2016,14(2):1-4.
[ 7 ] 熊俊,陈日新.系统评价/Meta分析方法学质量的评价工具AMSTAR[J].中国循证医学杂志,2011,11(9):1084- 1089.
[ 8 ] DON H,MICHAEL D,STARVROS P,et al. Consolidated Health Economic Evaluation Reporting Standards(CHEERS) statement[J]. BMC Medicine,2013,11(1):80-85.
[ 9 ] 周义湘,张苏菡,崔志强等.棕榈酸帕利哌酮药物经济学系统评价[J].中国现代医生,2018,56(31):95-99.
[10] VAN WELY M,KWAN I,BURT AL,et al. Recombinant versus urinary gonadotrophin for ovarian stimulation in assisted reproductive technology cycles:reviews[J]. Cochrane Database Syst Rev,2011. DOI:10.1002/14651858.CD005354.pub2.
[11] ALINANY HG,GELDER PV. Effect of urinary versus recombinant FSH on clinical outcomes after frozen-thawed embryo transfers:a systematic review[J]. Reprod Biomed Online,2010,21(2):151-158.
[12] BARRIERE P,PORCU-BUISSON G,HAMAMAH S.Cost-effectiveness analysis of the gonadotropin treatments HP-hMG and rFSH for assisted reproductive technology in France:a markov model analysis[J]. Appl Health Econ Health Policy,2018,16(1):65-77.
[13] LEVI SETTI PE,ALVIGGI C,COLOMBO GL,et al. Human recombinant follicle stimulating hormone(rFSH)compared to urinary human menopausal gonadortopin(HMG) for ovarian stimulationin assisted reproduction:a literature review and cost evaluation[J]. J Endorinol Invest,2015,38(5):497-503.
[14] WEX-WECHOWSKI J,ABOU-SETTA AM,NIELSEN SK,et al. HP-HMG versus rFSH in treatments combining fresh and frozen IVF cycles:success rates and economic evaluation[J]. Reprod Biomed Online,2010,21(2):166- 178.
[15] FRAGOULAKIS V,PESCOTT CP,SMEENK JMJ,et al. Economic evaluation of three frequently used gonadotrophins in assisted reproduction techniques in the management of infertility in the Netherlands[J]. Appl Health Econ Health Policy,2016,14(6):719-727.
[16] WEX J,ABOU-SETTA AM. Economic evaluation of highly purified human menopausal gonadotropin versus recombinant human follicle-stimulating hormone in fresh and frozen in vitro fertilization/intracytoplasmic sperm-injection cycles in Sweden[J]. Clinicoecon Outcomes Res,2013. DOI:10.2147/CEOR.S48994. eCollection 2013.
[17] ANDERSSEN AN,DEVROEY P,ARCE JC. Clinical outcome following stimulation with highly purified hMG or recombinant FSH in patients undergoing IVF:a randomized assessor-blind controlled trial[J]. Hum Reprod,2006,21(12):3217-3227.
[18] ZIEBE S,LUNDIN K,JANSSENS R,et al. Influence of ovarian stimulation with HP-HMG or recombinant FSH on embryo quality parameters in patients undergoing IVF[J]. Hum Reprod,2007,22(9):2404-2413.
[19] DEVROEY P,PELLICER A,ANDERSEN AN,et al. Me- nopur in GnRH antagonist cycles with single embryo transfer(MEGASET) trial group:a randomized assessor-blind trial comparing highly HMG and recombinant FSH in a GnRH antagonist cycle with compulsory single-blastocyst transfer[J]. Fertil Steril,2012,97(3):561- 571.
[20] TROUDE P,BAILLY E,GUIBERT J,et al. Who does not participate in a follow-up postal study:a survey of infertile couples treated by in vitro fertilization[J]. BMC Med Res Methodol,2012. DOI:10.1186/1471-2288-12-104.
[21] PLATTEA P,ALBANO C,SORENSEN P,et al. Exogenous luteinizing hormone activity may influence the treatment outcome in in vitro fertilization but not in intracytoplasmic sperm injection cycles[J]. Fertil Steril,2004. DOI:10.1016/j.fertnstert.2003.09.077.
[22] 張梦苑,卫茂玲,耿丽红,等.高纯度人尿促卵泡素与基因重组促卵泡素对超促排卵周期影响比较的Meta分析[J].中国全科医学,2015,18(29):3613-3618.
[23] TREW GH,BROWN AP,GILLARD S,et al. In vitro fertilisation with recombinant follicle stimulating hormone requires less IU usage compared with highly purified human menopausal gonadotrophin:results from a European retrospective observational chart review[J]. Reprod Biol Endocrinol,2013,8(8):137-148.
[24] ZHU D,ZHANG J,CAO S,et al. Vitrified-warmed blastocyst transfer cycles yield higher pregnancy and implantation rates compared with fresh blastocyst transfer cycles:time for a new embryo transfer strategy?[J]. Fertil Steril,2011,95(5):1691-1695.
[25] 唐惠林,门鹏,翟所迪.司维拉姆治疗透析患者高磷血症的快速评估[J].药物流行病学杂志,2017,26(5):302- 308.
[26] 钱晨月,张晶晶,谢林俊,等.替罗非班治疗急性冠状动脉综合征的快速卫生技术评估[J].中国药房,2020,31(15):1891-1895.
(收稿日期:2020-07-16 修回日期:2020-09-06)
(编辑:刘明伟)

