MassARRAY质谱分析脑胶质瘤6个基因11个突变位点的方法建立与应用
赵焕英 隋雷鸣 王俐勇 付文卓 赵君朋
(首都医科大学中心实验室基因组学研究平台,北京 100069)
脑胶质瘤是中枢神经系统最常见的恶性肿瘤,每年新发病例超越14000例。近几年,脑瘤分子标记物检测逐渐得到重视和开展,并为疾病诊断、预后的估判、及治疗方法选取提供有力信息支持,极大推进了原有的单纯组织病理学分类方法。其中胶质瘤相关基因中异柠檬酸脱氢酶1(Isocitrate dehydrogenase 1,IDH1)、异柠檬酸脱氢酶2(Isocitrate dehydrogenase 2,IDH2)基因突变易发生在年轻胶质瘤患者、少突胶质细胞瘤及混合性胶质瘤,IDH1/2突变的患者预后相对较好[1-3]。组蛋白h3.3和h3.1基因(H3F3A和HIST1H3B)的点突变在小儿弥漫性中线胶质瘤中发生率高达80%,其中在小儿弥漫性高级星形细胞瘤中,组蛋白H3.3基因H3F3A K27M 突变率高于 G34R/V,H3K27M 突变治疗反应差,生存率低,因此K27M分子可作为鉴别诊断的标准分子之一[4-6]。BRAFV600E和TERT启动子区域突变常分别在低分级和高分级别神经胶质瘤中发生[7],BRAFV600E突变在上皮样胶质母细胞瘤中占比达50%,而在其他类型神经母细胞中极少有BRAF的突变,BRAF突变肿瘤侵袭性强,同时也可望成为治疗的靶点[8]。TERT启动子突变是最常见的单基因成人弥漫性胶质瘤的突变类型,TERT启动子区-124和-146位点常发生C228T和C250T突变类型,对胶质瘤亚型分类有高度特异性,是弥漫性胶质瘤的诊断指标[9]。通过文献查阅,针对以上突变位点的检测,通常采用免疫组化、一代测序及焦磷酸测序的方法,时间长,成本贵。本实验旨在建立MassARRAY 质谱分析方法同时检测这些位点,为疾病的诊断和治疗提供可行性信息。
1 实验材料与方法
(1)实验材料:
40例人脑胶质瘤石蜡组织包埋标本,正常人外周血液样本为阴性对照,生理盐水空白对照。
(2)主要试剂与仪器:
蛋白酶K(Merk),核酸提取试剂盒、Lab-Aid 824核酸提取自动提取仪(厦门至善生物科技有限公司);紫外分光光度计(IMPLEN);QIAxcel Advanced 毛细管电泳仪(Qiagen);一代测序仪3730(ThermoFisher);聚合酶链式反应试剂盒、MassARRAY清洁树脂、iPLEX Pro Reagent Kit、MassARRAY Analyzer 4 System 384cpm质谱分析仪(Agena);振荡混悬仪(Eppendorf);Allegra 25R台式冷冻离心机(Beckman);LightCycler480荧光定量PCR仪(Roche)。
2 实验方法
2.1 石蜡样本DNA提取
石蜡样本经二甲苯脱蜡处理后行蛋白酶K 消化至液体状,于Lab-Aid 824仪器上进行核酸自动提取,方法参见文献[10]。
2.2 6个基因11位点的检测引物准备
通过检索Pubmed 数据库,结合国内外研究进展,统计胶质瘤相关基因突变位点,确定6个候选基因11个位点如下:IDH1-132(rs121913500)、IDH2-172(rs121913503)、IDH2-140(rs121913502)、TERT(-245,rs2853669)、TERT(-124)、TERT(-146)、H3.1-27、H3.3-27(rs1057519902)、H3.3-34(rs1057519903)、H3.3-33、BRAF-600。gene数据库中下载6个基因组序列,标注目的突变位点,选取突变位点前后约200bp碱基序列,编辑引物设计文档。利用Agena BioScience软件设计扩增引物8对,位点延伸引物11条,延伸引物设计位于突变位点前一个碱基,与扩增产物互补进行单碱基延伸反应,见表1。根据延伸引物及后续单碱基分子量不同,把11个检测位点分成2组见表2,每组分别配置每条引物浓度为0.5 μmol·L-1多重PCR反应的混合引物。
2.3 MassARRY反应体系
a)多重PCR反应:每个样品配置反应体系5 μL,其中浓度为10×PCR缓冲液0.5μL、MgCl2(25 mmol·L-1)0.4 μL、dNTPs(25 mmol·L-1)0.1 μL、PCR 热启动酶(5 U·μL-1)0.2 μL、扩增引物混合液1μL、基因组DNA(10 ng·μL-1)1μL,超纯水补足至5μL。在兼容384孔板的PCR仪上,进行扩增反应。PCR反应条件:95℃预变性2 min;95℃20 s,56℃30 s,72℃ 60 s,共45个循环:72℃再延伸3 min。
b)PCR产物碱性磷酸酶(SAP)处理:PCR反应结束,向384 孔反应孔中加入2μl SAP 反应混合液,密封反应孔,于PCR仪上运行程序:37℃ 40 min,85℃ 10min。
c)单碱基延伸反应:在384 孔中加入2μL 单碱基延伸混合液及引物,进行单碱基延伸反应,反应条件为:94℃ 10min;94℃30 s,56℃30s,72℃1 min,72℃3 min;4℃保存。
2.4 质谱检测及分析
在384 孔中加入16μL 去离子水与6mg树脂,按操作说明书进行脱盐处理;后利用MassARRAY Nanodispenser RS 1000点样仪转移至384孔芯片上,自然干燥后上机,运行MALDI-TOF质谱程序,采用MassARRAY TYPER4.1软件(Agena)进行基因型判读。
3 结果与讨论
3.1 多重PCR引物的筛选
MassARRAY原理为基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)技术。主要特点是:PCR扩增后的产物,加入SNP序列特异延伸引物,在 SNP 位点上,延伸 1个碱基。然后将制备的样品分析物与芯片基质共结晶,后置入质谱仪的真空管,于瞬时纳秒(10-9s)强激光激发,基质分子经辐射吸收能量,使基质晶体升华,核酸分子就会解吸附并转变为亚稳态电荷离子,离子在加速电场中获动能,按照其质荷比率加以分离,离子飞行时间与离子质量成反比。通过检测离子在真空管飞行到检测器的时间精确物质分子量,从而检测出SNP位点信息,基于飞行管长度限制,MassARRAY SNP 检测的分子量范围为5000~8500 Dalton。检测基于多重PCR方法,一管反应体系中引物数量多,这要求引物间避免互补,尤其需绝对避免延伸引物3’端与其他引物有超过3个碱基的互补。否则易造成非特异延伸,出现错误检测结果。为了保证PCR扩增效率,PCR扩增产物长度一般不超200bp,还需遵循其他PCR引物设计原则(避免形成二聚体/错配等)[11]。利用Agena BioScience软件筛选出的8对扩增引物,扩增片段长度在71bp~121bp之间,如表1。引物前端添加与人类基因无关的标签序列ACGTTGGATG,目的增加引物分子量使其大于8500Da,超过质谱检测限,避免对延伸引物及产物产生干扰。

表1 6个基因的11个待检位点的扩增引物序列信息
3.2 延伸引物及分子量范围
根据延伸引物及延伸一个碱基后分子量不同,基质辅助激光解吸后电离飞行到检测器的时间不同,分子质量小的先到达,质谱峰先出现。11个位点的延伸引物信息如表2,第1组5个位点组合,分子量范围为4844.2Da~7923Da;第2组6个位点组合,分子量范围为4833.1Da~8367.3Da。
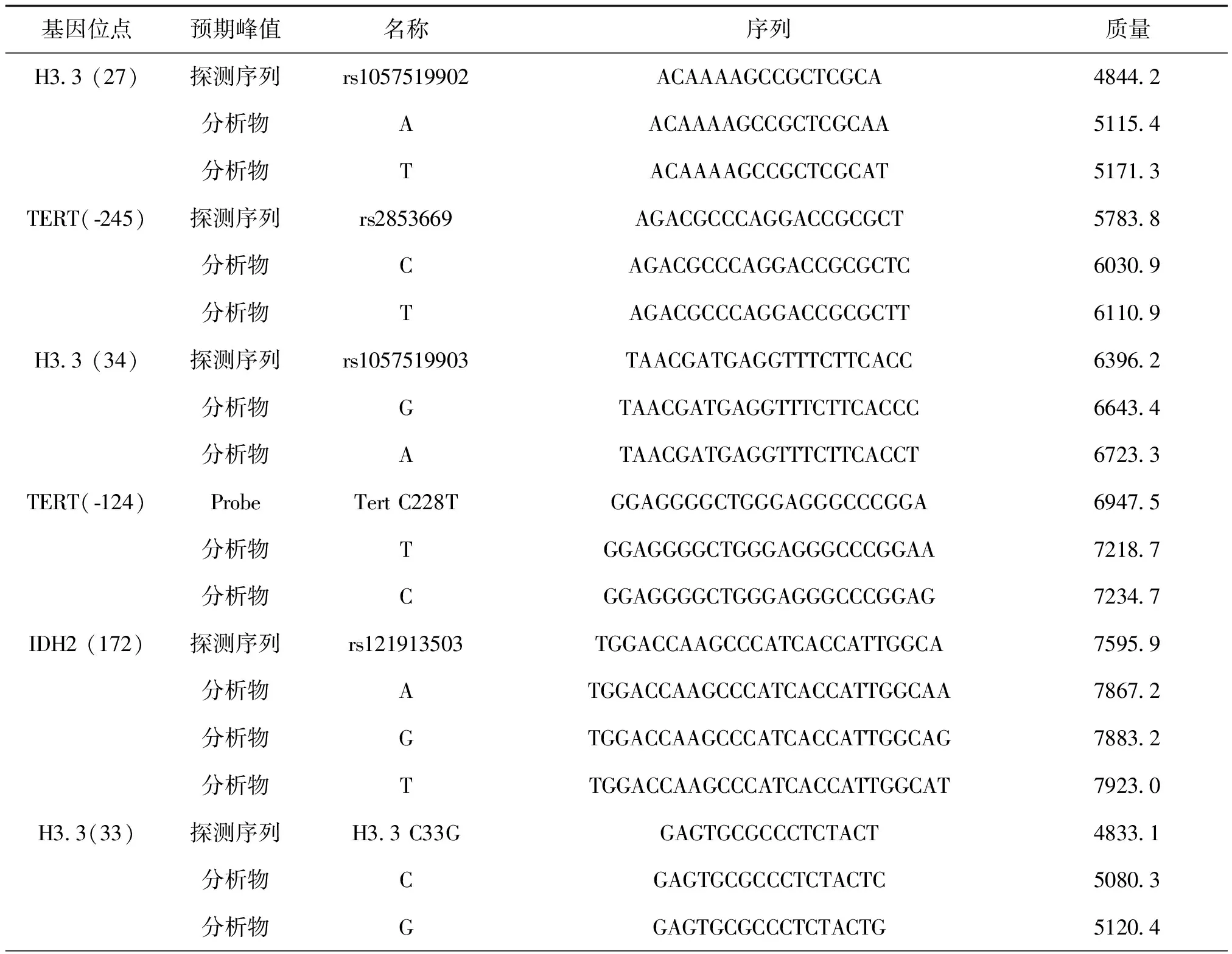
表2 11个待检位点的延伸引物及产物序列信息
3.3 两组突变位点的质谱检测
每个样品经过两组多重PCR扩增及延伸反应后,分别在芯片上进行点样,激光解吸后电离。图1是第1组前5个位点的质谱分离图,可以看出延伸后的分子量从5115.4Da~7923Da 之间;图2是第2组后6个位点质谱分离图,分子量在5080.3Da~8367.3Da区域。在质谱图上,每种颜色区域是一个基因位点的检测区域,根据出现的野生型和突变型的峰面积数据,能够定量判读突变比率。
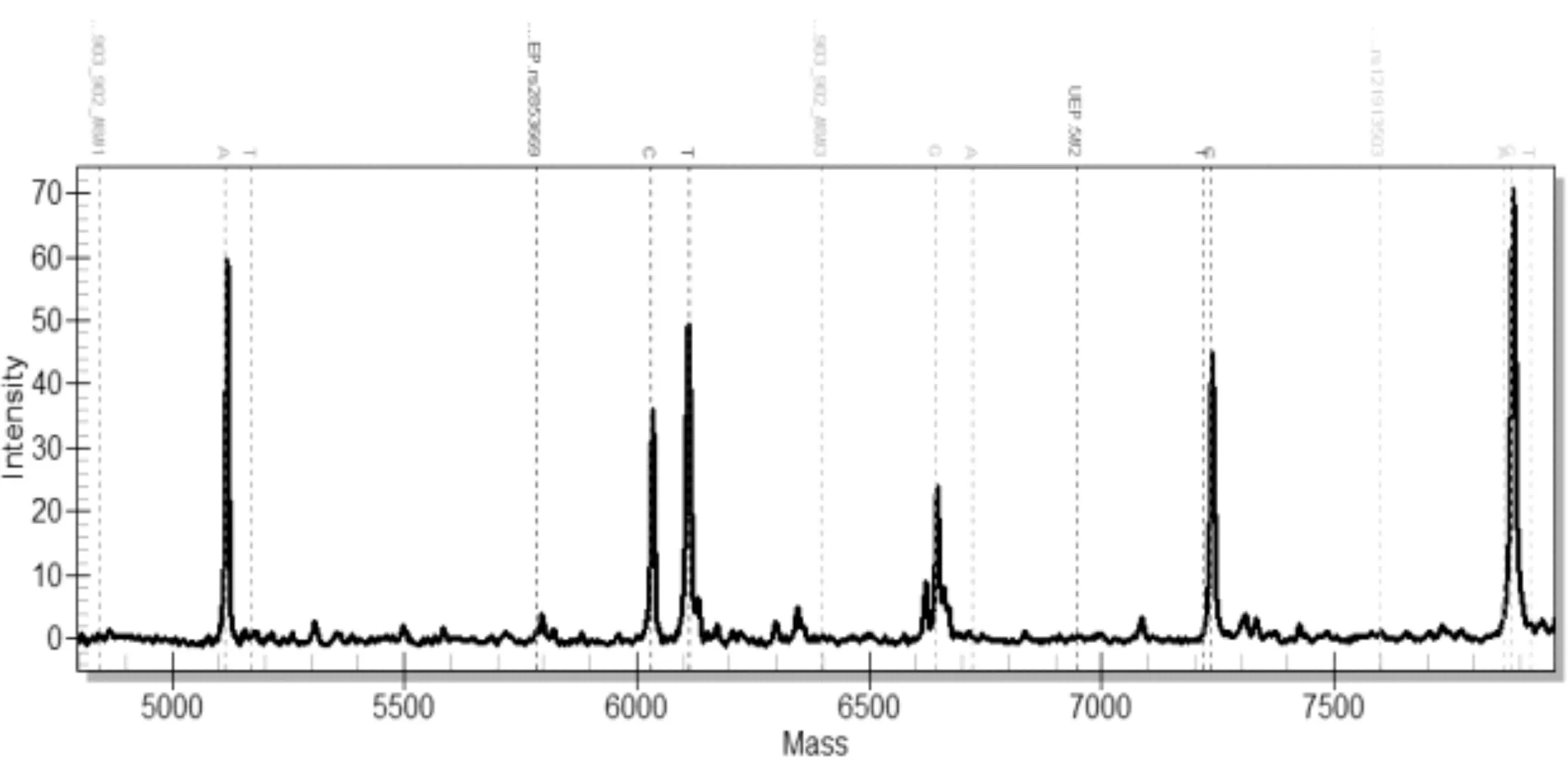
图1 前5个基因突变位点的质谱图型
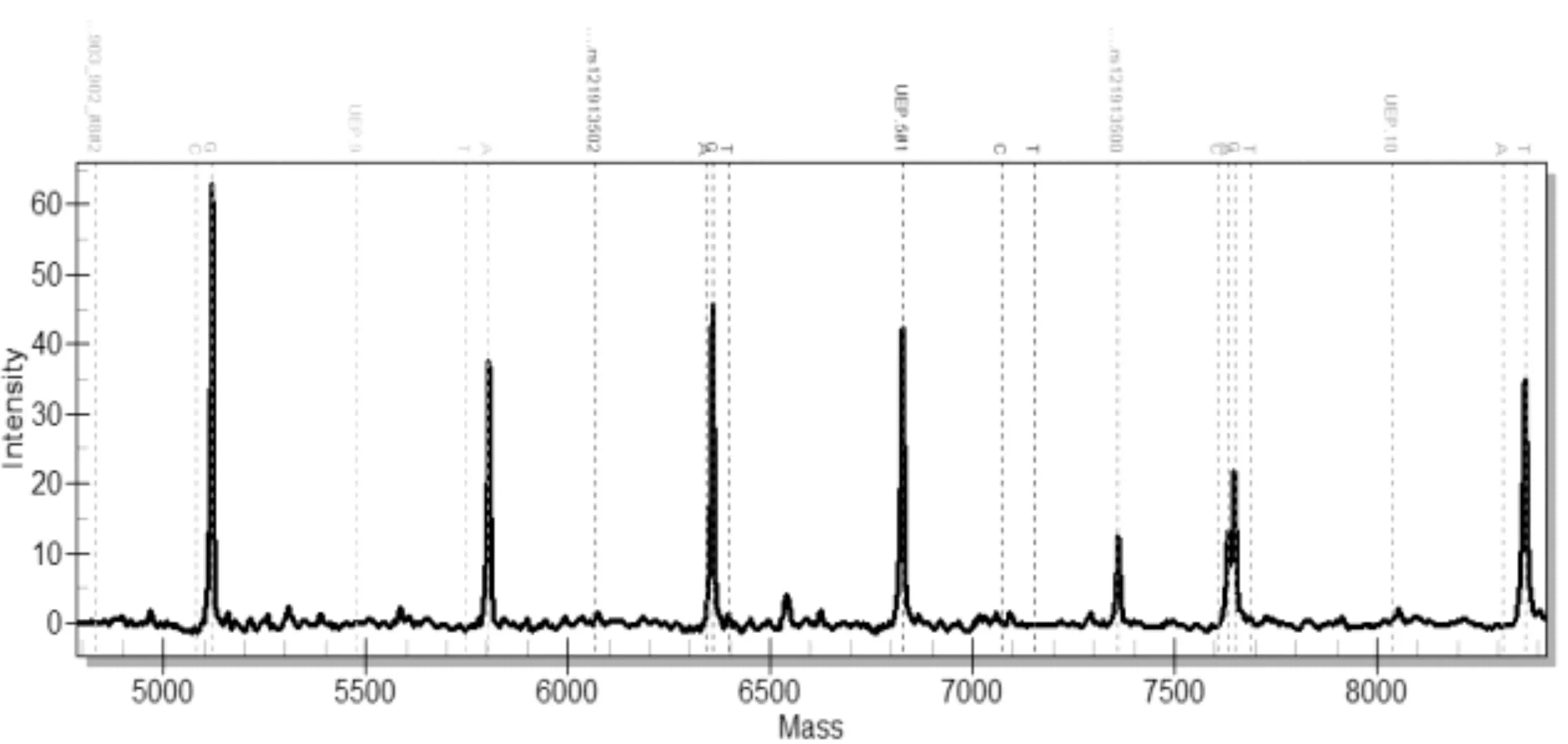
图2 后6个基因突变位点质谱图型
3.4 与一代测序结果比较
一代测序技术是荧光标记测序法,仪器通过检测ddNTP上的荧光来读取所测序列,荧光染料会干扰测序引物相邻的几十个碱基信号,导致无法读出序列,加之引物本身不含荧光,都是没信号的部分,这也要求设计引物时引物序列需距检测的目标位点最少60bp以上;且测序前需纯化回收PCR片段,为了保证回收效率,扩增的PCR片段长度不易低于200bp。与MassArray技术不同,引物前无需加标签序列,其他仍需遵循引物设计原则。两种技术检测结果见表3,突变位点检测一致率为96.4%,有2例样本1号和2号分别在H3.3和IDH1两个指标检测中结果不一致。如图3、图4是1号样本两种方法检测结果,从质谱图上可见H3.3(27)这个位点发生了A/T突变,分子量在5171.3处的T峰面积约为13,分子量5114.4处的A峰面积约为125;而图4一代测序所示无突变。同样图5、图6是2号样本检测结果,图5 质谱图上显示IDH1(132)位发生A/G碱基突变,A峰面积约84,G峰面积324,根据峰面积可计算突变比率;图6箭头所示背景峰高,无法判断是否发生突变。表4示40例样本在IDH1和H3.3两个位点检测结果比较,可知MassARRAY灵敏度能达100%,与一代测序检测的真阴性数据相比62/64,特异度约97%。造成这种差异的原因与一代测序技术灵敏度低,大于20%以上的突变才能被检测到有关[12]。测序反应的信号强弱除与模板量有关,还与同一位置不同碱基信号强度不同有关;这会导致即使突变的模板所占的比例较高时,也不一定能准确检测到突变的存在。另外,测序仪软件对扫描结果处理时,一般会将信号弱的峰做为背景信号处理,进一步压低弱的峰,提高主峰,因此对低含量的突变不易检测,高含量突变检测到也不能定量判读。且高GC、重复序列,复杂二级结构的DNA片段对一代测序是个巨大挑战,普通PCR条件很难扩增出单一目的条带,需利用高效热启动酶,梯度PCR程序及多对引物优化才能扩增出目的条带[13,14],测序时需添加变性剂优化测序信号。质谱方法中因扩增的PCR片段短,可避开一些复杂二级结构;延伸引物只需延伸一个碱基后进行质谱鉴定其分子量。另外 MassARRAY 系统反应体系为非杂交依赖性,不存在潜在的杂交错配干扰,无需各种标记。与芯片技术和质谱技术结合,使得它具备高度特异性、灵敏度和高精确度[15]。能够以快速精确的进行基因型识别,直接测出带有SNP 或其他突变的目标DNA[16]。
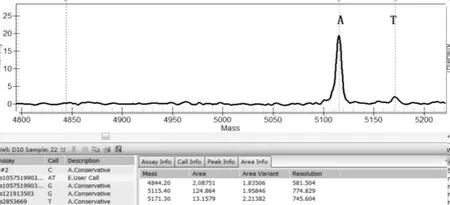
图3 MassARRAY检测1号样本H3.3-27位点A/T 突变
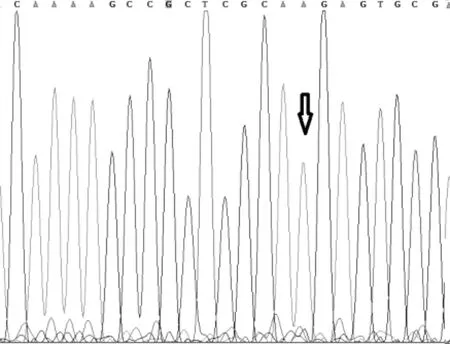
图4 一代测序检测1号样本H3.3-27位点的结果
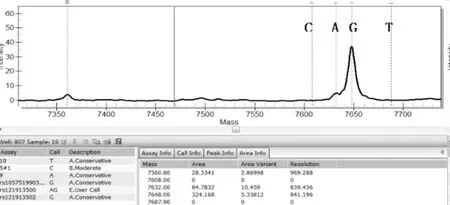
图5 MassARRAY 检测到的2号样本IDH1-132位点A/G突变
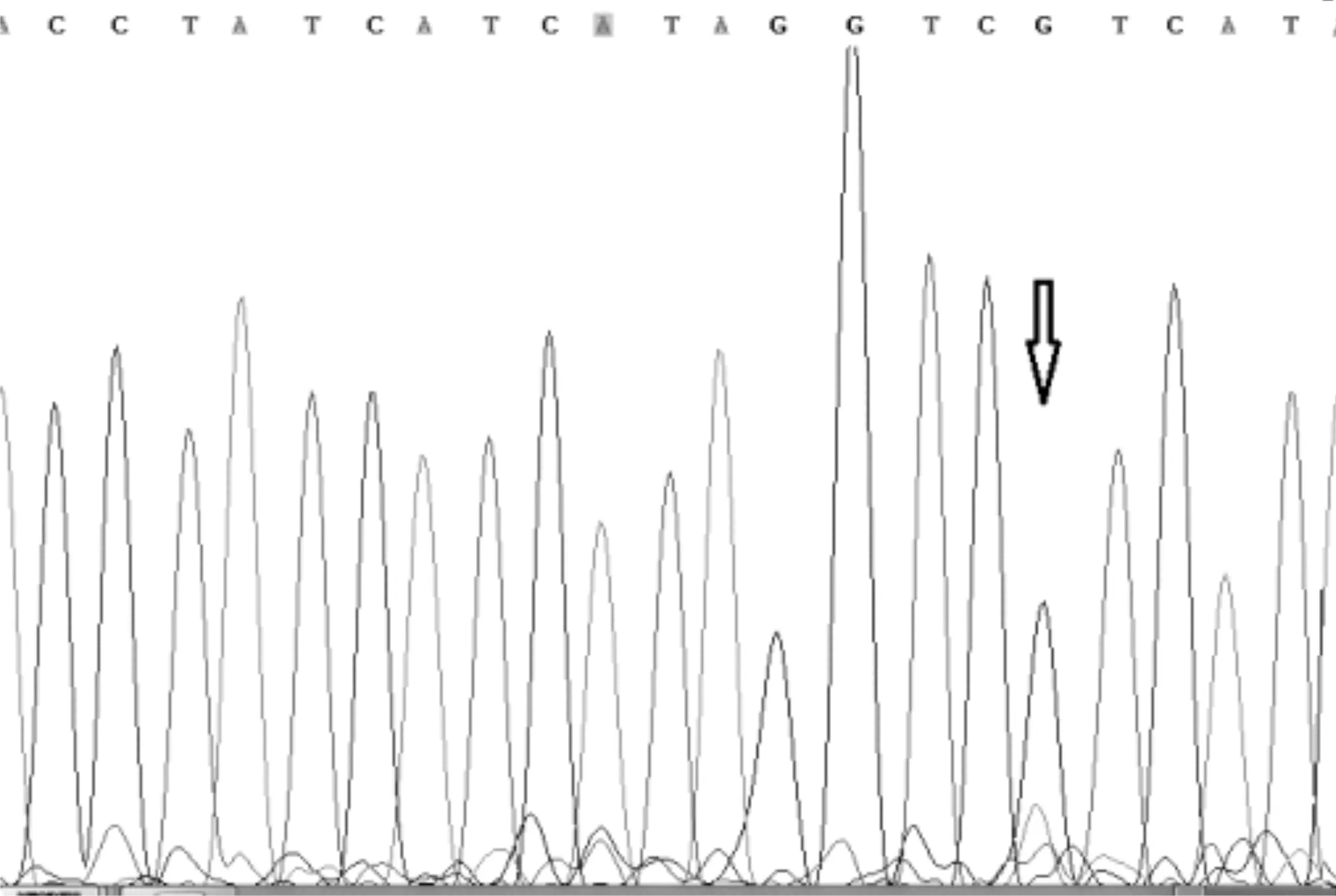
图6 一代测序检测2号样本IDH1-132结果
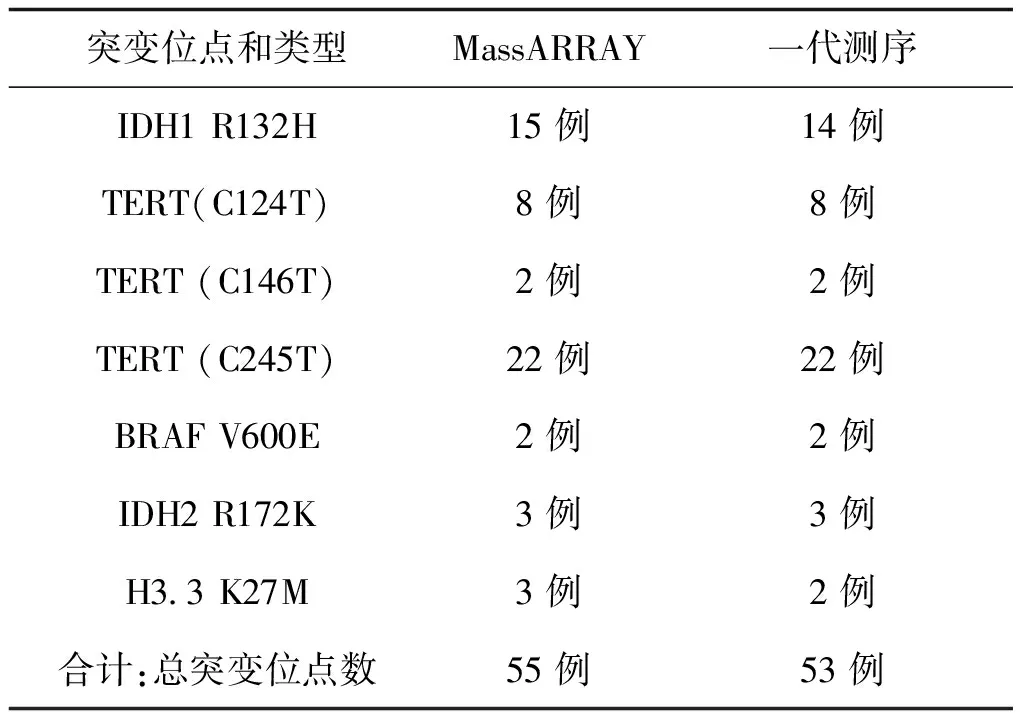
表3 MassARRAY 和一代测序对40例样本检测结果
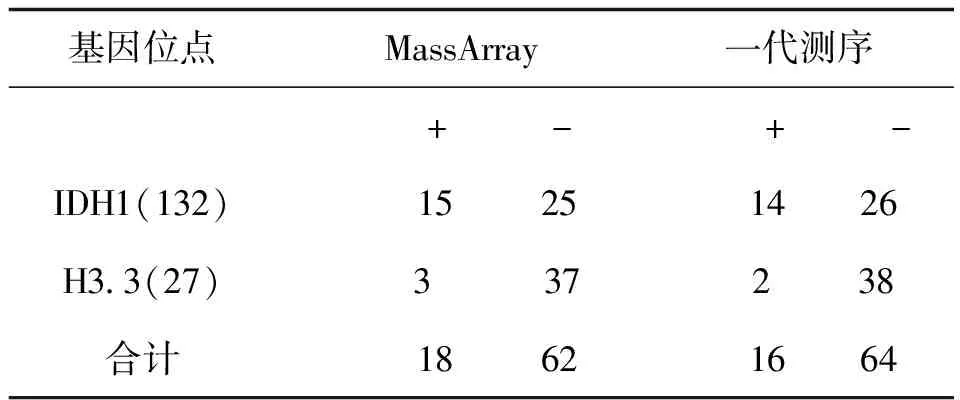
表4 40例样本IDH1和H3.3 两种测方法比较
4 结论
目前脑胶质瘤的病理分级和分型,常采用的是免疫组化或一代测序方法进行突变检测;在临床基因检测方面,因多个单基因分次检测的复杂性和穿刺等来源标本总量不足,成为多基因同时检测的限制因素。基于二代测序平台的高通量检测也因建库、测序及分析等专业化及价格贵还不能普及应用于临床检测。MassARRY技术通过扩增延伸反映与质谱技术结合,只需10ng DNA 样本可理论上就可实现多达40个基因同时检测,无需荧光标记;而一代测序需要每个基因单独扩增,极大增加了检测样本量和成本。MassARRY在定量分析基因突变检测中检测基因数量,除受基因分子量影响,也受PCR扩增引物及引物增加的多个碱基前缀影响,尚需多次尝试多对引物组合,建立合适的基因配伍检测集合。

