高效液相色谱-串联质谱法检测干血点样品中25-羟基维生素D2和25-羟基维生素D3的方法
高 洁 李 静 王 刚 文 婷 卢晓宇*
(1.陕西博荟精准医疗科技有限责任公司,西安710000;2.陕西友谊医学检验实验室,西安710000)
1 引言
维生素为结构上互不相关的一组化学物质,人体内可分为脂溶性维生素和水溶性维生素。维生素D是体内重要的营养素,维生素D本身不具备生理功能,只有转变为活性形式才能发挥生理活性。维生素D的主要活性形式有:25(OH)D2/D3、1,25-(OH)2D2/D3、24,25-(OH)2D2/D3等。维生素D摄入后首先经过肝脏活化成25(OH)D2/D3进入循环系统,部分单羟基VD进入肾脏活化为活性更强但半衰期更短的1,25-(OH)2D2/D3。由于双羟基VD在血液中稳定性差且含量极少,一般不推荐作为临床检验的检测指标。维生素D各种活性形式在人体肌肉与骨骼系统、免疫系统、肾脏系统、神经系统、心血管系统等发挥着类激素效应,最近的研究显示, 维生素D缺乏还与肿瘤、心血管疾病、自身免疫性疾病、糖尿病等慢性疾病相关[1, 2]。
维生素D的过量或缺乏都会导致健康问题的发生:缺乏可能会导致儿童佝偻病,成人骨软化,增加继发性甲状旁腺功能亢进、骨密度降低、骨折、糖尿病、心血管疾病、自身免疫学疾病、肾脏疾病等发病风险;孕妇增加妊娠糖尿病、先兆子痫、细菌性阴道炎、产后及绝经后妇女骨质疏松风险,影响新生儿智力发育。过量可能会导致高钙血症、肌无力头痛、厌食、呕吐、骨痛、异位性钙化、蛋白尿、高血压和心律失常;儿童过量补充导致小儿骨髓过早形成,生长停滞。其中,儿童、孕产妇及老年人是维生素D缺乏的高危人群。有研究表明,孕产妇维生素D缺乏率可高达75%以上[3]。
目前,检测维生素D的方法有免疫法、放射免疫法、液相色谱法以及液相色谱-串联质谱联用法等。美国内分泌学会推荐采用25(OH)D水平评价患者体内的维生素D状况,不推荐使用血清1,25-(OH)2D2/D3检测评价维生素D缺乏,仅在监测特定情况如获得性和遗传性维生素D和磷酸盐代谢紊乱时应用。随着LC-MS/MS分析灵敏度的提高,已经可以同时测量25(OH)D2和25(OH)D3,由于检测更加准确、稳定,被认为是检测维生素D的金标准[4]。
目前,多篇文章报道了有关血液样本测量25(OH)D2和25(OH)D3的检测方法,脂溶性维生素A、E、K、D联检的方法也有报道。但是,这些检测方法前处理比较繁琐,血液样本在运输途中十分不便,样本用量大,信号灵敏度不够。本文方法通过专用的干血点(DBS)样本,通过分析物衍生过程,增强了分析物在电喷雾正离子源(ESI+)中的离子化效率,提高检测的灵敏度,从而降低了样本用量和试剂使用量。只要需要一个8mm孔径大小的全血DBS样本;使用0.3%甲酸甲醇溶液进行超声提取分析物。简化了样本前处理过程,提高检测的灵敏度。分析物通过超高效液相-串联质谱平台检测降低了系统误差,使用同位素内标消除基质效应,同时增加了被检测物质信号信噪比,从而更准确稳定测量DBS中25(OH)D2和25(OH)D3含量。
DBS采样法方便快捷,只需要将全血滴在专用的干血片滤纸上。与常规采样相比有不受时间、地点、储存及运输方便的优势。同时样本的储存过程的稳定性大大提高。这样DBS样本在疾病筛查中的优势逐渐凸显出来。
本研究基于LC-MS/MS 与自动化液体处理平台联用, 建立了一种样本消耗量低、准确、灵敏、快速检测DBS 样本中25(OH)D2和25(OH)D3的方法。
2 实验及方法
2.1 仪器、试剂与材料
日本岛津8050CL液相色谱-串联质谱联用仪,岛津C18柱(50 mm×2.1 mm, 日本岛津公司); Whatman 903 CF12 滤纸(美国GE 公司); 96 通道氮吹仪(上海巴玖实业有限公司); 96孔样品板(单孔容积450 微升)、标准品25(OH)D2(纯度95%,江苏豪思生物)、标准品25(OH)D3(纯度98%,江苏豪思生物); 稳定同位素内标25(OH)D2-D6(纯度≥95%, 江苏豪思生物); 稳定同位素内标25(OH)D3-D3(纯度≥98%, 江苏豪思生物); 4-苯基-1,2,4-三唑啉-3,5-二酮(PTAD, 纯度≥98%, 美国Sigma-Aldrich 公司); 甲酸铵(纯度≥98%, 美国Fisher公司); 甲酸(FA)、乙睛、甲醇(HPLC级, 美国Fisher公司); 无水乙醇(HPLC级,美国Fisher公司)、乙酸乙酯(HPLC级,美国Fisher公司); 10×PBS 缓冲液(pH 7.4, 美国Thermo Fisher 公司);全血样本采自友谊检验所各业务医院。
工作试剂的配制:分别将标准品25(OH)D2和25(OH)D3按照江苏豪思生物试剂盒配比浓度配置,试剂盒稳定同位素内标25(OH)D2-D6 和25(OH)D3-D3-80℃保存备用,使用时根据需要取配制成所需浓度的工作液。准确称取适量的PTAD, 溶于乙酸乙酯中, 制成0.2 mg/mL 的PTAD溶液。
2.2 DBS样本采集
样本来自于陕西省友谊实验室各业务医院。医院采样标准:1岁以内婴儿采用足跟采血、1岁以上儿童采用指尖采血。用一次性采血针(推荐规格:21G23G)刺中指或无名指指尖或者新生儿足跟的两侧,深度小于2毫米,擦去第一滴血,从采集点的下方捏住穿刺位点,轻柔、间歇性地对周围组织施加压力,增加血流量;将滤纸片血圈中心接触血滴,切勿触及皮肤,使血液自然渗透至滤纸背面,避免重复滴血,至少采集2个血斑;手持消毒干棉球轻压采血部止血;将血片悬空平置,自然晾干呈深褐色。避免阳光或紫外线照射、烘烤、受潮以及挥发性化学物质污染;及时将检验合格的滤纸干血片置于密封袋内,密闭保存在28摄氏度冰箱中。
合格末梢血血片标准:单片血斑直径为8mm(50微升以上);血斑自然渗透,滤纸正反面一致;血斑无污染;血斑无渗出血环;采集信息完整、字迹清晰可见。
2.3 DBS 样本前处理
用8mm的打孔器在DBS样本上打孔1个备用;制备标准物质载体,使用干净的干滤纸片依次用8mm的打孔器打出9个空白纸片;使用北京豪斯生产的试剂盒分别配置标准曲线S1~S7备用;精密量取30μL 的S1~S7标准品和质控品分别滴于9个空白滤纸片上标记;精密量取15μL的内标溶液滴于DBS样本上,彻底晾干。
分别将干燥标准品、质控品、DBS样本的滤纸片置于1.5m的离心管中;密移取200μL的0.3%甲酸的甲醇溶液,超声30分钟;将超声后的离心管置于1000rmp离心机中5分钟,吸取180μL上清液,于96MTP板中,氮气吹干;向微孔板样本中加入50μL的PTAD溶液,于500rmp、20℃震荡混匀器,混匀1小时;向的微孔板中加入160μL的无水乙醇溶液,静置10min,氮气吹干。精密移取50μL 50%甲醇水(1∶1/V∶V)溶液,分别加入至氮气吹干的样本96MTP板中,1000rpm涡旋振荡10分钟,震荡均匀;复溶样本于4 ℃、4000 rpm离心20 分钟,准备上机;将含样本的96孔板置于LC-MS/MS中进行检测。
2.4 色谱-串联质谱分析
液相色谱条件:色谱柱:Shim-pack Velox C18 色谱柱(2.1mmI.D.x50mm L, 2.7μm);流动相:流动相A(0.1%甲酸-2mM乙酸铵水溶液);流动相B(0.1%甲酸甲醇溶);流速:0.5mL/min;色谱柱温:40摄氏度; 进样量:10μL;自动进样器温度:4摄氏度;洗脱方式:梯度洗脱,B相初始浓度为80%,时间程序设定见表1。

表1 色谱时间程序
质谱条件:离子源:ESI(+);雾化气流速:3.0L/min;加热气流速:10.0L/min;干燥气流速:10.0L/min;DL温度:160℃;加热模块温度:500℃;接口温度:350 ℃;驻留时间:19.0 ~41.0 ms;最大循环时间:0.44s;扫描模式:多反应监测(MRM),MS扫描参数见表2。
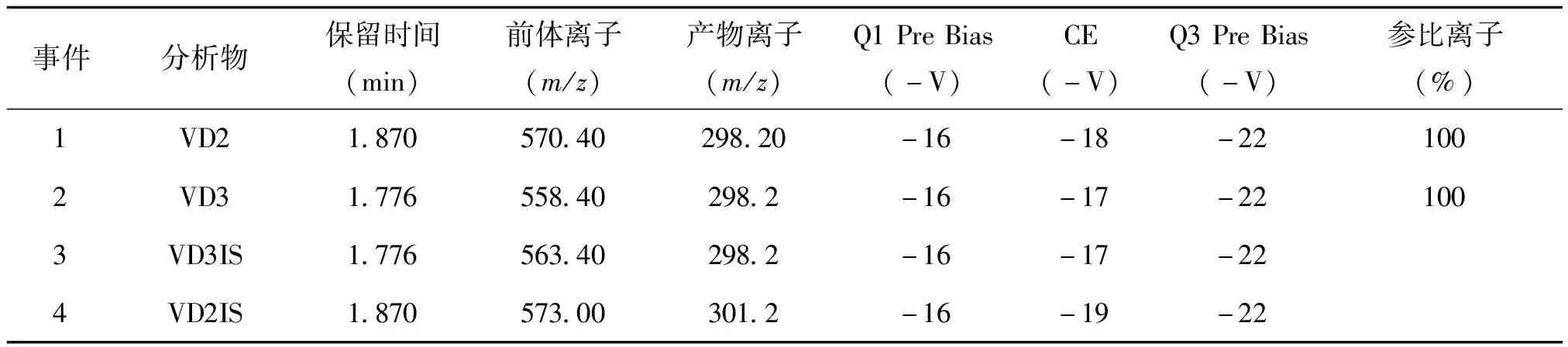
表2 MS扫描参数
3 结果与讨论
3.1 高效液相色谱-串联质谱的条件优化
离子对衍生化优化:由于25(OH)D电喷雾电离条件下很难被电离, 为提高25(OH)D离子化效率, 获得更佳的灵敏度, 通常使用PTAD对25(OH)D 进行衍生化反应, 通过反应引入一个含丰富氮原子的基团, 该基团会使衍生化产物在ESI+模式下很容易形成加氢峰[5]。本研究分析DBS样本, 由于8mm DBS 样本片中全血含量很少, 使得分析物的量远低于常规的血清样本LC-MS/MS 分析方法, 须使用PTAD 试剂对分析物进行衍生化, 以提高检测灵敏度。PTAD 与25(OH)D 进行Diels-Alder 反应生成的25(OH)D2和25(OH)D3衍生化产物均存在6S和6R构型, 本方法在流动相添加甲酸铵或甲酸, 调节流动相比例及流速, 实现6S和6R构型的分离(图1), 获得了更佳的分离度、保留时间和峰形, 提高了分析的准确度。优化后选择流动相为甲醇(含0.1%甲酸)-水(0.1%甲酸、2mM甲酸铵,80:20,V/V), 洗脱时间为7min。对于25(OH)D衍生化产物存在的6S 和6R 两种构型, 为方便定量, 选择主峰6S 构型进行定量分析。PTAD衍生化产物在质谱环境中,容易失去一分子水,形成的准分子离子脱水峰是该衍生物ESI一级质谱的主峰,因此,MRM定量分析时选择[M+H-H2O]+作为母离子。
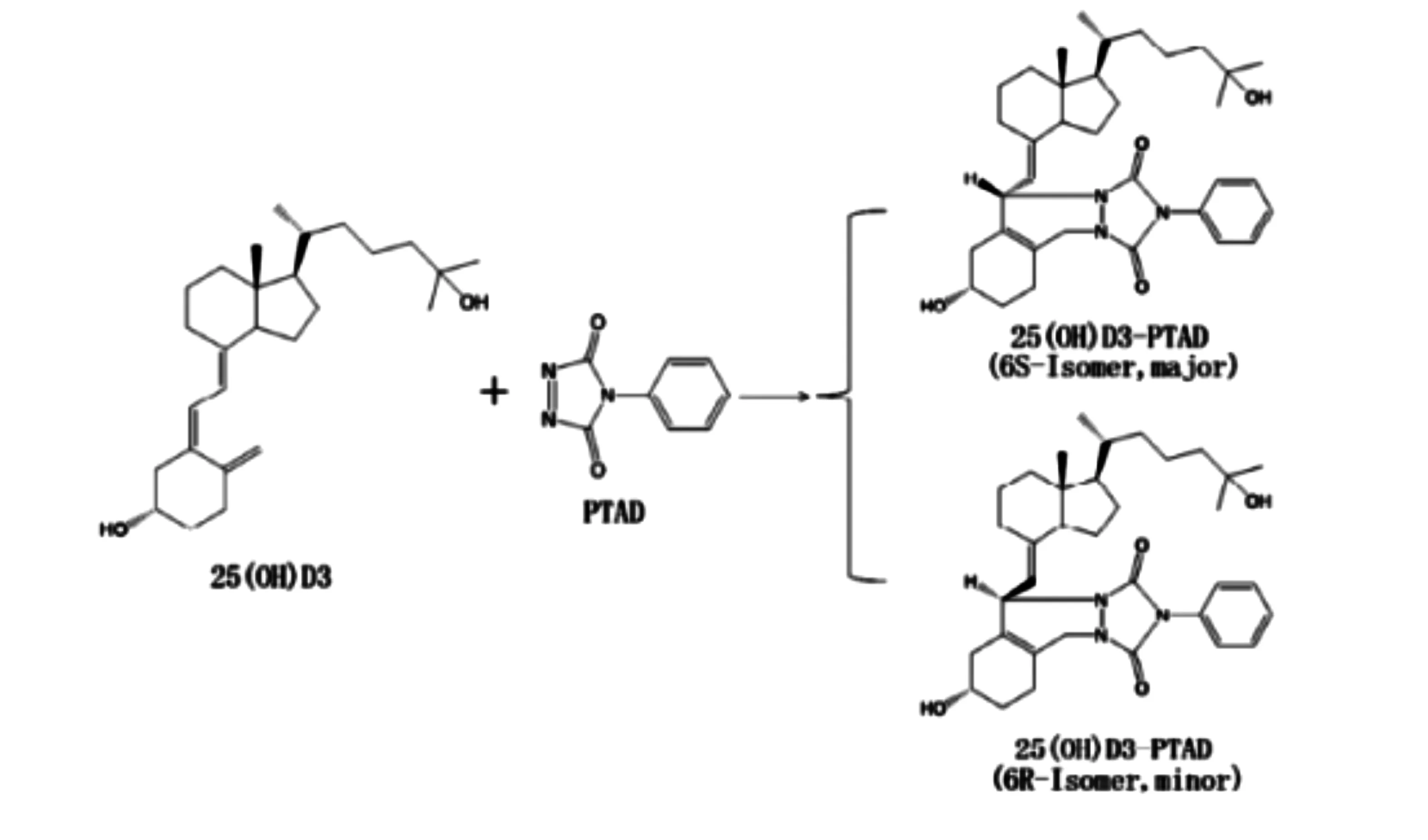
图1 25(OH)D3衍生化过程
提取试剂优化:本研究方法优化了从DBS样本从提取25(OH)D提取率;分别使用了乙酸乙酯、甲醇、乙腈、正己烷4组从DBS样本从提取25(OH)D。同条件下比较甲醇组的提取效率相对较高。对甲醇组继续优化,分别对照了提取时间30min和15min,两个时间段无明显差异;对甲醇组用水分别配置20%、40%、60%、80%、100%比例的浓度进行提取无显著差异。对甲醇组用甲酸分别配置0.1%、0.2%、0.3%、0.5%浓度的比例进行提取对比,结果表明3%甲酸甲醇溶液提取信号峰面积最大。最终确定用0.3%甲酸甲醇溶液作为提取剂在超声模式下提取15min。
3.2 实验结果
从DBS样本测量25(OH)D含量,标准品中25(OH)D2和25(OH)D3的浓度为1ng/mL、2ng/mL、5ng/mL/、10ng/mL、20ng/mL、100、ng/mL;质控品的浓度为20ng/mL、100ng/mL。全血中分析物25(OH)D2和25(OH)D3和相对应的稳定同位素内标25(OH)D2-D6和25(OH)D3-D3的峰面积比值为y, 浓度为x(ng/mL), 进行线性回归拟合, 结果表明, 25(OH)D2和25(OH)D3在1~100ng/mL范围内线性关系良好, 线性决定系数R2均大于0.99(图2)。

图2 质谱检测峰及定量曲线
3.3 DBS样本中25(OH)D与血清中的换算关系
DBS样本25(OH)D的含量定量:DBS样本与血浆维生素D水平的换算公式:(Hematocrit Fraction与性别有关,女性0.41,男性0.45)
目前已经检测52个DBS样本。做DBS样本同时检测血浆中25(OH)D的含量定量。两组数据采用配对T检验进行统计差异比较,成对样本相关系数0.983(P<0.01),成对样本检验统计量t=2.19(P<0.05),得出结论两种方法统计学差异度小。
4 结论
本研究建立了一种基于LC-MS/MS 检测DBS样本中25(OH)D的方法, 检测仅需要1个8mm孔径全血的DBS样本, 前处理使用PTAD衍生化,以及超声提取。本方法方便快速, 灵敏度高, 准确度好, 样本稳定性佳, 适用于有限采血条件下的25(OH)D2/D3检测及相关疾病的大规模筛查。

