维生素D 通过上调Nrf2/HO-1 通路减轻高糖诱导的血管内皮损伤
郭艳光, 林丽明, 吴 莹, 许开祖, 余 杰, 吴梅芳
(莆田学院附属医院 心血管内科, 福建 莆田 351100)
0 前言
糖尿病是一种较为常见的非传染性慢性疾病[1], 糖尿病患者最重要的死亡原因是心脑血管疾病, 后者共同的病理基础是动脉粥样硬化,而血管内皮细胞作为维系血管正常结构和功能的第一道屏障, 其功能障碍在动脉粥样硬化发生发展中起着重要作用。 基础研究发现, 长期高糖暴露能够通过氧化应激导致血管内皮损伤和功能障碍[2]。 流行病学和基础研究发现, 维生素D 缺乏广泛存在于糖尿病患者中, 并可能通过诱导氧化应激和炎症、 增加胰岛素抵抗等机制参与糖尿病大血管并发症发生、 发展。 前期研究发现, 维生素D 干预人脐静脉内皮细胞(HUVECs), 能够抑制高糖时源自线粒体和还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH) 氧化酶的活性氧簇(ROS)生成, 改善血管内皮功能[3-5]。 然而, 维生素D的血管内皮保护作用是否能够通过促进抗氧化物质生成实现, 目前还未见报道。
核因子E2 相关因子2(Nrf2) 是一种机体维持氧化还原稳态非常重要的核转录因子。 当细胞遭受氧化物质攻击时, 胞浆的Nrf2 能够转移至胞核并与抗氧化反应元件(ARE) 结合, 启动众多抗氧化酶如血红素加氧酶1(HO-1)、 超氧化物歧化酶、 过氧化氢酶等基因的转录和表达, 保护机体免受氧化物质的侵害。 研究发现, Nrf2 活性降低与血管内皮功能障碍和动脉粥样硬化形成相关, 而Nrf2 / ARE 通路激活能够减轻各种氧化物质对血管内皮的损伤作用[6]。
因此, 本研究拟观察维生素D 能否通过激活Nrf2 / HO-1 信号通路, 促进高糖环境下HUVECs 抗氧化物质生成, 拮抗细胞氧化应激损伤。
1 材料
骨化三醇( 上海笃玛生物科技有限公司);M199 细胞 培养基、 胎牛血清、 0.25% 胰酶-EDTA( Invitrogen 公 司); OPTI-MEM ( Gbico 公司); Ⅰ型胶原酶(Sigma 公司); ROS 检测试剂盒(武汉华联科生物技术有限公司); CCK8 检测试剂盒(碧云天生物技术有限公司); 一氧化氮(NO)测定试剂盒( 武汉纯度生物科技有限公司); 核蛋白提取试剂盒(上海源叶生物科技有限公司); 抗Nrf2、 HO-1、 β-actin 单克隆抗体(TCS 公司); 辣根过氧化物酶标记(HRP) 的二抗(上海联迈生物工程有限公司); X 线胶片(日本柯达公司); PVDF 膜( Millipore 公司); 免疫印迹检测用的ECL 试剂(Santa Cruz 公司)。
2 方法
2.1 HUVECs 培养及分组干预
取莆田学院附属医院健康育龄产妇剖宫产后的新鲜脐带(所有取材经莆田学院附属医院伦理委员会许可及志愿者书面知情同意), 采用胶原酶消化法原代培养HUVECs, 依据镜下特异形态学特征及免疫荧光染色Ⅷ因子相关抗原阳性鉴定HUVECs, 取传3~6 代的HUVECs 进行分组, 正常对照组接受5.5 mmol/ L 葡萄糖处理, 高糖组接受33 mmol/ L 葡萄糖处理, 高糖+维生素D 组(简称HD 组) 接受33 mmol/ L 葡萄糖和10-9~10-7mol/ L 浓度骨化三醇联合处理, 干预48 h。下文中, HD1 组、 HD2 组、 HD3 组骨化三醇浓度分别为10-9mol/ L、 10-8mol/ L、 10-7mol/ L。
2.2 CCK8 法测定细胞增殖活性
每孔加入10 μL CCK8 和90 μL 基本培养基,37℃避光孵育1 ~2 h, 测定450 nm 处的吸光度值[D(450nm)]。 计算各组HUVECs 的相对增殖活性。
2.3 流式细胞仪检测细胞内ROS 的水平
细胞处理结束后, 加入ROS 检测试剂盒,采用酶标仪检测各组HUVEC 荧光强度, 代表细胞内ROS 水平。
2.4 NO 含量测定
搜集各组细胞培养液100 μL, 按照NO 检测试剂盒说明书中的方法(硝酸还原酶法)和步骤,检测各组HUVECs 培养液NO 水平。
2.5 免疫印迹检测蛋白表达水平
提取总蛋白、 胞浆蛋白和胞核蛋白(根据核蛋白提取试剂盒说明书操作), 煮沸10 min 变性, 采用12% SDS-PAGE 分离50 μg 蛋白样品,转至PVDF 膜后用特异的抗Nrf2、 HO-1、 β-actin单克隆抗体4℃振荡过夜, TBST 洗5 min×3 次,加入HRP 标记的二抗常温孵育1 h, ECL 法显影, 应用凝胶成像分析仪测定蛋白条带灰度后,计算各蛋白条带和内参照β-actin 的比值。
2.6 统计学分析
实验中所记录数据均以“均数±标准差” 表示, 多组间的均数比较采用单因素方差分析, 组间的两两均数比较采用最小显著性差异法检验。P<0.05 为差异有统计学意义, P<0.01 为差异显著。 采用SPSS13.0 统计分析软件分析数据。
3 结果
3.1 维生素D 对高糖条件下HUVECs 活性水平的影响
高糖能够呈时间依赖性降低HUVECs 细胞活性水平, 如见图1 所示, 高糖作用48 h 时HUVECs 活性明显降低(P<0.01), 高糖作用72 h 时HUVECs 细胞活性与高糖作用48 h 时HUVECs 的活性差异无统计学意义(P>0.05), 故选取48 h为高糖暴露时间进行后续实验; 以维生素D(10-9~10-7mol/ L) 预处理45 min 后加高糖共同孵育HUVECs48 h, 结果显示维生素D 10-8和10-7mol/ L 均能显著抑制高糖条件下HUVECs 活性水平下降, 且以维生素D 10-7mol/ L 更为显著(P<0.01), 故选取10-7mol/ L 为维生素D 的工作浓度进行后续实验。
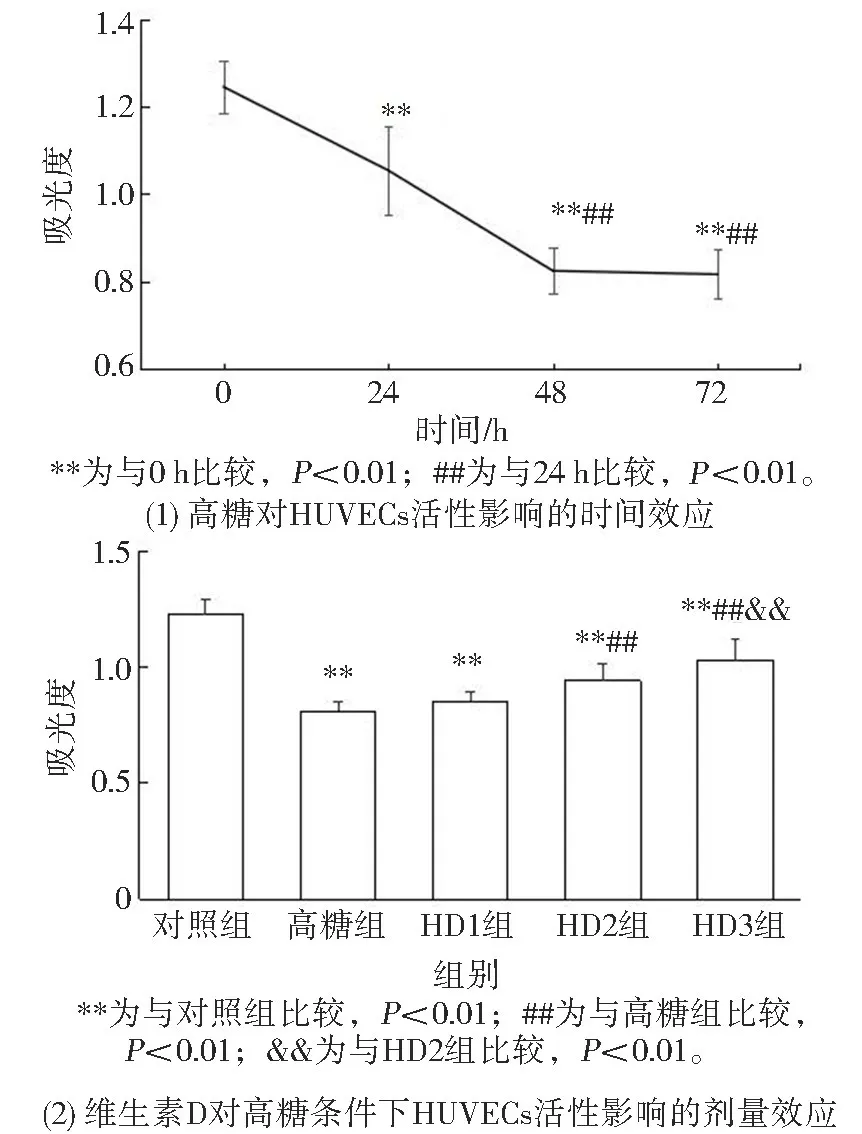
图1 维生素D 对高糖条件下HUVECs 活性水平的影响
3.2 维生素D 对高糖条件下HUVECs 培养液中NO 生成的影响
高糖暴露显著减少HUVECs 中NO 的生成,与对照组相比, 高糖组HUVECs 培养液中NO 含量显著降低(对照组为28.42±5.31 μmol/ L, 高糖组为9.52±2.68 μmol/ L, P<0.01); 维生素D干预能显著增加高糖诱导的HUVECs 中NO 的生成, 与高糖组相比, HD3 组HUVECs 培养液中NO 含量显著增加(HD3 组为21.46±3.37μmol/ L, P<0.01), 但仍低于对照组(P<0.01)。 见图2。
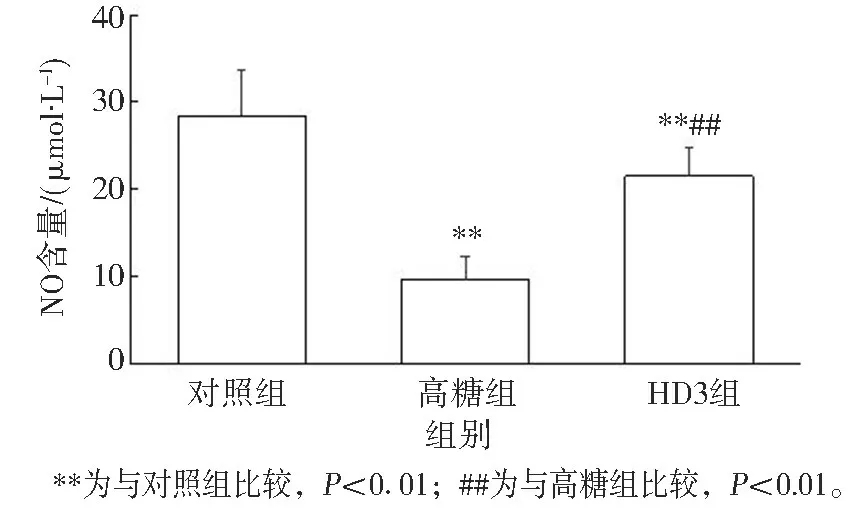
图2 维生素D 对高糖条件下HUVECs培养液中NO 生成的影响
3.3 维生素D 对高糖条件下HUVECs 内ROS生成的影响
流式细胞仪检测HUVECs 内ROS 水平显示:高糖可促进HUVECs 内ROS 生成, 与对照组相比, 高糖组HUVECs 内ROS 水平显著增加( P<0.01); 维生素D 干预能显著抑制高糖诱导的HUVECs 内ROS 生成, 与高糖组相比, HD3 组HUVECs内ROS 水平显著降低(P<0.01)。 见图3。
3.4 维生素D 对高糖条件下HUVECs 的Nrf2和HO-1 蛋白表达的影响
免疫印迹结果显示: 与对照组相比, 高糖组HUVECs 的Nrf2 亚细胞分布无显著差异, 即两组HUVECs 胞浆与胞核Nrf2 蛋白表达水平均无统计学差异(P>0.05); 与高糖组相比, HD3 组HUVECs 胞浆Nrf2 蛋白水平明显减少(P<0.01),胞核Nrf2 蛋白水平显著增加(P<0.01)。 此外,与对照组相比, 高糖组HUVECs 的HO-1 蛋白表达显著降低(P<0.01); 与高糖组相比, HD3 组HUVECs 的HO-1 蛋白表达显著增高(P<0.01)。见图4。
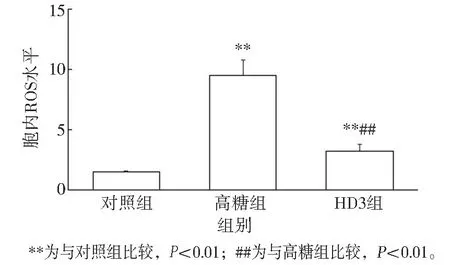
图3 维生素D 对高糖条件下HUVECs 内ROS 生成的影响
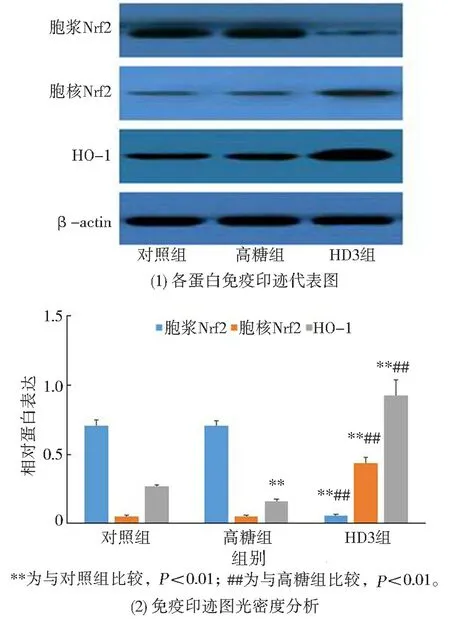
图4 维生素D 对高糖条件下HUVECs 的Nrf2和HO-1 蛋白表达的影响
4 讨论
高糖通过诱导氧化应激加重血管内皮功能障碍是糖尿病大血管病变发生的起始环节, 而氧化应激的原因与体内抗氧化物质不能有效清除ROS 有关。 前期在动物和细胞水平的研究发现,维生素D 能够抑制高糖诱导的氧化应激和炎症,改善糖尿病小鼠胸主动脉内皮对乙酰胆碱的舒张反应[2-3]。 在此基础上, 本研究在细胞水平进一步证明, 维生素D 能够通过激活Nrf2 / ARE 抗氧化通路, 增加抗氧化物质HO-1 蛋白表达, 拮抗高糖诱导的HUVECs 内ROS 生成, 促进NO 合成, 可能成为防治糖尿病血管内皮功能障碍及大血管并发症的潜在药物。
Nrf2 / ARE 信号通路作为体内经典的抗氧化通路, 其活性降低被证实与内皮功能障碍及动脉粥样硬化疾病发生相关[6]。 Berridge M J 曾提出一个假说, 维生素D 可能通过诱导两个关键调控蛋白Nrf2 和Klotho 的表达, 参与多种基因转录活性的调控, 进而维持体内低水平的ROS 和Ca2+信号稳态[7]。 Chen L 等研究证实了以上假说, 研究发现基因敲除小鼠骨化三醇合成的关键酶1α 羟化酶能够使动物存活寿命缩短, 皮肤和肾脏组织的氧化应激标记物水平增加, 衰老相关蛋白p16、 p53 和p21 表达上调, 细胞增殖活性减低和出现衰老相关分泌表型, 而补充维生素D能够通过激活维生素D 受体, 上调Nrf2 / ARE 抗氧化通路阻断这一衰老过程[8]。 本研究发现,维生素D 预处理可以促进高糖环境下HUVECs胞浆Nrf2 向胞核转移, 诱导其下游抗氧化物质HO-1 蛋白表达, 拮抗高糖诱导的血管内皮氧化损伤。 除此之外, Nakai K 等研究也发现, 维生素D 能够通过激活Nrf2 / ARE 通路, 抑制肾脏局部NADPH 和NF-κB 表达, 减轻糖尿病小鼠蛋白尿和肾小球系膜基质增生[9]。 Teixeira T M 等研究也发现, 维生素D 预处理HUVECs, 能够通过激活Nrf2 / ARE 抗氧化通路, 预防瘦素诱导的氧化应激和炎症[10]。 这些研究提示, 维生素D 可能通过上调Nrf2 下游抗氧化酶基因表达, 拮抗糖尿病、 肥胖等代谢性疾病所致的心血管损害。
虽然大量的流行病学研究显示, 维生素D缺乏与糖尿病及其大血管并发症发生密切相关,而且基础研究也显示补充维生素D 可能具有保护心血管作用, 然而, 近期有关维生素D 在一般人群的心血管疾病和2 型糖尿病一级预防的临床试验却得出阴性结果[11-13]。 值得注意的是,这些临床研究的纳入人群均非维生素D 缺乏人群, 或者在维生素D 缺乏的亚组人群观察到获益[14-15]。 因此, 维生素D 用于心血管疾病和2型糖尿病的防治目前仍无法定论。 本研究在细胞水平上进一步证实了维生素D 能够通过激活Nrf2 / ARE 通路, 保护血管内皮免受高糖诱导的氧化应激损伤, 这为将来进一步开展维生素D用于合并维生素D 缺乏的2 型糖尿病患者防治大血管并发症提供了一定的理论基础。

