Ag/ TiO2 光催化材料的制备及其催化降解硝基苯
饶艳英, 魏红帆, 熊依凌, 李章良
(1.莆田学院 环境与生物工程学院, 福建 莆田 351100;2.福建省新型污染物生态毒理效应与控制重点实验室, 福建 莆田 351100;3.生态环境及其信息图谱福建省高等学校重点实验室, 福建 莆田 351100)
0 引言
硝基苯是一种常见的有毒污染物, 是化工生产中一种重要的原材料[1], 具有分布广泛、 毒性强的性质, 可通过呼吸道摄入或皮肤的吸收而对人体产生毒性作用, 从而引起神经系统症状、贫血甚至破坏人体的肝脏与呼吸系统, 导致肝的实质性病变[2]。 硝基苯在水中还具有极高的稳定性与一定的溶解度[3], 极易引起水体环境污染。
二氧化钛( TiO2) 化学性质稳定、 活性高、可以屏蔽紫外线, 现已广泛应用于水环境污染治理、 空气净化、 贵金属回收以及化妆品生产等领域[4-5]。 光催化降解反应是一种新型且有诸多优点的化学反应, TiO2在光催化条件下通过紫外光的照射, 会产生光生电子-空穴对, 经过有效分离之后两者都可参与光催化反应, 在降解污染物、 抗菌杀毒以及防污防雾方面有很大的优势和利用价值[6-8]。 然而, TiO2只能吸收波长小于387 nm 的光子(能隙为3.2 eV), 所吸收的紫外光辐射部分仅为太阳光能谱的4%左右, 因此在太阳光的利用效率方面TiO2有很大局限[9]。 现如今有许多技术对TiO2纳米粒子进行修饰或表面改性, 如金属离子掺杂[10]和非金属离子掺杂[11]等, 以提高TiO2对于可见光的吸收率[12]。本实验通过在TiO2上负载贵金属进行表面改性,利用化学沉积法制备Ag / TiO2并研究其在紫外光及自然光作用下氧化降解水中硝基苯的催化降解机理。
1 材料与方法
1.1 实验试剂
金红石型纳米TiO2、 P25 型纳米TiO2购自北京德科岛金科技有限公司; 氨水、 无水乙醇、过氧化氢(H2O2,30%)、 硝酸银(AgNO3)、 硝基苯均为分析纯, 购自国药集团化学试剂有限公司。
1.2 Ag / TiO2 的制备
将2%的氨水滴入2%的AgNO3溶液中至沉淀完全溶解后停止, 配制出银氨溶液, 取110 mL 银氨溶液加入0.1 g TiO2(金红石型与P25 型各制备一次), 搅拌并滴加过量2%的H2O2, 直至溶液变成棕黑色。 将沉淀用离心机离心后, 再用蒸馏水和无水乙醇各洗涤两次, 取沉淀于70℃下烘干12 h, 得到掺杂银的TiO2[13-14], 记为Ag / TiO2。
1.3 光催化降解实验
实验光源能量为114.6 mJ/ cm2的紫外灯和模拟自然光的室内荧光灯。 反应器由磁力搅拌器与光源组成, 温度保持在室温。 实验模拟废水为硝基苯溶液, 浓度20 mg / L。
配制初始浓度为20 mg / L 的硝基苯溶液60 mL, 加入1.0 mL 15 mmol/ L 的H2O2, 10 mg Ag /TiO2, 暗反应条件下搅拌10 min 后达到吸附平衡, 将灯源打开, 在常温条件下进行催化反应,每10 min 吸取5 mL 溶液于带过滤头的针筒中过滤, 将过滤出的溶液置于紫外分光光度计中, 测定波长λ = 268 nm 处的吸光度。
2 结果与讨论
2.1 材料表征
采用日本岛津XRD-6100 X-射线衍射仪分析样品的晶相结构。 电压45 kV, 电流40 mA; 扫描速度5(°) / min; 狭缝DS: 1°, SS: 1°, RS:1°; X 射线为Cu 靶Kα( λ = 0.154 n06 nm), 步长: 0.02°; 扫描范围10 ° ~90°[15]。
图1 为P25 型和金红石型TiO2及对应的Ag / TiO2的XRD 图谱。 从XRD 谱图中可以看到4个Ag 的衍射峰, 所对应的2θ 值分别为38.2°、44.4°、 64.5°和77.7°, 其衍射峰的强度以及对应的值与银原子的XRD 标准图谱中银原子4 个晶 面 一 致, 各 为( 111 )、 ( 200 )、 ( 220 )、(311), 说明此Ag / TiO2制备方法能够使银负载在TiO2表面[16]。
图2 为P25 型和金红石型TiO2及对应的Ag / TiO2的扫描电镜图。 从图2( a)、( c) 可以看出, P25 型TiO2表面在负载银后, 结构发生了变化, 表面出现了细小的银颗粒, 金红石型TiO2在负载银后, 表面结构变化更明显, 如图2(b)、2(d)所示, 其结构由原来表面较光滑的片状颗粒变为表面粗糙的块状颗粒。 这进一步说明上文Ag/ TiO2制备方法能够使银负载在TiO2表面。
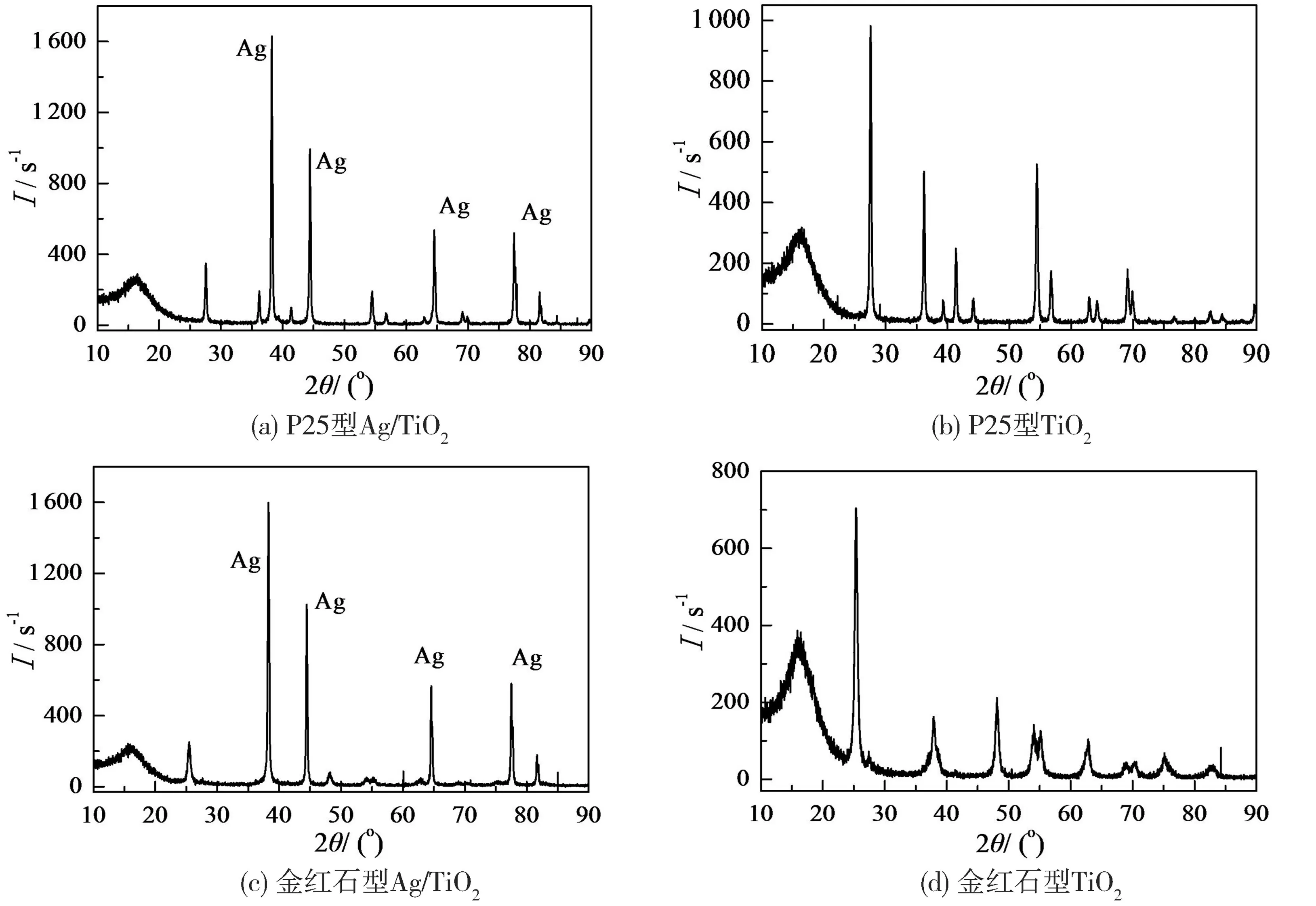
图1 不同类型TiO2、 Ag/ TiO2 的XRD 谱图

图2 扫描电镜图
2.2 硝基苯溶液标准曲线的测定
用TU-1900 双光束紫外分光光度计在硝基苯溶液最大吸收波长(268 nm)下测定硝基苯标准溶液的吸光度A, 实验数据如图3 所示。 以硝基苯浓度C 为横坐标, 吸光度A 为纵坐标绘制标准曲线, 所得曲线拟合得线性回归方程: Y = 0.0715x -0.0166。 从图3 可看出, 在0~25 mg / L 浓度范围内, 浓度与吸光度之间呈较好的线性关系(相关系数R2= 0.998 4)。
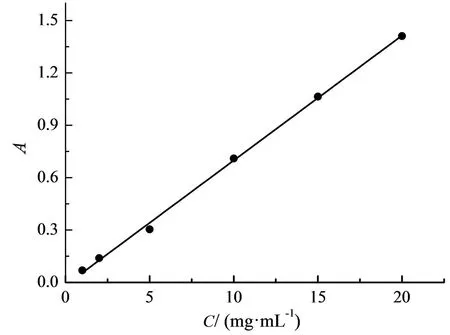
图3 硝基苯标准曲线
2.3 H2O2 加入量对降解效率的影响
配制6 份60 mL 初始浓度为20 mg / L 的硝基苯溶液, 分别加入15 mmol/ L H2O2溶液0.5、1.0、 2.0、 3.0、 4.0、 5.0 mL, 于20℃下搅拌,暗反应10 min 后, 置于紫外光照射下搅拌120 min 后, 测吸光度并记录降解率( 如图4)。 实验结果表明: 当H2O2加入量为1.0 mL (即浓度为0.25 mmol/ L) 时, 光催化降解率最高达到41.2%。 当溶液中H2O2浓度小于0.25 mmol/ L时, 硝基苯的降解率在逐渐增高; 但当H2O2浓度超过0.25 mmol/ L 后, 硝基苯降解率开始降低。 故H2O2投加浓度在0.25 mmol/ L 时, 光催化降解率最高。
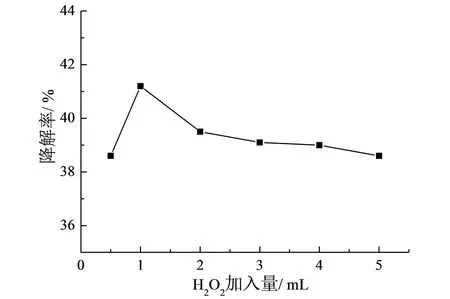
图4 H2O2 加入量对硝基苯降解率的影响
2.4 催化剂投加量对硝基苯降解率的影响
配制6 份内含H2O2浓度为0.25 mmol/ L、 硝基苯浓度为19.67 mg / L 的反应溶液60 mL, 分别加 入 0.001、 0.005、 0.010、 0.040、 0.080、0.120 g Ag / TiO2, 于20℃下搅拌, 暗反应10 min后, 置于自然光照下搅拌120 min 后, 测吸光度并记录降解率, 结果如图5 所示。
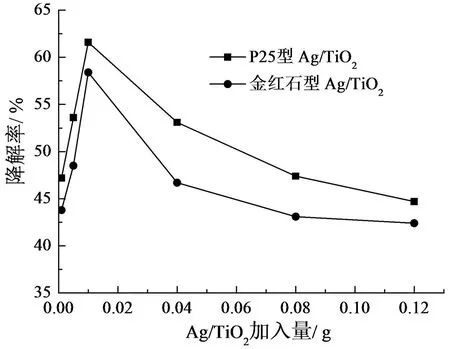
图5 Ag/ TiO2 加入量对硝基苯降解率的影响
实验结果表明, 在20℃下, 随加入量的增加, P25 型和金红石型Ag / TiO2对硝基苯的催化降解效率变化趋势非常相似, Ag / TiO2加入量在0.010 g 时, 硝基苯降解率均达到最佳状态, 此时溶液中Ag / TiO2的浓度为0.16 g / L。 而后, 随着Ag / TiO2加入量的增加, 硝基苯的催化降解率逐渐降低, 说明Ag / TiO2使用过量致使Ag / TiO2颗粒间发生互相屏蔽而降低催化活性[17]。
当只加入少量Ag / TiO2时, 硝基苯与Ag /TiO2光催化材料表面的接触不充分, 导致光能无法被充分利用, 光催化降解硝基苯的降解率偏低。 而随着Ag / TiO2使用量增加, 催化反应活性增大, 因此, 硝基苯的降解效率也相应的随之加大。 但如果Ag / TiO2使用过量, 则过量的Ag /TiO2会遮蔽入射光, 降低了溶液的透光率和光源的光子发射效率, 导致硝基苯的降解率降低[18]。 故溶液中Ag / TiO2的浓度为0.16 g / L 时,光催化降解率最高。
2.5 催化剂种类对硝基苯降解率的影响
配制4 份内含0.25 mmol/ L H2O2、 19.67 mg/ L硝基苯的反应液60mL, 分别加入0.01g P25 型Ag/TiO2、 金红石型Ag/ TiO2、 P25 型TiO2和金红石型TiO2, 于20℃下搅拌, 暗反应10min 后, 置于紫外光照下搅拌120min, 其间每隔20min 取样测吸光度并记录降解率, 对比结果如图6 所示。
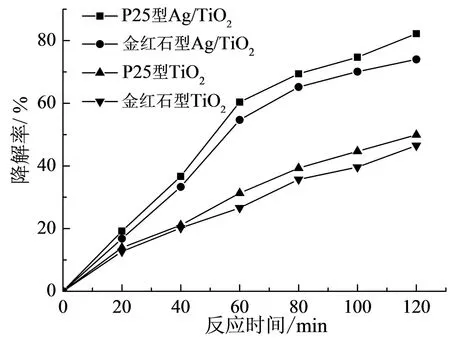
图6 催化剂类型对硝基苯降解率的影响
图6 结果表明, TiO2在紫外光照条件下对硝基苯溶液存在一定的光催化降解效果, 反应时间120 min 后, 使用金红石型TiO2光催化材料,硝基苯的降解率为46.5%; 使用P25 型TiO2光催化材料, 硝基苯的降解率为49.9%; 使用金红石型Ag / TiO2光催化材料, 硝基苯的降解效率为74.0%; 使用P25 型Ag / TiO2光催化材料, 硝基苯的降解效率可达到82.4%。 表明当负载银后, TiO2的催化性能获得大幅提高[19]。
2.6 光源类型对硝基苯降解率的影响
配制4 份内含0.25 mmol/ L H2O2、 19.67 mg/L 硝基苯的反应液60 mL, 分别加入0.01 g Ag/TiO2(金红石型、 P25 型各2 份), 于20℃下搅拌, 暗反应10 min 后, 各取1 份分别置于自然光照和紫外光照下搅拌反应120min, 其间每隔20 min取样测吸光度并记录降解率, 结果如图7 所示。
图7 结果表明, 在自然光作用120 min 下,使用金红石型Ag / TiO2光催化材料, 硝基苯的降解率为58.4%; 使用P25 型Ag / TiO2光催化材料, 硝基苯的降解率为61.6%; 使用P25 型Ag /TiO2的光催化效果略高于金红石型Ag / TiO2的光催化效果; 而在紫外光作用120 min 下, 使用金红石型Ag / TiO2光催化材料, 硝基苯的降解率为74.0%, 使用P25 型Ag / TiO2光催化材料, 硝基苯的降解率达到了82.4%。 这说明, 使用紫外光比使用自然光更有利于硝基苯的降解, 紫外光协同Ag / TiO2光催化剂作用提高了水中有机污染物硝基苯浓度的降解效率。
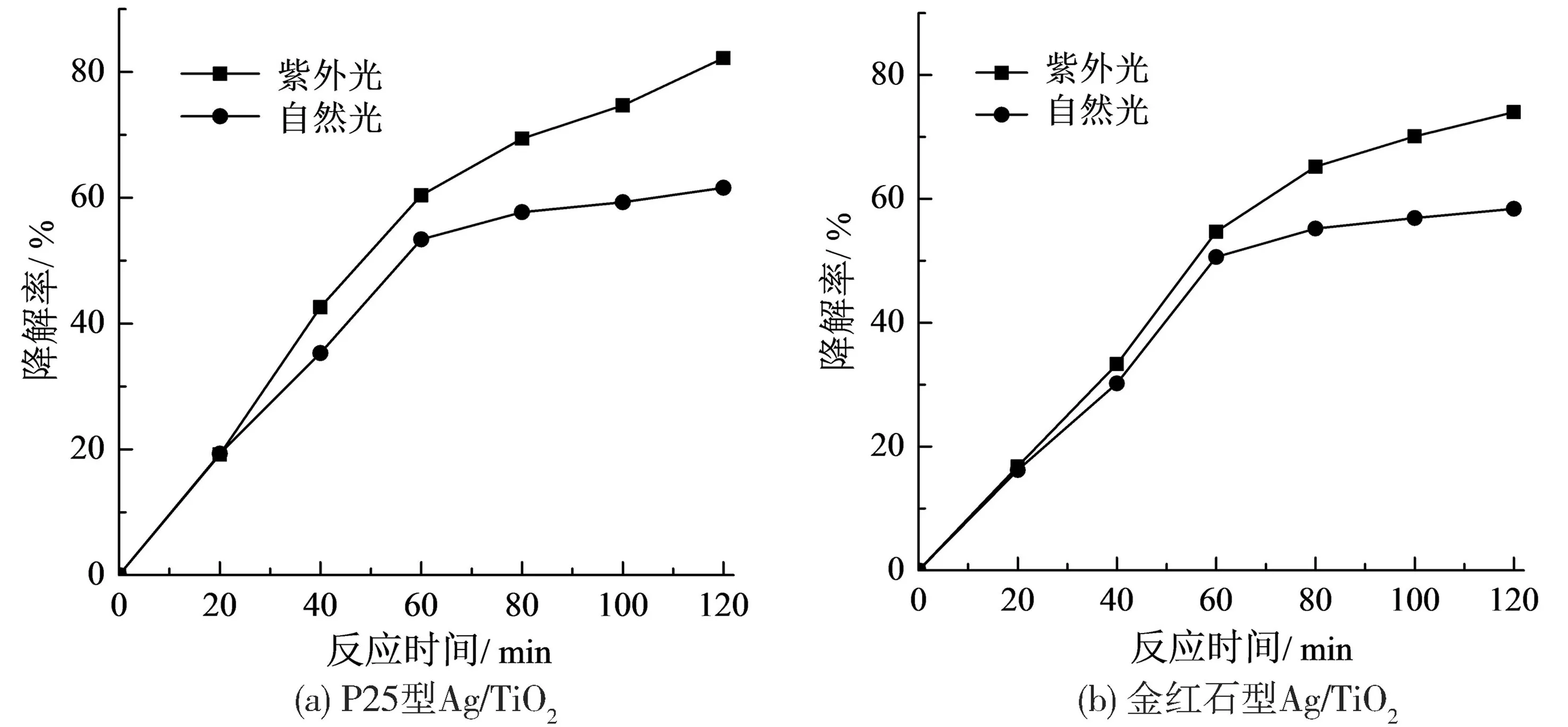
图7 光源类型对硝基苯降解率的影响
2.7 催化剂的循环使用
将使用过的Ag / TiO2催化剂洗涤并烘干。 配制8 份内含0.25 mmol/ L H2O2、 19.67 mg / L 硝基苯的反应液60 mL, 加入0.01g 已进行过催化实验的Ag / TiO2(金红石型、P25 型各4 份) 置20℃下搅拌, 暗反应10 min 后, 置于紫外光照下搅拌120 min, 其间每隔20min 取样测吸光度并记录降解率; 对比其催化活性, 实验结果如图8 所示。
图8 结果表明, 第2 次使用Ag / TiO2光催化材料在紫外光条件下反应120 min 后, 使用P25型Ag / TiO2光催化材料, 硝基苯的降解率为66.1%, 使用金红石型Ag / TiO2光催化材料, 硝基苯的为60.7%; 相较于第一次使用, 降解效率明显降低, 但仍具有较强的催化活性。 进行第3 次催化再生实验后发现, 使用P25 型Ag / TiO2光催化材料, 硝基苯的降解率为53.0%, 使用金红石型Ag / TiO2光催化材料, 硝基苯的降解率为44.7%, 仍然具有一定催化降解效果。 进行第4 次催化剂回收利用实验, 使用P25 型Ag /TiO2光催化材料, 硝基苯的降解率为39.1%,使用金红石型Ag / TiO2光催化材料, 硝基苯的降解率为35.6%, 催化剂的催化性能大大降低,基本失去催化活性。
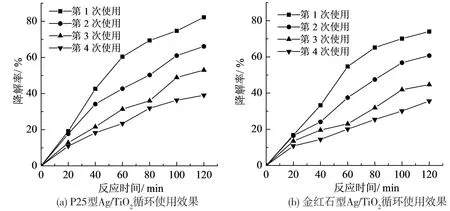
图8 Ag/ TiO2 使用次数对硝基苯降解率的影响
3 结论
利用化学沉积法制备的Ag / TiO2光催化纳米材料, 提高了TiO2的光催化降解能力。 通过探究H2O2用量、 催化剂加入量、 TiO2种类、 光照条件等对硝基苯的降解效果的影响, 得出在20℃下, Ag / TiO2用量为0.16 g / L、 H2O2浓度为0.25 mmol/ L, 硝基苯浓度为19.67 mg / L 时, 自然光条件下降解120 min 后, 使用金红石型Ag /TiO2, 硝基苯的降解率为58.4%, 使用P25 型Ag / TiO2, 硝基苯的降解率为61.6%; 而在紫外光条件下降解120 min, 使用金红石Ag / TiO2, 硝基苯的降解率为74.0%, 使用P25 型Ag / TiO2,硝基苯的降解率为82.4%。 说明在紫外光作用下, 掺杂银之后, TiO2的光催化效率得到很大的提升。 且此Ag / TiO2光催化材料具有一定的再生性, 使用2~3 次仍具有一定活性。

