构建思维模型 落实核心素养
严兵


摘 要:酸碱中和滴定曲线图像题既是高考的常考点,又是化学教学的重点和难点,也是学生的失分点。构建pH-V图像的解题思维模型,可以提高学生分析问题和解决的能力。
关键词:酸碱中和;滴定曲线;化学核心素养;思维模型
酸碱中和滴定曲线图像题是近年来高考化学的热点。这类试题的难度较大,是学生最常见的失分点,在教学中要强化离子平衡理论相关知识点的学习,注重图像试题的解题策略。构建思维认知模型是基础知识的内化,有利于提高学生获取和分析信息的能力。酸碱中和滴定曲线图像题的基础知识是酸碱中和反应,但相关的信息却是从图像中获取,并以获得的信息结合已有的化学与数学知识等信息,并据此作为证据进行推理,解构题干与选项做出判断。
一、读图分析,结合学科知识构建解题思维模型
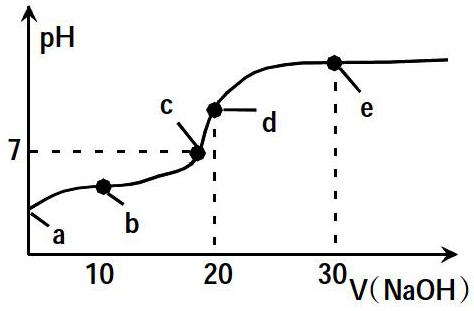
例1.室温时,向20mL 0.01 mol·L-1的HA溶液中不断滴入0.01mol·L-1的NaOH溶液,pH变化曲线如下图所示。下列叙述正确的是( )
A.若a=4,則室温下HA的电离常数Ka=1.0×10-8
B.b点:2c(Na+)=c(HA)+c(A-)
C.c点:c(A-)>c(Na+)
D.e点:c(Na+)∶c(HA)+c(A-)=2∶3
解析:答案B。若a=4,即未开始滴定时醋酸的pH=4,则可知已电离出c(H+)=10-4mol/L,计算可得出Ka=1.0×10-6,故A项错误;从题干条件和图像信息得出:b点V(NaOH)=10mL,则b点溶质成分HA和NaA,由物料守恒关系式:2c(Nar)=c(A-)+c(HA),可判断B项正确;由图中信息可知c点溶液pH=7,根据电荷守恒可得出c(Na+)=c(A-),故C项错误;e点溶质成分为NaA和NaOH,结合题目所给浓度与体积可计算得出:n(HA+A-)=2×10-3mol,n(Na+)=3×10-3 mol,故D项错误。
本题解题关键在于通过题中各点溶液的酸碱性,结合酸碱中反应过程,判断出图中a、b、c、d、e点溶质的成分及它们物质的量之间的大小关系,同时巧用图像中的几个特殊点即起点、半点、中性点和恰好完全反应点来判断守恒关系与离子浓度大小。
室温下,在酸碱滴定过程中,随滴入NaOH溶液逐渐增多,图中曲线上各点溶液的溶质及物质的量的关系,溶液的酸碱性如下表:
总结分析,构建思维模型与知识点的衔接如下:
做这类题型时,首要就是找到不同点对应的溶质成分及物质的量的关系,然后再根据溶质成分和选项的设置作答。
(1)巧用“四点”判溶质成分:
(2)根据选项观察微粒特征判断守恒关系与离子浓度大小:
a.若等式一边都为阴离子,一边都为阳离子,则为电荷守恒关系式;
b.若等式一边都含有一种元素,另一边都含有另外一种元素,则为物料守恒关系式;
c.若等式的一边微粒能结合H+,另一边的微粒为H+或能电离H+,则为质子守恒关系式;
d.若等式没有以上明显特征,则可能为三种守恒关系变形而来;
e.若等式为离子浓度大小比较,则只需要结合电荷守恒与溶液的酸碱性就可以轻松解决。
通过图像中横纵坐标的关系,在微粒种类、宏观现象和符号表征之间建立三重表征分析,从而搭建起学生分析此类问题的解题思维模型:
二、变式训练强化解题思维模型的应用与完善
变式训练能激发学生积极参与课堂的热情,不仅可检查其基础知识的掌握情况,还能培养其分析与归纳的思维能力。因此,变式训练是提升学生解题能力的有效途径与方法。
例2.室温下,氢氧化钠溶液与盐酸溶液相互滴定的曲线如下图,下列叙述不正确的是( )。
A.氢化化钠的浓度为0.1 mol·L-1
B.P点:c(Na+)=c(Cl-)
C.曲线a是碱滴定酸的滴定曲线
D.石蕊试液能用作本实验的指示剂
解析:答案D。由题中信息可知这是强酸与强碱互相滴定的曲线。未开始滴定时,氢氧化钠溶液的pH=13,得出氢氧化钠溶液的浓度为0.1 mol·L-1,故A项正确;P点时溶液呈中性,根据电荷守恒关系式可得出c(Na+)=c(Cl-),故B项正确;曲线a对应的溶液起点的pH等于1,随着滴定的进行,溶液pH逐渐增大,因此可判断曲线a是碱溶液滴定酸的曲线,故C项正确;酸和碱的中和滴定实验中,石蕊试液pH变色范围比较广,且滴定终点时颜色变化接近,肉眼无法清晰分辨滴定终点,因此不可选用石蕊试液作指示剂,故D项错误。
例2变式训练1:参照例2的图像,请画出常温下,20 mL 0.10 mol·L-1的一元弱酸(HA)溶液中逐滴滴加0.10 mol·L-1的一元强碱溶液(MOH)的pH-V(MOH)图像,并注明起点、半点、中性点和恰好完全反应点。
例2变式训练2:参照例2的图像,请画出常温下,20mL 0.10 mol·L-1的一元弱碱溶液(MOH)中滴加0.10 mol·L-1的一元强酸(HA)的pH-V(HA)图像,并注明起点、半点、中性点和恰好完全反应点。
例2变式训练3:室温下,将0.02 mol·L-1 MOH溶液逐滴加入100 mL 0.01 mol·L-1HX溶液中(混合溶液体积变化忽略不计),混合溶液的pH随V(MOH)变化情况如下图。下列说法中,不正确的是()。
A.HX为强酸
B.N点:c(M+)+c(MOH)=c(X-)
C.电离程度:N点大于K点
D.若K点的pH=10,则有c(MOH)+c(OH-)=(5.0×10-3+1.0×10-10)mol·L-1
解析:答案B。由图看出,起点pH=2,可知0.01 mol·L-1 HX溶液中HX完全电离,故A项正确;N点溶质:MX和MOH,可得出c(M+)+c(MOH)>c(X-),故B项错误;N点pH=7,而K点pH>7,溶质为MX和MOH,MOH过量,抑制了水的电离,故C项正确;由图看出K点溶质为MX和MOH,且n(MX)=n(MOH),据物料守恒关系式可得2c(X-)=c(M+)+c(MOH)=0.002mol/0.2L=0.01 mol·L-1,又因HX为强电解质,X-完全以离子形式存在于溶液中,计算可得:c(X-)=5.0×10-3 mol·L-1,将c(M+)+c(MOH)=1.0×10-2 mol·L-1代入电荷守恒关系式中:可得:c(MOH)+c(OH-)=1.0×10-2+c(H+)-c(X-)=1.0×10-2+1.0×10-10-5.0×10-3=(5.0×10-3+1.0×10-10)mol·L-1,故D项正确。
酸碱中和滴定曲线试题教学要求学生能从题干和图像获取信息,并利用信息作为证据,结合已有的学科知识进行证据推理判断,通过变式训练提高学生构建模型和应用模型解决问题的能力。
编辑 冯志强

