ZKSCAN3介导的自噬在急性镉暴露肝毒性中的作用
陈梦妍,谢 佳,田 丽,皮会丰
(陆军军医大学军事预防医学系军队劳动卫生学教研室/电磁辐射医学防护教育部重点实验室,重庆 400038)
镉被广泛应用于多个领域,包括冶炼、采矿、电镀、油漆颜料生产以及合金制造等[1]。但镉是一种对人体多个器官具有危害的重金属,“湖南镉大米事件”“河南镉小麦事件”等重大公共卫生事件的披露揭示了镉污染的严峻现实及其对公众健康的巨大威胁[2]。肝是镉毒理作用的主要靶器官之一,导致肝功能异常的人群镉暴露主要是急性暴露[3]。在镉的急性中毒事件中,患者会出现倦怠、恶心等症状和天冬氨酸转氨酶(aspartate transaminase,AST)、丙氨酸转氨酶(alanine transaminase,ALT)等酶谱异常[4]。因此,探究镉诱导的肝损伤分子机制,可以为镉导致的肝损伤防护提供新线索。
自噬是细胞内物质代谢的重要过程,某些衰老细胞器和生物大分子等由双层膜包裹后陷入溶酶体内并被消化掉是维持细胞稳态的关键因素之一[5]。自噬-溶酶体途径受损会导致细胞凋亡因子的释放和坏死信号的启动,造成细胞的损伤或死亡。然而,细胞自噬过度活化会导致细胞内正常的线粒体被吞噬降解,引起细胞能量代谢障碍,从而刺激细胞自噬性死亡[6]。本课题组前期研究结果表明,肝细胞(L02细胞和HepG2细胞)在镉暴露后会出现SQSTM1蛋白减少和LC3蛋白翻转实验阳性,敲除自噬关键基因ATG5和利用自噬抑制剂3-MA可以显著减少镉暴露诱导的线粒体降解、能量代谢障碍及肝细胞死亡,提示镉暴露造成了肝细胞自噬过度活化,抑制自噬能显著拮抗镉肝毒性[7-8]。然而,镉是通过何种信号通路诱导自噬还有待进一步阐明。
ZKSCAN3是控制细胞自噬-溶酶体途径的关键分子之一,主要通过调控自噬-溶酶体途径相关基因表达从而控制自噬流[9-10]。有研究发现,ZKSCAN3位于细胞核中,但在饥饿或者运动等应激情况下,细胞核内的ZKSCAN3会减少或向细胞质转位,从而丧失对DNA转录的抑制作用,进而启动自噬-溶酶体途径相关基因的转录[9-10]。基于以上情况,本研究通过体内实验,建立急性镉暴露小鼠模型,初步探究ZKSCAN3介导的自噬在急性镉暴露肝损伤中的作用。
1 材料与方法
1.1 实验动物及试剂
SPF级C57BL/6J雄性小鼠,7~8周龄,由陆军军医大学实验动物中心提供,生产许可证号:SCXK(渝)20170002,使用许可证号:SYXK(渝)20170002。所有动物实验的开展均获得陆军军医大学实验动物伦理审查委员会批准。氯化镉购自西格玛奥德里奇公司,纯度大于99.99%。建立镉暴露小鼠模型前,以生理盐水配制氯化镉溶液,质量体积比为1∶2.5。
1.2 小鼠急性氯化镉暴露实验
将16只8周龄SPF级雄性小鼠随机分成生理盐水对照组及镉暴露组,每组8只。生理盐水对照组小鼠每日腹腔注射等量生理盐水1次,7 d后取材进行后续实验;镉暴露组小鼠腹腔注射氯化镉,染毒剂量为2 mg·kg-1·bw-1,染毒方式为每天腹腔注射1次,7 d后取材进行后续实验[11]。
1.3 AAV-TBG-ZKSCAN3干预实验
AAV-TBG-ZKSCAN3及AAV-TBG-control两种腺相关病毒由和元生物设计合成,该病毒含有TBG启动子,可以在肝中特异性过表达ZKSCAN3[12]。24只7周龄SPF级雄性小鼠随机分成镉组、镉+ZKSCAN3组、对照组,每组8只:镉组尾静脉注射AAV-TBG-control,1周后连续腹腔注射氯化镉7 d;镉+ZKSCAN3组尾静脉注射AAV-TBG-ZKSCAN3,1周后连续腹腔注射氯化镉7 d;对照组尾静脉注射AAV-TBG-control,1周后连续腹腔注射生理盐水7 d。2×1011拷贝数AAV溶解在100 μL生理盐水后进行尾静脉注射。氯化镉染毒剂量为2 mg·kg-1·bw-1,染毒方式为每天腹腔注射1次,7 d后取材进行后续实验。
1.4 血清生化指标检测
镉暴露实验及干预实验完成后,小鼠以25%乌拉坦麻醉,心脏取血,1 000 g离心10 min,制备血清,于-80 ℃冻存。干冰运输送至武汉赛维尔生物科技有限公司以全自动生化分析仪检测血清中ALT、AST含量。
1.5 肝组织病理形态学检查
镉暴露实验及干预实验完成后,小鼠以25%乌拉坦麻醉,取肝组织,大小为0.5 cm×1 cm×1.5 cm,4%多聚甲醛固定,送至武汉赛维尔生物科技有限公司进行肝组织常规病理切片,苏木素-伊红(HE)染色,应用Pannoramic MIDI病理切片扫描仪进行记录。
1.6 肝组织的细胞核与细胞质蛋白分离
采用碧云天的细胞核蛋白与细胞浆蛋白抽提试剂盒进行蛋白的核质分离。镉暴露实验结束后采集小鼠肝组织,用剪刀将组织尽可能剪小,按照20∶1的比例混合适量的细胞浆蛋白抽提试剂A和B。每60 mg组织加入200 μL组织匀浆液后,在玻璃匀浆器内充分匀浆。随后按照说明书分别提取细胞质蛋白及细胞核蛋白。
1.7 Western blot检测ZKSCAN3蛋白表达
将细胞核蛋白与细胞质蛋白分别上样,上样量为50 μg,用10% SDS PAGE凝胶电泳,湿转至PVDF膜,然后用10%脱脂奶粉溶液封闭1 h,TBST液清洗,然后加入一抗(ZKSCAN3,1∶1 000;GAPDH,1∶5 000;H3,1∶5 000)。孵育过夜后加入相应二抗。使用ECL显色,在凝胶成像系统中曝光,观测结果,用Image J软件分析条带图。
1.8 实时荧光定量PCR检测自噬相关基因mRNA表达
以总RNA提取试剂RNAiso Plus(宝生物,日本)溶解小于100 mg的肝组织,按说明书步骤提取样本总RNA。取等量总RNA按反转录试剂盒Prime Script RT reagent Kit(宝生物,日本)说明书步骤将总RNA转录为cDNA以进行后续实验。使用荧光定量检测试剂SYBR Master Mix(宝生物,日本)及荧光定量PCR仪(CFX96,美国伯乐)进行基因实时定量荧光PCR实验,检测自噬成膜、发生、延伸等过程的基因Map1lc3b,控制自噬小体与溶酶体融合的基因Rab5a,溶酶体v-ATPase酶基因Atp6v0d1,溶酶体膜蛋白酶基因Lamp1和溶酶体水解酶基因Ctsb的表达。以β-actin为内参,以2-ΔΔCT方法计算mRNA表达量[13],参照对照组计算相关基因mRNA相对表达水平。特异性引物序列见表1。

表1 基因引物列表
1.9 统计学处理

2 结果
2.1 急性镉暴露诱导小鼠肝损伤
HE染色结果显示,与生理盐水对照组比较,镉暴露组小鼠肝细胞局部出现气球样变,炎症细胞浸润、坏死(图1a);与生理盐水对照组比较,镉暴露组小鼠血清中肝功能生化指标ALT、AST显著较高(P<0.01),见图1b、c,表明2 mg·kg-1·bw-1急性镉暴露可造成小鼠肝损伤。
2.2 镉暴露后肝自噬相关基因mRNA表达显著增高
实时荧光定量PCR检测结果显示,与生理盐水对照组比较,镉暴露组肝组织中Map1lc3b、Rab5a、Atp6v0d1、Lamp1、Ctsb的mRNA表达均显著较高,差异有极显著性统计学意义(P<0.01),见图2。
2.3 镉暴露抑制ZKSCAN3 mRNA和蛋白的表达
本研究检测发现,与生理盐水对照组比较,镉暴露组ZKSCAN3基因表达显著较少(P<0.01),见图3a。同时,本课题组进一步检测ZKSCAN3蛋白在镉暴露后是否发生细胞质转位,结果显示,镉暴露降低了细胞核内ZKSCAN3蛋白的表达(P<0.01),却并未引起其明显的细胞质转位(P>0.05),见图3b。
2.4 过表达ZKSCAN3可抑制镉诱导的肝细胞自噬相关基因mRNA的表达
本研究检测发现,过表达ZKSCAN3可以扭转镉对ZKSCAN3基因mRNA的抑制(P<0.05),见图4a;过表达ZKSCAN3可以显著抑制镉诱导的Map1lc3b、Rab5a、Atp6v0d1、Lamp1、Ctsb等自噬相关基因mRNA的表达(P<0.01),见图4b~e。
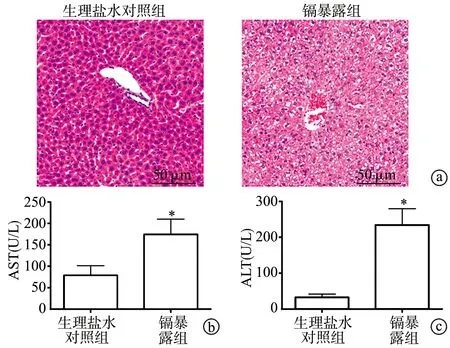
a:小鼠肝组织HE染色图;b:AST水平;c:ALT水平 *:与生理盐水对照组相比,P<0.01图1 急性镉暴露对小鼠肝组织形态的影响及血清生化指标分析
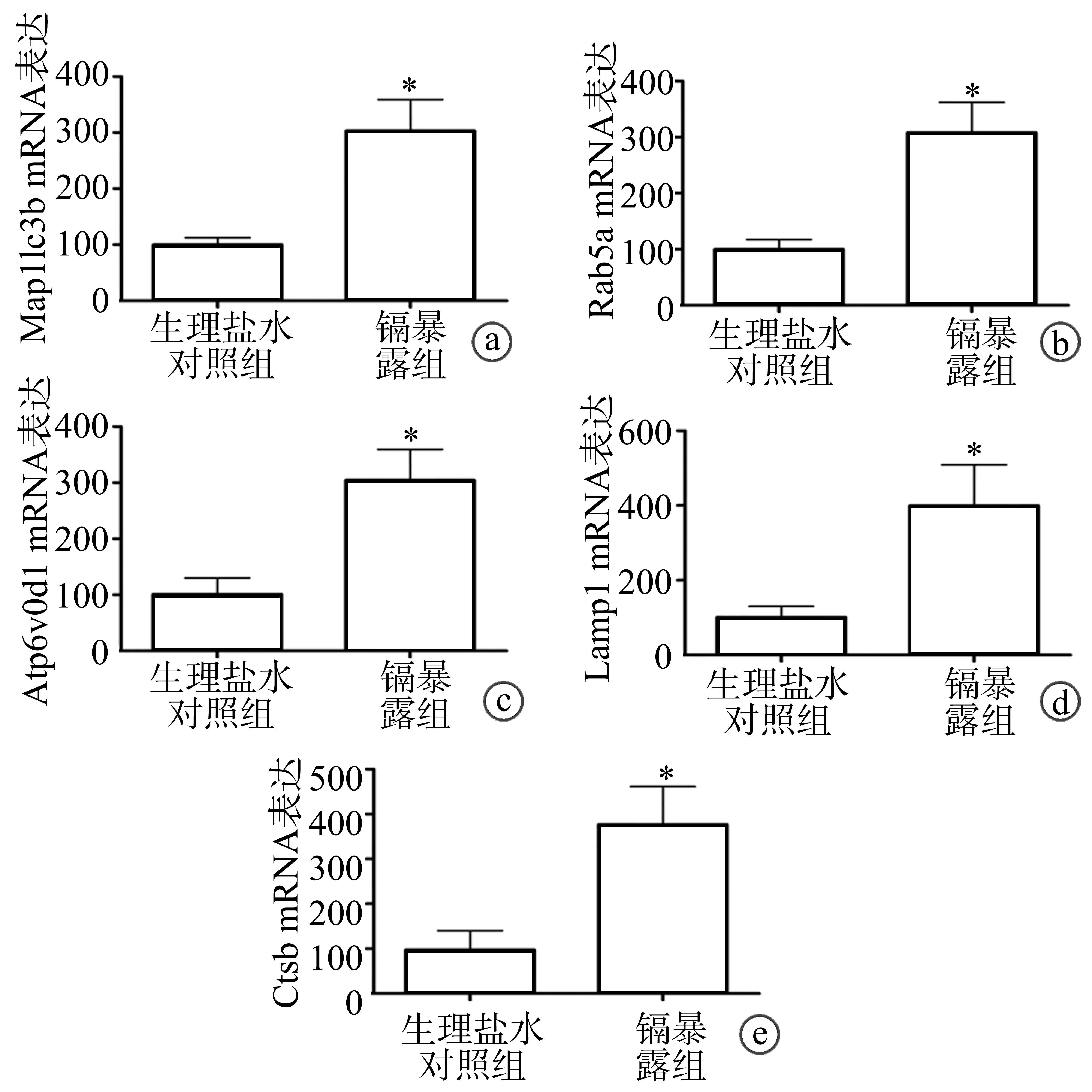
a:Map1lc3b;b:Rab5a;c:Atp6v0d1;d:Lamp1;e: Ctsb *:与生理盐水对照组比较,P<0.01图2 急性镉暴露肝组织中自噬相关基因mRNA表达
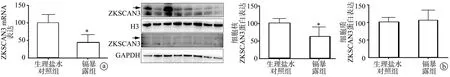
a:ZKSCAN3基因表达;b:ZKSCAN3蛋白的核质分布 *:与生理盐水对照组比较,P<0.01图3 镉暴露抑制ZKSCAN3蛋白的表达
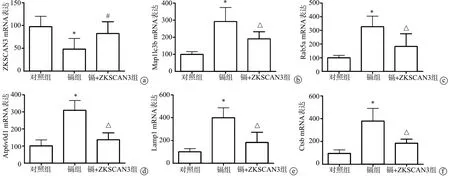
a:ZKSCAN3;b:Map1lc3b;c:Rab5a;d:Atp6v0d1;e: Lamp1;f: Ctsb *:与对照组比较,P<0.01;#:与镉组比较,P<0.05;△:与镉组比较,P<0.01图4 过表达ZKSCAN3对自噬相关基因mRNA表达影响
2.5 过表达ZKSCAN3可以抑制镉诱导的肝损伤
HE染色结果显示,过表达ZKSCAN3可显著减少镉组小鼠肝组织炎症细胞浸润,减轻局部肝细胞气球样变、坏死(图5a);与镉组比较,镉+ZKSCAN3组小鼠血清中肝功能生化指标ALT、AST显著较低(P<0.01),见图5b、c。

a:小鼠肝组织形态学;b:血清生化指标AST水平;c:血清生化指标ALT水平 *:与对照组比较,P<0.01;#:与镉组比较,P<0.01图5 过表达ZKSCAN3对急性镉暴露诱导的小鼠肝损伤的影响
3 讨论
肝是镉中毒的主要靶器官之一,目前国内外研究表明,镉导致的肝毒性主要机制包括:改变维持内环境稳定相关的某些基因表达;竞争性地抑制细胞膜上的各种离子通道,导致细胞内离子代谢特别是铁代谢的紊乱;改变线粒体膜通透性,诱导内质网应激及活性氧产生,促进凋亡及坏死[14-15]。尽管镉肝毒理机制已经有了一定进展,但是其作用机制依然缺乏系统的研究。本研究建立急性镉暴露小鼠模型,发现2 mg·kg-1·bw-1镉暴露 7 d可显著诱导小鼠肝损伤,且ZKSCAN3介导的自噬与镉肝毒性密切相关。
自噬-溶酶体途径是细胞维持稳态的重要生命过程,其基本过程包括自噬小泡的形成,自噬小体的组装、延伸和闭合,自噬小体与溶酶体的融合,及随后的包裹物在溶酶体水解酶的作用下降解,从而为细胞重新合成细胞器提供氨基酸等小分子原料[16]。在正常生理条件下,自噬可维持肝细胞内环境的稳定,自噬过度活化可导致肝细胞内细胞器损伤及肝细胞死亡[17]。细胞自噬性死亡与很多化合物的毒理机制密切相关[18]。Feng等[19]研究发现,吗啡能够显著诱导大鼠原代神经元自噬过度活化,导致神经元线粒体拷贝数下降、线粒体供能障碍、ATP水平下降,从而产生神经毒性。Su等[20]研究发现,自噬关键基因ATG7si-RNA通过抑制过度活化的自噬可以显著拮抗1-甲基-4-苯基-1,2,3,6-四氢吡啶引起的神经细胞死亡。本课题组前期研究结果已经在细胞层面证实了镉可以诱导肝细胞自噬过度活化。同时,Hao等[21]报道了镉暴露可以诱导hsa_circ_0040768介导的肝细胞自噬性死亡。Zhang等[22]研究发现,钙紊乱介导肝细胞自噬性死亡是镉肝毒性的重要靶点。本课题组前期研究也证明了镉暴露通过激活Ca2+-DNM1lL通路和抑制SIRT1-SIRT3-SOD2通路诱导肝细胞自噬性死亡[7-8]。本研究结果表明,镉暴露可以激活肝细胞自噬-溶酶体相关基因的表达,为镉诱导肝细胞自噬活化增添了体内研究证据。
ZKSCAN3是一个具有KRAB与SCAN结构域的锌指蛋白,KRAB结构域结合到DNA模板时可起到转录抑制的作用,SCAN结构域在C2H2锌指蛋白的组装与功能发挥上起到重要作用,而C2H2锌指结构域可结合DNA、RNA、蛋白及小分子物质,且不同的锌指序列及锌指间连接序列决定了该锌指蛋白的结合特异性[23]。细胞核ZKSCAN3减少会启动包括自噬成膜、自噬小体发生及成熟、自噬小体与溶酶体融合、溶酶体生成等一系列基因的表达,几乎涵盖了对整个自噬-溶酶体途径的调控[24]。Lei等[25]报道了A30P突变的α-突触核蛋白通过增加ZKSCAN3蛋白的表达抑制神经细胞的自噬流。同样有研究表明,HEP14化合物能诱导ZKSCAN3细胞质转位,促进细胞自噬,加强蛋白的降解和脂滴的代谢[10]。目前有研究显示ZKSCAN3的细胞质转位与其磷酸化水平密切相关[26]。本研究发现镉暴露抑制了ZKSCAN3蛋白的表达,但未引起其细胞质转位,可能与其磷酸化水平没有发生改变有关。然而过表达ZKSCAN3显著抑制了自噬-溶酶体基因的表达,这也证实了是ZKSCAN3的表达而不是其细胞质转位参与了镉诱导的急性肝损伤和细胞自噬性死亡。此外,最近有研究发现ZKSCAN3还可以通过保持异染色质的稳定性来拮抗细胞的衰老与死亡,而且这种功能并不依赖于对自噬的调控[27]。因此,ZKSCAN3在镉肝毒性中的作用值得进一步的探讨与研究。
综上所述,急性镉暴露可诱导小鼠肝细胞自噬性死亡,ZKSCAN3可能是镉诱导肝细胞自噬性死亡的重要靶点。本研究探讨了镉肝毒理作用的细胞靶点及分子机制,为开展镉肝毒性治疗和药物的研究提供了实验依据。

