miR-146a调控TGF-β/SMAD2信号通路对膝关节韧带损伤的影响
王 振,杜异凡,袁赞安,邝欢欢,位付涛
(联勤保障部队第九八八医院骨科,河南 郑州 450042)
膝关节是人体承受重力最多的关节,起着重要的支撑作用[1]。膝关节韧带损伤是由膝关节和韧带超负荷受力引起。近年来,膝关节损伤发生率有增加的趋势。在膝关节韧带损伤中内侧副韧带损伤通常较严重,且伤后其愈合能力较低,若未进行及时有效的治疗会引起创伤性关节炎等膝关节疾病,导致患者需要行内侧副韧带移植[2-3]。但由于移植物来源及数量有限等缺点,故膝关节韧带损伤的治疗非常棘手。目前,转化生长因子-β(transforming growth factor-β,TGF-β)是较高效的促纤维化因子,创伤后一般可依靠TGF-β信号来促进瘢痕增生[4]。应力可调控TGF-β1的表达,又可激活下游的SMAD2,并调节韧带干细胞的生长和迁移。TGF-β/SMAD2信号通路可调控基因的转录,转录后的mRNA也可调控TGF-β/SMAD2信号传导通路的相关基因[5-6]。有研究显示,miR-146a可改善关节损伤,其高表达可减少骨组织破坏,但由于影响内侧副韧带损伤的因素较多,miRNA对膝关节韧带损伤的研究机制并不完善[7-8]。因此,本研究通过建立兔膝关节韧带损伤模型,探究miR-146a是否通过调控TGF-β/SMAD2信号通路对膝关节韧带损伤产生影响,以期为膝关节韧带损伤的治疗提供更有效的方法。
1 材料与方法
1.1 实验动物
选择兔龄12周左右的雄性新西兰兔32只,体质量2~2.2 kg,购自联勤保障部队第九八八医院,在SPF级动物房中分笼饲养,室温维持在22oC左右,昼夜交替循环,自由摄食饮水。
1.2 试剂与仪器
石蜡切片机(德国LETIZ公司);光学显微镜(日本OLYMPUS公司);苏木素伊红染色试剂(北京京试化学试剂公司);戊巴比妥钠(天津药业焦作有限公司);碘伏(北京京试化学试剂公司);反转录试剂盒(TakaRa公司);miR-146 mimic(北京英格恩生物科技有限公司)。
1.3 动物模型与分组
将32只兔平均分为假手术组、模型组、安慰剂组及miR-146 mimic组,各组兔禁食1 d后用于实验。造模前所有兔禁水10~16 h。假手术组只切开皮肤并缝合,但不损伤前交叉韧带。对模型组、安慰剂组及miR-146 mimic组兔进行交叉韧带切断术,首先于兔耳缘静脉注射10%水合氨醛3 mL/kg进行麻醉,在兔的右膝关节作2 cm的切口,暴露髌骨并脱离,使膝关节最大程度弯曲,暴露前交叉韧带并全部剪断,然后用生理盐水反复清洗干净,逐层缝合,建模成功。miR-146 mimic组在建模成功后3 d,关节腔内注射1 mg/kg的miR-146 mimic,连续注射4周。安慰剂组将关节腔注射液替换为等量生理盐水,其余处理与miR-146 mimic组相同。术后所有兔均正常饲养,可自由活动,每天肌肉注射1次头孢唑啉(1.0 mg/kg),连续注射3周。所有兔于术后第9周处死。
1.4 兔膝关节行为学观察
参考改良的Lequesne MG膝关节级别评估方法,对各组兔进行膝关节行为学评估(表1)。

表1 Lequesne MG评分标准
1.5 兔膝关节大体观察
9周后停止对兔的干预,从每组兔中随机取出6只处死,随即进行解剖,观察兔膝关节的组织病理学表现,标准见表2。

表2 彭太平法组织病理学分级
1.6 内侧副韧带取材及力学测试
内侧副韧带取材:将兔处死后,取出膝关节部位及髌骨,保留好各处韧带,用纱布包裹、密封,置于-20 ℃保存,备用。内侧副韧带拉伸测试:测试前1 d取出样本,于4 ℃解冻。测试时测量内侧副韧带的长度、宽度和厚度,安装防脱夹。生物材料在应力作用下存在差异,实验前加上标准试样、卸载重复15次,预调后进行内侧副韧带拉伸试验,并计算最大位移、最大应力、最大应变和强度模量[9]。
1.7 内侧副韧带HE染色
用福尔马林将内侧副韧带组织固定72 h后进行脱钙处理,1周后进行酒精梯度脱水,最后将组织浸泡在100%的酒精中1 h。脱水后的组织放入二甲苯溶液中浸泡1 h,随后将组织置入石蜡中浸泡1 h并用石蜡包埋,切成厚度为5 μm的石蜡切片,再用热水将组织烫平后烘干。将石腊切片置入二甲苯溶液中浸泡20 min,重复2次。再次酒精梯度脱水后用蒸馏水浸泡。伊红染色后重新进行梯度脱水,并再次放入二甲苯溶液中浸泡24 h,晾干后滴入中性树脂并封固观察。
1.8 Western blot检测内侧副韧带TGF-β和SMAD2蛋白表达
分离兔内侧副韧带组织,剪成小块,按照10∶1的比例加入裂解液并转入EP管中,于4 ℃以14 000 r/min的速度离心10 min,离心后弃上清;随后于95 ℃将蛋白热浴变性10 min,后置于-80 ℃冰箱封存。将用BCA试剂盒定量后的蛋白样品进行电泳,电泳后将蛋白凝胶中的蛋白转移到PVDF膜上,转膜条件为50 V、3 h。转膜后将PVDF膜浸泡于TBST缓冲液中,摇晃1 h后孵育一抗,再用5%脱脂奶粉封闭1 h。再次用TBST漂洗10 min,反复3次。于36 ℃孵育二抗2 h后,使用TBST漂洗2次,TBS漂洗1次,每次10 min。使用ECL试剂检测蛋白,在暗室进行曝光,分析蛋白的相对表达量。
1.9 qRT-PCR检测内侧副韧带TGF-β和SMAD2 mRNA的表达量
逆转录(RT)和定量聚合酶链反应(qPCR)检测各组兔内侧副韧带组织中TGF-β及SMAD2的表达情况。按照RNase free dH2O 4.5 μL、5×RT反应缓冲液2 μL、Randam primer 0.5 μL、Oligo dT 0.5 μL、反转录酶0.5 μL、RNA 2 μL进行反转录反应。将cDNA样品分成3份,每组总cDNA样本稀释20倍,取3 μL cDNA进行PCR扩增反应。引物序列见表3。

表3 qRT-PCR引物序列
1.10 统计学处理

2 结果
2.1 兔膝关节行为学观察结果
假手术组、模型组、安慰剂组及miR-146 mimic组Lequesne MG评分分别为0分、(6.0±1.10)分、(6.1±1.23)分和(1.1±0.47)分。模型组、安慰剂组Lequesne MG评分显著高于假手术组和miR-146 mimic组(P<0.05),但模型组与安慰剂组比较差异无统计学意义(P>0.05)。假手术组兔膝关节无明显疼痛,可正常活动;模型组和安慰剂组兔膝关节有明显收缩情况,且行走不稳;miR-146 mimic组兔膝关节活动度有明显好转,能正常活动。
2.2 兔膝关节大体观察结果
假手术组兔膝关节软骨正常,无明显变化,且色泽光亮,软骨无缺失,关节液清澈透明,滑膜为淡红色,无充血和水肿情况发生;与假手术组兔比较,模型组及安慰剂组兔软骨裂痕明显,关节腔内液体增多,充血严重;与模型组、安慰剂组比较,miR-146 mimic组兔关节腔内液体、骨髓组织出血及结构紊乱情况明显减少/轻,膝关节活动度明显好转,接近于假手术组(图1)。

a:假手术组;b:模型组;c:安慰剂组;d:miR-146 mimic组图1 兔膝关节大体观察
2.3 内侧副韧带拉伸试验结果
miR-146 mimic组的最大应力和最大应变较其他组更强,差异有统计学意义(P<0.05);与模型组、安慰剂组比较,假手术组和miR-146 mimic组最大位移明显较长,差异有统计学意义(P<0.05),但miR-146 mimic组和假手术组比较,差异无统计学意义(P>0.05);与模型组、安慰剂组比较,假手术组和miR-146 mimic组强度模量较高,差异有统计学意义(P<0.05),见表4。从结果可知,模型组和安慰剂组膝关节韧带拉伸力学变化最大,miR-146 mimic组明显好转,提示miR-146a可有效改善这种拉伸力学特性。
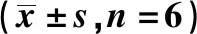
表4 兔膝关节内侧副韧带拉伸实验数据比较
2.4 兔内侧副韧带HE染色结果
假手术组兔HE染色显示软骨组织完整,表面平整,细胞排列有序;模型组和安慰剂组情况相似,软骨表面有明显的磨损,组织破坏严重,细胞较少且排列紊乱;miR-146 mimic组软骨表面较为平整且完整,软骨细胞排列规则,潮线较深且连续,见图2。
2.5 Western blot检测兔内侧副韧带TGF-β和SMAD2蛋白表达
模型组及安慰剂组TGF-β和SMAD2蛋白表达明显低于假手术组(P<0.05),其中模型组相对于假手术组TGF-β蛋白含量减少60.5%,SMAD2蛋白含量减少78.3%。miR-146 mimic组TGF-β蛋白和SMAD2蛋白表达明显高于模型组及安慰剂组(P<0.05),其中miR-146 mimic组相对于安慰剂组TGF-β和SMAD2蛋白含量分别增加了59.8%和73.2%,均接近于假手术组,见图3。
2.6 qRT-PCR检测兔内侧副韧带TGF-β和SMAD2 mRNA表达
与假手术组比较,模型组、安慰剂组兔内侧副韧带TGF-β和SMAD2 mRNA表达明显较少(P<0.05);与模型组、安慰剂组比较,miR-146 mimic组TGF-β和SMAD2 mRNA表达明显较多(P<0.05),见图4。
a:假手术组;b:模型组;c:安慰剂组;d:miR-146 mimic组图2 兔膝关节内侧副韧带HE染色(×400)

a:各组TGF-β和SMAD2蛋白表达电泳图;b:各组TGF-β和SMAD2蛋白表达定量分析 *:与假手术组比较,P<0.05;#:与miR-146 mimic组比较,P<0.05图3 兔内侧副韧带TGF-β和SMAD2蛋白表达
3 讨论
膝关节前交叉韧带是纤维软骨与内侧副韧带的结合,其中内侧副韧带最薄,是常见的韧带损伤部位[10-12]。内侧副韧带损伤主要分为部分断裂和完全断裂,部分断裂为韧带实质部的局部断裂、局部血肿,会影响膝关节活动;而完全断裂为横断、斜面或纵形断裂,会导致膝关节内侧失去联系,丧失稳定性[13]。膝关节韧带的重塑一直是韧带损伤修复关注的问题。研究显示,调控miRNA对于韧带损伤具有一定治疗作用[14],但具体调控机制尚不清楚。本研究通过建立兔膝关节内侧副韧带损伤模型,观察miR-146a转录调节因子在膝关节韧带中的凋亡和分化作用,发现TGF-β/SMAD2信号通路能对膝关节韧带损伤的恢复起到一定的促进作用。
有研究发现,miRNA在创伤后的修复中发挥着重要作用,相关靶基因通过调节miRNA促进细胞的增殖,从而对韧带损伤起到一定的修复作用[15]。本研究结果显示,与模型组、安慰剂组比较,miR-146 mimic组兔患肢轻度痉挛、稍肿胀、能正常活动;miR-146 mimic组最大应变和最大位移明显增加;膝关节韧带拉伸力学明显好转,可见miR-146a可有效改善这种拉伸力学特性,对内侧副韧带损伤的恢复有一定的促进作用。有研究显示miR-146a是先天性炎症反应的重要调节因子,与细胞凋亡有关[16];也有研究表明miR-146a在骨关节炎、关节软骨损伤等多种骨关节疾病中起保护作用[17-18]。因此,本研究推测miR-146a对内侧韧带损伤的保护作用可能通过直接或间接的方式抑制炎症因子活性。
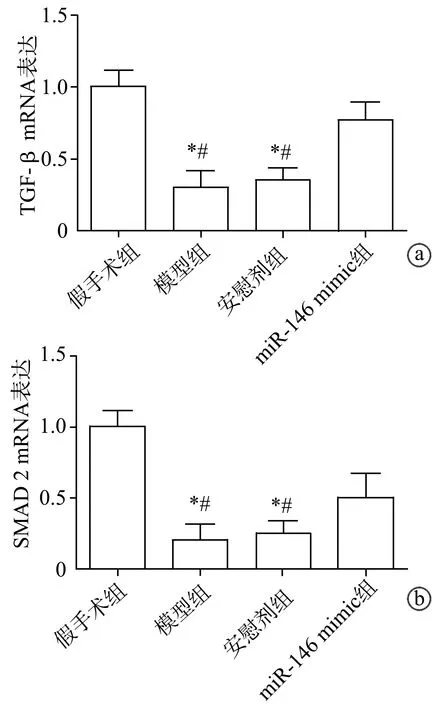
a:各组TGF-β mRNA的表达定量分析;b:各组SMAD2 mRNA表达定量分析 *:与假手术组比较,P<0.05;#:与miR-146 mimic组比较,P<0.05图4 兔内侧副韧带荧光检测TGF-β和SMAD2 mRNA表达
本研究HE染色结果显示,模型组、安慰剂组骨髓组织出血严重、结构紊乱;与模型组比较,miR-146 mimic组骨髓组织出血及结构紊乱情况明显好转。qRT-PCR及Western blot检测结果显示,模型组、安慰剂组TGF-β和SMAD2 mRNA和蛋白表达明显较少,miR-146 mimic组TGF-β和SMAD2 mRNA和蛋白表达明显增加,表明miR-146a对于韧带损伤具有修复作用。Kim等[19]的研究发现,在TGF-β刺激细胞后,SMAD2蛋白形成三聚体复合物并广泛激活下游靶基因,从而促进膝关节韧带损伤的恢复。而最新的研究发现,剪切应力诱导的miR-146a增多还可以通过靶向胶原蛋白促进血管生成[20],在一定程度上对韧带损伤修复后血供的恢复有一定的帮助,同时也证实了本研究的结论。
综上所述,miR-146a可促进TGF-β和SMAD2蛋白表达,加强韧带拉伸效果,促进膝关节韧带损伤的修复。

