孕酮通过ABHD2 受体介导的cAMP-PKA 信号通路调控精子受精功能的研究*
江 峰 朱 勇 陈 颖 汤晓峰 杨岳洲 陈国武 刘玉林 孙晓溪**
1. 上海集爱遗传与不育诊疗中心(上海200011);2. 复旦大学附属妇产科医院
孕酮属于类固醇类激素,是调节成熟精子功能最重要的生理激素之一,能瞬间增加精子胞内Ca2+离子和cAMP 含量,激活精子获能、超活化、趋化性和顶体反应等生理功能,孕酮生理效应主要通过相关性膜受体介导的非基因组效应完成[1]。 此后,2016 年发现了a/b 水解酶2 (abhydrolase domain containing protein 2,ABHD2) 是孕酮对精子靶蛋白中作用的非基因组效应的核心功能蛋白[2]。 然而,ABHD2 在不育症患者精子膜表面的表达情况暂无报道,我们拟通过比较临床不育(选择少弱精子症和顶体反应异常患者)与正常生育男性之间ABHD2 的表达, 探究不同组间是否存在差异。 另外ABHD2 如何快速激活胞内相关信号分子的功能还不清楚, 拟通过体外对ABHD2 上下游信号通路研究, 探明孕酮是否通过ABHD2 调控cAMP-PKA(环磷酸腺苷- 蛋白激酶A)信号通路进而影响精子的功能活性,对阐明受精机制和男性不育症诊疗等作用具有重要临床意义。
材料和方法
一、材料和主要试剂
按WHO《人类精液检查与处理实验室手册》(第5版) 确诊为男性少弱精子症组(排除精子浓度≤5×106/ml)、精子顶体反应测定异常组(精子顶体功能检测采用WHO 第五版推荐的PSA-FITC 染色法) 不育患者为研究对象(实验组)和将符合人类精子库捐精标准的正式捐精后生育者(对照组或正常生育组);年龄均小于35 周岁, 签署医学伦理知情同意书(JIAIE2017-08)。
Percoll 精子分离液、Trizol (sigma,USA)、TaKaRa反转录试剂盒(RR047A)、一般PCR 试剂(TaKaRa)、P4(孕酮)/BCA 蛋白定量试剂盒、人cAMP ELISA 试剂盒(苏州卡尔文生物科技有限公司)、细胞PKA 激酶活性定量检测试剂盒(上海杰美基因医药科技有限公司/GMS50059.1)、ABHD2 一 抗(Abcam/ab230417)、精 子顶体染色试剂盒(安徽安科生物工程公司)等。
二、实验分组及方法
(一)ABHD2 在男性不同组mRNA 表达变化
1. 分组:均禁欲2-7 天,采用手淫取精置于无菌取精杯。按照WHO 精液参数标准第5 版要求进行检查前准备及精液分析评估进行分组。 正常组精子样本、少弱精子组样本(排除精子浓度≤5×106/ml)、顶体异常精子组样本,每组30 例样本。
2.RNA 提取及RT-PCR 分析:将Percoll 分离获得的精子,精子RNA 提取采用Trizol(sigma,USA),4℃,12000 g 离 心5 min。 参 照 TaKaRa 反 转 录 试 剂 盒(RR047A)说明书,配置20μL RNA 和缓冲体系,42℃放置5min,37℃放置20min,80℃放置1min。 采用罗氏Roche480 荧光定量PCR 仪和软件, 将β-actin 作为内参, 引物的序列如下:β-actin 上游引物(5'-3')ATCTC CTTCTGCATCCTGTCGG, 下游引物(5'-3')CATGGAG TCCTGGCATCCACGA;ABHD2 上游引物(5'-3')CCTC ATGTTTGCCTTCTTTGC,下游引物(5'-3')GGCGGGTA CATTTCTCCATC。 进行荧光定量PCR 和数据结果分析。
3. Western-blot(蛋白质印迹法WB)检测ABHD2的蛋白表达水平: 利用Trizol 法提取精子的总蛋白,利用BCA 蛋白定量法进行定量,Western-blot 检测ABHD2 表达情况。
(二)不同研究个体对孕酮的敏感性研究
1. 实验分组:分为实验组(少弱精子症组)、实验组+ 孕酮(P4)、对照组(捐精后生育组)、对照组+ 孕酮(P4),每组10 个样本。 因后续实验需观察顶体反应等,故第一部分顶体反应异常者不再后续入组。
2.方法: 将Percoll 分离获得的精子, 在37℃,5%CO2孵育箱中孵育3.5h 使精子获能, 然后参考相关文献[3,4]按上述分组加入3μM(μmol/L)孕酮(P4)继续孵育2h 后进行后续实验。
3.Western-blot(蛋白质印迹法)检测ABHD2 的蛋白表达水平(4 组X1 个指标):利用Trizol 法提取精子的总蛋白, 利用BCA 蛋白定量法进行定量,Western-blot 检测ABHD2 表达情况。
(三)调控cAMP-PKA 信号通路影响精子功能活性研究
1. 实验分组(4 组):正常生育组(A)、正常生育组+P4(B)、正常生育组+P4+ABHD2 抗体(C)、正常生育组+P4+PKA 拟制剂H-89(D)。
2.方法: 将Percoll 分离获得的精子, 在37℃,5%CO2孵育箱中孵育3.5h 使精子获能,B 组加入3μM 孕酮(p4),C 和D 组在P4 加入前分别用ABHD2 抗体和PKA 拟制剂H89 100 μM,预处理15min,加入P4,2h 后进行后续实验。
3.ELISA 检测cAMP、PKA 的水平: 处理结束后,收集精子细胞,加入细胞裂解液,用ELISA 检测cAMP和PKA 的水平。
4.FITC-PSA 染色检测各组精子的顶体反应:用精子顶体染色试剂盒, 精子处理后加入工作液, 固定封片,荧光显微镜下观察精子涂片。
三、统计学方法
运用SPSS 20.0 软件进行统计,组间比较采用单因素方差分析,差异显著性为P<0.01。
结 果
一、荧光定量PCR 结果
检测正常生育组、少弱精子组、顶体异常组中ABHD2mRNA 水平表达变化。结果如图1 所示,和正常生育组相比,少弱精子组和顶体异常组中ABHD2 mRNA水平显著减少(F:90.84,P<0.01)。
二、三组ABHD2 水平两两比较
顶体异常组与少弱精组差异具有统计学意义(F:7.46,P<0.01)。 顶体异常组与正常组差异具有统计学意义(F:13.45,P<0.01)。 少弱精子组与正常组差异具有统计学意义(F:5.99,P<0.01)。 Western blot(蛋白质印迹法)检测正常生育组、少弱精子组和顶体异常组中ABHD2 蛋白水平表达变化。结果如图1 所示,显示和正常生育组相比,少弱精子组和顶体异常组中ABHD2 蛋白水平显著减少。
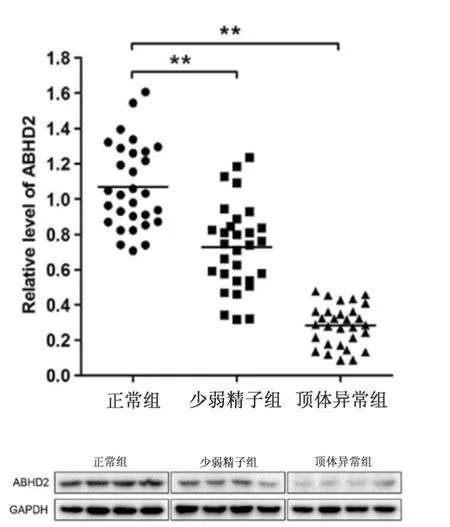
图1 荧光定量PCR、WB 分析各组ABHD2 蛋白表达变化
三、观察不同个体精子对孕酮(P4)的敏感性差异
Western blot 检测对照组、对照组+P4、实验组和实验组+P4 中ABHD2 蛋白水平表达变化。结果如图2所示,结果显示,和对照组相比,实验组中ABHD2 蛋白水平表达明显减少; 在对照组中加入孕酮处理后,ABHD2 蛋白水平表达明显增加。 而实验组中加入孕酮处理后, 与未加孕酮相比,ABHD2 蛋白水平表达增加不明显。
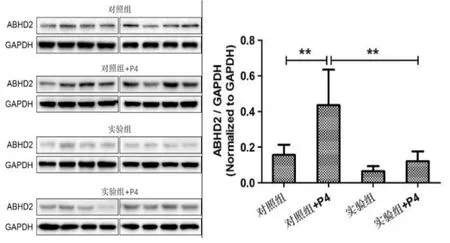
图2 WB 分析各组中ABHD2 蛋白表达变化
四、ELISA 检测正常生育组、正常生育组+P4、正常生育组+P4+ABHD2 抗体、正常生育组+P4+PKA 拟制剂H-89 中PKA 活性变化
结果如图3 所示,和正常生育组相比,在正常组中加入P4 处理后,PKA 活性极显著增加(P<0.01),继续加入ABHD2 抗体或PKA 拟制剂H89 后PKA 活性均显著减少(P<0.01)。
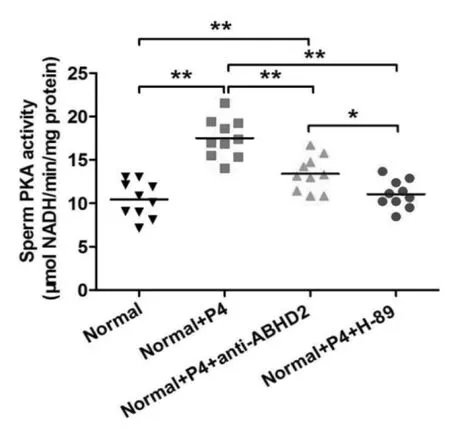
图3 ELISA 分析各组中PKA 活性变化
五、ELISA 检测正常生育组、 正常生育组+P4、正常生育组+P4+ABHD2 抗体、正常生育组+P4+PKA 拟制剂H-89 中cAMP 浓度变化
结果如图4 所示,和正常生育组相比,在正常组中加入P4 处理后,cAMP 浓度极显著增加(P<0.01),继续加入ABHD2 抗体或PKA 拟制剂H89 后cAMP 浓度均显著减少(P<0.01)。
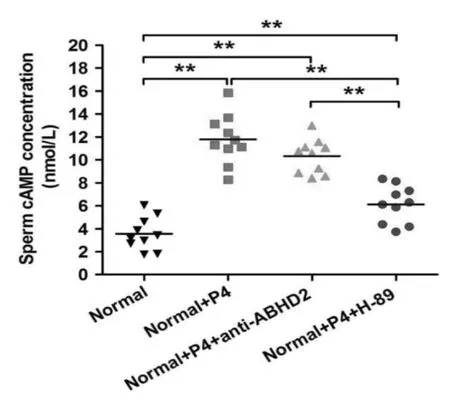
图4 ELISA 分析各组中cAMP 浓度变化
六、FITC-PSA 染色检测各组精子的顶体反应
结果如图5 所示, 结果显示在正常生育组和正常生育组+P4 中,顶体完整,精子头部荧光染色明亮且均匀, 特别是在正常生育组+P4 中, 赤道带也出现荧光带。 正常生育组+P4+ABHD2 抗体、 正常生育组+P4+PKA 拟制剂H-89 中精子头部荧光染色稍微减弱,赤道带未出现荧光带。
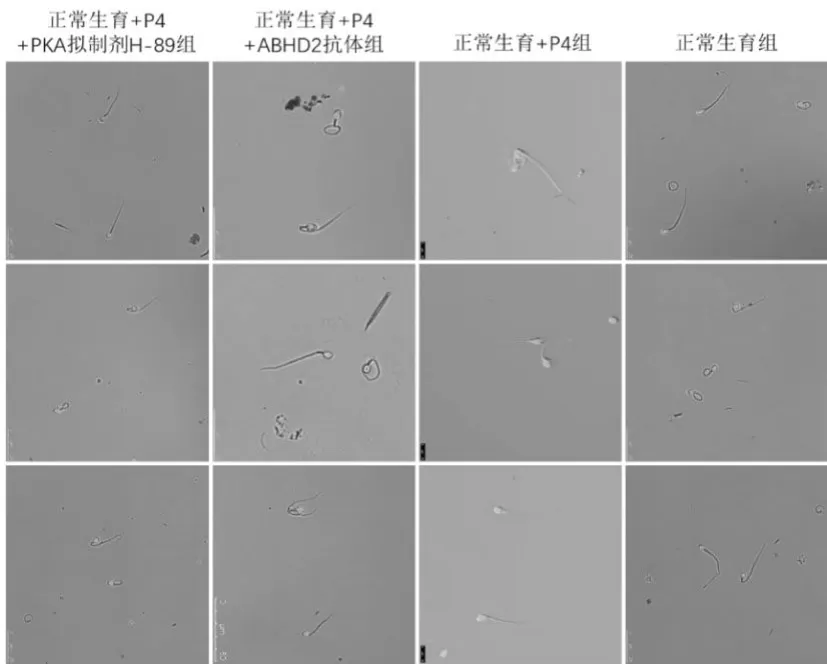
图5 FITC-PSA 染色检测各组精子的顶体反应变化
讨 论
孕酮(P4)通过激活人类和小鼠精子表面的钙离子通道(CatSper)来调控精卵结合功能。已有研究表明,精子获能、顶体反应及精子趋化作用都依靠钙离子内流,钙离子通道发生障碍或缺失会导致不育[5]。 孕酮作为胞外信号,能够通过ABHD2[2],激活人类精子的CatSper,从而强力激发精子鞭毛上的主要Ca2+离子通道, 直接诱导钙离子内流[6],无须激活核内受体,发挥非基因组性质的激活效应。 ABHD2 的作用具体机制首先与孕酮结合, 激活ABHD2 从而分解三酰甘油脂肪, 产生2AG, 使 得CatSper 的 抑 制 剂1AG/2AG 转 化,使CatSper 处于活化状态,Ca2+离子内流,激活下游信号而起作用[7]。 然而,ABHD2 在临床不育患者中的表达模式差异, 以及如何快速激活胞内相关信号分子的功能研究还少有报道。
本研究首先通过比较正常生育组与少弱精子症组、顶体反应异常组精子之间在ABHD2 mRNA 和蛋白水平表达变化,发现组间的明显差异,且同样为不育病人, 顶体反应异常组表达水平发生变化更明显高于少弱精子症组(图1),在辅助生殖临床上也反映出受精率低等表现。 另外初步比较对照组(正常生育组)与实验组(少弱精子组)之间ABHD2 在蛋白水平表达上存在明显差异,同时添加孕酮(P4)处理后,在对照组中ABHD2 蛋白水平表达明显增加。 而实验组与未加孕酮时相比,ABHD2 蛋白水平表达增加不明显。 说明不同个体存在表达差异、调控差异,以及对孕激素的敏感性存在差异, 这种差异或能成为评估精子活性和辅助生殖中精卵结合的趋化作用等的新功能指标。
环磷酸腺苷- 蛋白激酶A(cAMP-PKA)是被发现参与类固醇类激素调控的非基因组效应的细胞第二信使,其调控主要是通过激活腺苷酸环化酶,增加细胞内cAMP 含量,从而活化cAMP 依赖的PKA,导致精子中相关蛋白丝氨酸、苏氨酸磷酸化以及酪氨酸磷酸化,进而调节精子获能、超活化、趋化性和顶体反应等多种生理过程[8]。 本研究通过正常生育组添加P4 处理后,PKA活性和cAMP 浓度极显著增加,继续加入ABHD2 抗体或PKA 拟制剂H89 后,PKA 活性和cAMP 浓度则均显著减少。并且通过FITC-PSA 染色检测不同组精子的顶体反应,正常生育组和+P4 组顶体完整,精子头部荧光染色明亮且均匀, 特别是在正常生育组+P4 中赤道带也出现荧光带,ABHD2 抗体组和PKA 拟制剂H89组精子头部荧光染色稍微减弱,赤道带未出现荧光带,证实了孕酮与ABHD2 蛋白结合对调控cAMP-PKA 信号通路的影响, 以及激活精子Ca2+离子依赖性顶体反应等生理功能。
早期已有发现表明, 孕酮可以通过竞争性拟制物(如睾酮、氢化可的松)来调控CatSper 通道[9]。 而ABHD2 的发现,不仅可以帮我们解释某些不明原因不育,如果找到阻断ABHD2 的方法,我们就会发现另一种避孕的方法[10]。 本研究初步探明精子胞内cAMP-PKA 通路可干扰孕酮激素与ABHD2 蛋白结合, 封锁CatSper通道, 可以阻止精子的活跃运动, 使其重回非激活状态。 但这种机制并不会影响自然状态下精子本身细胞存活,即精子细胞无毒副作用,精子依然可以游动,只是没有足够的动力促使它们进入卵细胞而已[11-12]。 对ABHD2 上下游信号通路的研究对阐明受精作用、男性不育机制、研发新型非激素类避孕药,以及研究类固醇激素的临床作用机制也提供了非常重要的基础。

