热应激致大鼠睾丸中热休克蛋白A2及几种热休克转录因子的表达变化研究*
李 锐 陈雪丹 张庆华**
1. 陆军军医大学大坪医院生殖医学中心(重庆400042);2. 陆军军医大学基础医学院医学遗传学教研室(重庆400038)
前 言
男性不育已成为一个全球性的人口健康问题,而精子质量下降是造成男性不育的主要原因。 Levine 等[1]研究发现, 仅1973 年至2011 年人类精子数量就下降了52.4%。 睾丸是精子发育的重要场所,影响其正常结构和功能的外界因素众多,大体上可分为物理因素、化学因素以及生物因素。 其中,物理因素中的高温对精子的损伤机制为研究热点之一。
热休克反应(Heat-Shock Response,HSR)是生物机体在热应激(或其他应激)状态下所表现的一种以基因表达变化为特征的防御适应性反应。 对于大多数体细胞,这种反应旨在保护细胞免受损伤[2],但对于睾丸内的生殖细胞(主要是减数分裂细胞和减数分裂后的细胞),热应激并未促发这种保护性反应。 与此相反,受影响的生殖细胞通过凋亡途径被清除了[3]。 现有研究表明,热应激可导致精子浓度降低,精子活性及运动能力受损[4]。 此外,热应激下精子头部的某些性状也可发生改变,并直接影响受精[5]。 但热应激导致精子发育功能障碍的内在机制还知之甚少。 既往研究提示[6-8],热应激可能通过诱导普列克底物蛋白同源样结构域家族A 成员1 蛋 白(pleckstrin homology-like domain family A member 1,PHLDA1)、 佛波醇-12- 肉豆蔻酸-13- 乙酸诱 导 蛋 白 1(Phorbol-12-myristate-13-acetate-induced Protein 1, PMAIP1)、半胱氨酸蛋白酶-3(caspase-3)等的表达上调,最终引发生精细胞凋亡。 这可能在一定程度上说明热应激致精子数量减少的本质原因, 却很难解释由热应激所导致的精子活性及运动能力损伤。 因此,一个可能的推测是,多种因素联合作用共同介导了热应激下精子损伤的发生。 现已知一系列热休克蛋白(heat shock protein , HSP ) 及 热休 克 转录因子(heat shock factor,HSF)参与了精子发育过程。尤其是热休克蛋白A2(heat shock protein A2,HSPA2),其为一种在睾丸中组成型高表达的HSP, 大量研究证实其对精子发生及其成熟都是必不可少的, 而HSF 在精子发育中的作用也见诸报道[9-10]。 HSF 又是调节HSP 表达的转录因子,研究发现[10],人基因组共编码6 种HSF,即HSF1、HSF2、HSF4、HSF5、HSFX 和HSFY,它们在哺乳动物精子发生的过程中均有表达,但其表达谱呈现较大差异,其中HSF5 和HSFY 仅在睾丸中表达,HSF2 为全身性表达,但在睾丸中表达量较高,HSF4 可见于多种组织,但主要在晶状体中表达,而HSF1 为全身性表达,无明显组织特异性,是介导热休克反应的主要转录因子。
本研究试图通过构建大鼠生殖系统的热应激模型, 对大鼠睾丸中的HSPA2 及几种HSF 作定量分析,以期进一步揭示热应激致精子发育功能障碍的可能机制, 同时可为热应激造成男性不育的基因治疗和新药研发提供一定的理论依据。
材料与方法
一、实验动物
16 只SPF 级雄性SD 大鼠购自陆军军医大学实验动物中心,8 周龄,体重约180~210g,均安置在带有松木屑垫层的聚碳酸酯笼子中,饲养于 以12 小时为周期明/暗交替、 温度及湿度可控的房间内,SPF 级大鼠维持饲料(北京华阜康生物科技股份有限公司,2010250213)及饮水可自由获取。 陆军军医大学实验动物中心为重庆市市场监督管理局计量认证合格单位,由重庆市实验动物质量检测中心作公正性申明。 动物饲养及操作严格遵守陆军军医大学动物保护与利用专业委员会有关规定。 本研究所用动物及使用已获陆军军医大学动物福利伦理委员会批准。
二、主要仪器与试剂
HOPE-MED 8150E 型特定环境智能型模拟实验舱(天津合普公司),CFX Connect 实时定量PCR 仪(美国Bio-Rad 公司),PowerPac Basic 基本型电源电泳仪、ChemiDoc Touch 化学发光成像系统(美国Bio-Rad 公司), 荧光定量PCR 试剂盒2×TSINGKE Master qPCR Mix(SYBR Green I)(擎科新业生物技术有限公司,TSE201),HSPA2 特异性单克隆抗体(华安生物技术有限公司,ET1701-15),HSF1 多克隆抗体(博奥森生物技术有限公司,bs-3757R),HSF2 多克隆抗体(博奥森生物技术有限公司,bs-1409R),HSF5 多克隆抗体(美国赛默飞世尔科技公司,PA5-69484),HSFY 多克隆抗体(美国赛默飞世尔科技公司,PA5-28352),次黄嘌呤磷酸核糖基转移酶(Hypoxanthine-guanine phosphoribosyltransferase,HPRT) 单克隆抗体(杭州华安生物技术有限公司,JU03-26),HRP 标记山羊抗兔二抗(联科生物技术股份有限公司,70-GAR007)。
三、实验方法
(一)实验分组及模型建立
将16 只大鼠适应性饲养1 周后,随机等分为热应激组和对照组。 开启HOPE-MED 8150E 型特定环境智能型模拟实验舱(以下简称高温舱),设定温度为43℃,待舱内温度上升至设定值并稳定片刻后,将热应激组8只大鼠连同聚碳酸酯笼子(撤去饲料及饮水) 一起置入,计时30 分钟后取出。 对照组8 只大鼠除不进行热应激处理外,其余处理与热应激组完全相同。
(二)取材
热应激组大鼠于高温舱内取出后3 小时(鉴于3小时为热应激模型的关键时相点之一[11-13]),处死所有大鼠,将其仰卧放置于实验台上,用外科剪剪开其下腹部皮肤层及肌肉层后, 以镊子向头侧方向牵引下腹部脂肪组织,待双侧睾丸显露后,分离出附睾及周围脂肪组织,将取下的睾丸组织分装编号,先以液氮速冻,再保存于-80℃。
(三)实时荧光定量PCR 法检测睾丸组织中HSPA2、HSF1、HSF2、HSF5、HSFY 及HPRT 基因mRNA 的表达
HSPA2、HSF1、HSF2、HSF5、HSFY 及HPRT(内参)基因引物序列如表1 所示, 所有引物均由擎科新业生物技术有限公司合成。 将取材于热应激组和对照组大鼠的睾丸组织全部自-80℃取出,各称取约20 毫克,使用RNAprep Pure Tissue Kit 法提取大鼠睾丸组织总RNA,经Goldenstar RT6 cDNA Synthesis Kit Ver.2 法逆转录得到各自的cDNA,最后使用表1 所示引物,根据2×TSINGKE Master qPCR Mix(SYBR Green I)法进行实时荧光定量PCR(反应体系10μl,反应条件:95℃预变性3 分钟;95℃10 秒,57℃10 秒,72℃30 秒,共40 个循环)。 PCR 反应结束后,对熔解曲线及其变化率曲线进行分析,观察是否存在非特异性扩增。 根据反应所得Ct 值,以HPRT 为内参,按照2-ΔΔCt 法计算目的基因mRNA 相对表达量。

表1 实时荧光定量PCR 引物序列及扩增产物长度
(四)Western blot 法检测睾丸组织中HSPA2、HSF1、HSF2、HSF5、HSFY 及HPRT 蛋白的表达
于-80℃取出全部16 份大鼠睾丸组织样本, 各称取约100 毫克置于EP 管中, 依次加入1ml RIPA 裂解液,10μl PMSF,提取总蛋白。将待测样品依次加入上样孔进行电泳,采用半干转法转膜7 min,封闭约1.5 h。根据目的蛋白条带所在位置裁剪PVDF 膜后, 加入到对应的一抗溶液中,4℃孵育过夜。 经TBST 洗涤3 次(20min/ 次)后,加入二抗溶液中,4℃孵育约1.5 h。 经TBST 洗涤3 次(20min/ 次)后,置于ChemiDoc Touch化学发光成像系统中拍照。 以HPRT 为内参,各目的蛋白表达量以相对灰度值表示。 实验过程中,各目的蛋白和内参蛋白上样体积、一抗及二抗稀释比例见表2。
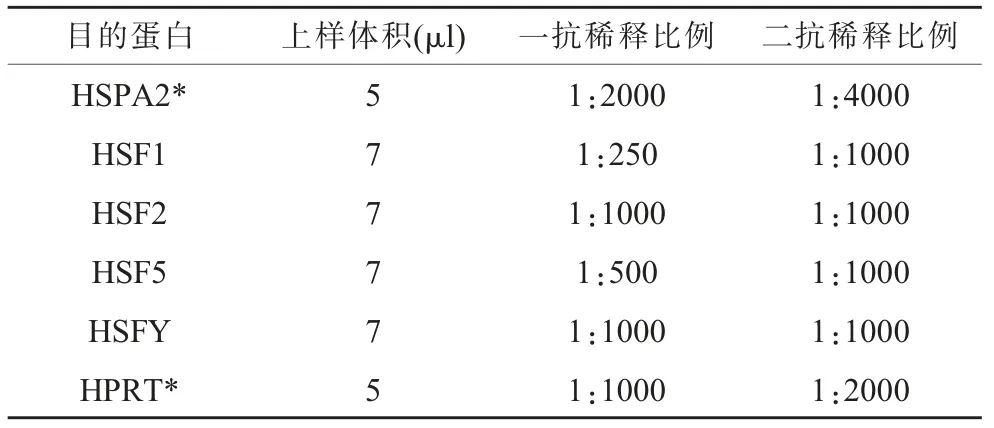
表2 目的蛋白及内参蛋白上样体积、一抗及二抗稀释比例
(五)数据分析
使用SPSS 20.0 对数据作统计分析。 本研究对大鼠分组采用的是完全随机法, 热应激组与对照组为两组独立样本。 分别对两组数据作正态性检验和方差齐性检验,若符合参数检验条件则使用T 检验,不满足参数检验条件时使用非参数检验法。 对于检验结果的解读:若P>0.05 则判定差异不显著,结果无统计学意义;若P<0.05 则判定差异显著,P<0.01 则判定差异极显著,此二者结果均具有统计学意义。 使用GraphPad Prism 8.0对数据进行统计作图。
结 果
一、热应激对大鼠睾丸组织中HSPA2、HSF1、HSF2、HSF5、HSFY 基因mRNA 表达量的影响
热应激组与对照组睾丸组织中HSPA2、HSF1、HSF2、HSF5、HSFY 基因mRNA 表达的检测结果如图1 所示。与对照组相比,热应激组HSPA2(P<0.0001,1A)、HSF2(P=0.0006,1C)及HSFY(P=0.0002,1E)的相对表达量极显著降低,HSF1(P=0.0102,1B)与HSF5(P=0.0237,1D)的相对表达量显著降低。
二、热应激对大鼠睾丸组织中HSPA2、HSF1、HSF2、HSF5、HSFY 蛋白表达量的影响
热应激组与对照组睾丸组织中HSPA2、HSF1、HSF2、HSF5、HSFY 蛋白的检测结果及其相对表达图如图2、图3 所示。热应激组与对照组HSPA2(P=0.5624,3A)、HSF1(P=0.3292)、HSF2(P=0.9928,3C)、HSF5(P=0.8118,3D)、HSFY(P=0.6864,3E)的表达量无显著差异。
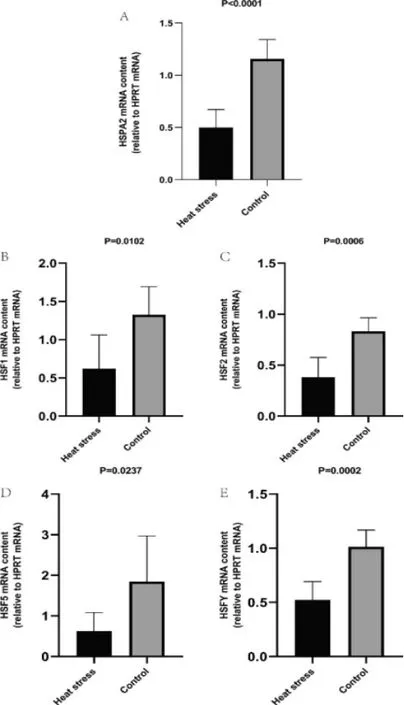
图1 热应激组与对照组睾丸组织中HSPA2、HSF1、HSF2、HSF5、HSFY 基因mRNA 相对表达量的比较
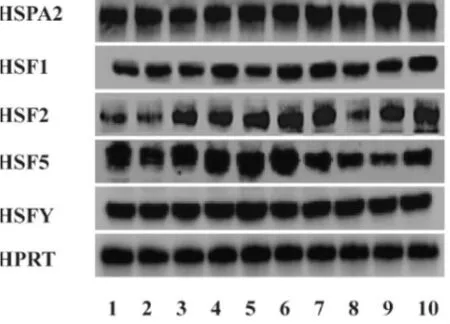
图2 热应激组与对照组睾丸组织中HSPA2、HSF1、HSF2、HSF5、HSFY 蛋白的Western 印迹图
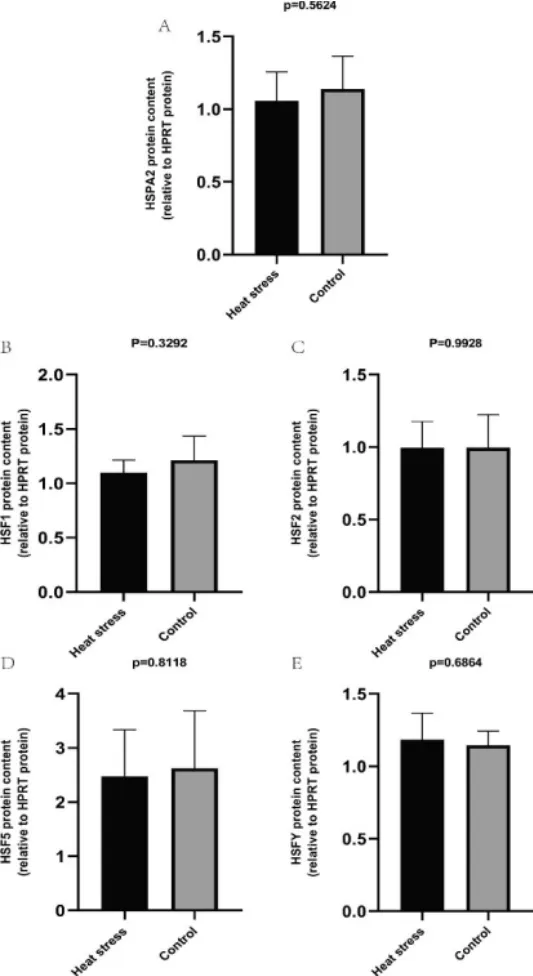
图3 热应激组与对照组睾丸组织中HSPA2、HSF1、HSF2、HSF5、HSFY 蛋白相对表达量的比较
讨 论
男性不育问题已在全球范围内引起了广泛关注,而造成男性不育的关键因素就是精子质量的下降。 精子的发生及其成熟是极其复杂的生物学过程, 因此导致精子发育功能障碍的因素也可能是多方面的, 而高温正是其中之一。 既往研究从不同角度回答了热应激导致精子数量减少的内在原因, 但热应激致精子活性及运动能力损伤的本质原因却少见报道。 据此推测,热应激致精子发育损伤可能涉及到更多不同的机制。
现有研究表明,在睾丸中大量表达的HSPA2 表达异常或功能障碍,都会显著地影响精子发育,这种影响不仅体现在精子发生的过程中, 还体现在精子功能转化的过程中,最终可能导致精子数量减少、形态异常以及功能障碍[9]。 此外,有研究指出,HSF 也与精子发育过程紧密相关, 被单独敲除HSF1 或HSF2 的雄性小鼠,其精子数量明显减少, 头部形态异常的精子数量明显增多,有趣的是,这些雄性小鼠的生育能力并未显著降低, 但被同时敲除HSF1 和HSF2 基因的雄性小鼠,则因精子发生完全受阻而表现为绝对不育[10]。 综上所述,我们认为HSPA2 及HSF 很可能在热应激过程中介导了精子损伤的发生。 本研究选择在睾丸中高量表达的HSPA2,在睾丸中特异性表达的HSF5 和HSFY,主要在睾丸中表达的HSF2 以及介导热休克反应的关键转录因子HSF1 作为重点研究指标,试图通过构建大鼠热应激模型, 从动物水平上探索热应激致精子发育功能障碍的可能机制。
本研究通过实时荧光定量PCR 技术检测了热应激组与对照组HSPA2、HSF1、HSF2、HSF5 及HSFY 基因mRNA 的相对表达量,结果发现对照组HSPA2(P<0.0001,1A)、HSF2(P=0.0006,1C)及HSFY(P=0.0002,1E)的相对表达量极显著高于热应激组,HSF1(P=0.0102,1B)与HSF5(P=0.0237,1D)的相对表达量显著高于热应激组。 Krawczyk 等研究发现,为大鼠实施隐睾术后2 天,检测到2.5 kb RNA(即HSPA2)显著降低,该发现与本研究结果中热应激致HSPA2 基因mRNA 表达下调相一致, 同时也可能为临床上常见的隐睾或可回缩睾丸(睾丸常位于阴囊与腹股沟管之间,将扪及的睾丸逐渐推入阴囊内, 松手之后睾丸能在阴囊内停留, 并非隐睾)所致的生育功能障碍提供一定的解释,但从本质上讲,无论是暴露于高温环境,施行隐睾术,还是先天性隐睾或可回缩睾丸都客观上破坏了精子发育的最佳条件[14](通常阴囊内部温度比核心体温大约低2~7℃),均可能通过诱导热应激反应致使HSPA2 表达下调,并进一步影响正常精子发育。 既往研究表明,HSF1 是热休克反应的主要调节因子。 生理条件下,它以无活性的单体形式存在于与HSP 及其他蛋白质的复合体中。 应激条件下,其可从与之相结合的复合体中解离,这些非结合单体可进一步转变为具有转录活性的三聚体。 在多数哺乳动物细胞和组织(如肝、肾、肺)中,HSF1 在41℃或更高温度下才会激活, 而在睾丸中,HSF1 在较低温度(35~38 ℃)下即可被激活。 有趣的是,本研究发现热应激下睾丸中HSF1 基因mRNA 的表达量实际是下调的。 有研究显示,HSF1 在热应激下可能具有两种完全相反的功能, 其在耐热细胞中(大多数体细胞皆属此类)可激活保护性HSP 的表达,此时促凋亡蛋白的表达是受阻的, 而在热敏感细胞中则可激活促凋亡蛋白的表达,此时保护性HSP 的表达是受阻的。 既往研究表明, 活化的HSF1 并未在减数分裂和减数分裂后的生精细胞中诱导保护性HSP 表达,相反,HSF1 通过激活促凋亡蛋白(PMAIP1,PHLDA1)表达,最终导致生精细胞凋亡[10]。 显而易见,睾丸中的生精细胞(主要指减数分裂和减数分裂后的生精细胞)属于热敏感细胞。尽管热应激下HSF1 表达下调的内在机制尚不得而知,但如前所述, 当活化的HSF1 在热敏感的生精细胞中介导凋亡途径时,保护性HSP 的表达受阻。 因此,我们似乎可以作出一个合理的推测, 即HSF1 的表达下调与保护性HSP 的表达受阻很可能具有某种内在关联,但尚需进一步研究证实。尽管单独敲除HSF1 或HSF2 并没有对雄性小鼠的生育能力造成显著影响, 但同时敲除HSF1 和HSF2 时直接导致了雄性小鼠的绝对不育。造成这种奇怪现象的一个可能原因是,HSF1 和HSF2之间具有功能互补性。 不难发现,HSF1 和HSF2 与精子发育也具有紧密关联, 尽管其调节精子发育的具体机制目前尚不明确, 但可以推断两者表达水平同时降低极可能会影响正常的精子发育。关于HSF5 和HSFY的功能目前尚少见文献报道, 但作为睾丸中特异性表达的两种热休克转录因子, 其对精子发育的作用值得深入探讨, 对其作用的揭示也有助于阐明热应激致精子发育功能障碍的内在机制。综上所述,我们推测热应激很可能通过下调HSPA2、HSF1、HSF2 的表达介导精子损伤的发生。 值得注意的是,HSF5 和HSFY 的表达也显著下调了, 但关于两者在精子发育中的确切作用还有待进一步研究。
本研究WB 实验结果显示, 热应激组与对照组HSPA2(P=0.5624,3A)、HSF1(P=0.3292)、HSF2(P=0.9928,3C)、HSF5(P=0.8118,3D)和HSFY(P=0.6864,3E)蛋白相对表达量均未见显著差异, 与实时荧光定量PCR 的结果不一致。 原因可能是多方面的。 第一,既往研究表明HSF 可经历多种翻译后修饰,如磷酸化、乙酰化、苏素化、泛素化等,而HSPA2 也可发生翻译后修饰[15]。 热应激可能会改变蛋白质的翻译后修饰状态, 进而影响其抗原性,并最终对WB 的定量结果造成干扰。 第二,基因表达包含了转录和翻译两个层面, 而转录和翻译发生的时间和位点是存在时空间隔的, 所以一个可能的原因是, 实验过程中处死大鼠的时间点HSPA2、HSF1、HSF2、HSF5 及HSFY 蛋白表达尚未发生显著差异。 第三,相比于WB 检测蛋白,实时荧光定量PCR 检测mRNA 的灵敏度要高很多,因此在本实验中,热应激组与对照组蛋白的相对表达值可能已经存在实质性差异,只是WB 未能检出。 第四,实验样本量太少或样本之间的个体差异性太大,或样本的代表性不足,也可能是导致WB 实验结果与实时荧光定量PCR 结果不一致的重要原因。 总之,本研究尚存在诸多不足之处,我们将在后期研究中进一步探索。
综上所述, 本研究证实热应激导致大鼠睾丸中HSPA2、HSF1、HSF2、HSF5 及HSFY 基因mRNA 表达量显著下调,提示热应激很可能通过下调HSPA2 及系列HSF 的表达,进而介导精子损伤的发生,可为临床上男性不育的基因治疗和新药研发提供有价值的理论参考。 如前所述,HSF 是调控HSP 表达的转录因子,但迄今为止HSPA2 是否接受HSF 的调控尚无定论。 尽管HSF1 和HSF2 对精子发育的影响研究已取得部分进展,但其影响精子发生的具体机制不明。研究表明[16],表观遗传机制可能是调控HSPA2 基因表达的首要因素,但热应激过程中是否也涉及到类似的机制,值得探讨。总之,HSPA2 及HSF 在热应激过程中表达下调的本质原因尚有待进一步研究。

