巴曲酶在小鼠实验性自身免疫性脑脊髓炎中的作用
田书娟 黄德晖 杨扬 王晓 吴卫平
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统炎性,脱髓鞘疾病。MS主要的病理改变包括血脑屏障(blood-brain barrier,BBB)的破坏、纤维蛋白沉积、炎性细胞浸润、髓鞘脱失、少突胶质细胞丢失、反应性胶质增生和轴索破坏。实验性自身免疫性脑脊髓膜炎(EAE)是目前最佳的炎性脱髓鞘动物模型,对EAE的研究有助于更进一步理解炎性脱髓鞘的分子和细胞机制。在MS和EAE研究中发现,早在T细胞浸润和脱髓鞘开始前脑白质中即发现BBB破坏和纤维蛋白沉积,并伴有小胶质细胞活化[1-6],纤维蛋白沉积不仅发生在MS的早期,在MS的活动期和慢性病变中也有大量沉积,且与脱髓鞘和T细胞浸润有关[7-8],表明纤维蛋白沉积参与了MS的整个致病过程且与炎性反应有关。且研究发现降低纤维蛋白沉积可减轻炎性反应,延迟脱髓鞘的发生[9],并有效改善EAE模型发病动物的临床症状[10]。巴曲酶是蛇毒中提取的一种蛋白酶,具有分解纤维蛋白、降低人体内纤维蛋白原的作用。本文作者团队之前的实验通过免疫后给予巴曲酶治疗,发现巴曲酶能明显减轻EAE小鼠的临床症状和发病过程[11]。但EAE小鼠免疫前预防应用巴曲酶是否也能起到保护作用尚不可知,故本研究于小鼠免疫前后分别给予巴曲酶预防及治疗,观察巴曲酶对EAE的作用。
另有研究显示,基质金属蛋白酶(matrix metalloproteinases,MMPs)可以参与BBB的破坏过程,组织型纤溶酶原激活剂(tissue-type plasminogen activator,t-PA)和 MMP-2和-9均参与了BBB的破坏和MS的发病过程。这些酶的大量激活均依赖于纤溶酶,表明MMP和纤溶酶原激活酶系统之间存在功能相互作用[12-13]。但纤维蛋白沉积、纤溶活性改变及MMP-9表达间的关系目前尚未明了。因此本研究利用分子生物学技术观察纤维蛋白对MMP-9表达的影响,以观察巴曲酶是否会通过影响MMP-9的表达来影响EAE的发病。
1 材料和方法
1.1 实验动物与试剂清洁级8~10周龄的C57BL/6(H-2b)雌性小鼠(河北医科大学实验动物中心提供,体质量约18 g)。福氏完全佐剂(completely freund adjuvant,CFA)(美国Sigma公司),百日咳活菌疫苗、结核杆菌冻干粉(北京天坛生物制品研究所),巴曲酶(北京东菱医药生物科技有限公司提供),鼠源MOG35-55多肽(MEVGWYRSPFSRVVHLYRNGK;西安联美生物有限公司),兔抗CD3抗体、兔抗Fig抗体、鼠抗GFAP抗体、山羊抗MBP抗体及山羊抗MMP-9抗体(美国SANTA CRUZ公司),生物素标记山羊抗兔IgG二抗(河北博海生物工程开发有限公司)。
1.2 方法
1.2.1实验动物分组及EAE造模:将8~10周龄的雌性C57BL/6小鼠55只,根据体重编号后,随机分为正常对照组(10只)、EAE模型组(15只)、巴曲酶预防组(预防组,15只)、巴曲酶治疗组(治疗组15只),后3组小鼠(简称EAE小鼠)均以MOG35-55多肽诱发EAE模型。各组小鼠具体干预方法见表1。

表1 各组小鼠的干预方法
(1)EAE造模:以200 μg MOG35-55多肽溶入200 μL PBS液,再与等量CFA混和,添加结核杆菌使其终浓度为1.5 mg/mL,搅拌5~10 min使其充分乳化,于小鼠双侧侧腹壁腹腔注射,免疫后0时(即腹腔注射MOG35-55多肽乳化液时)及48 h腹腔内注射100 μL百日咳活菌疫苗(含菌5×109)。造模操作后存活小鼠时参与后续实验,EAE模型组15只,治疗组14只,预防组12只。正常对照组:将200 μL PBS液与200 μL CFA乳化,取小鼠双侧侧腹壁腹腔注射。
(2)发病情况及神经功能评分:免疫后(对照组注射后)每日观察各组小鼠发病情况并进行神经功能评分,并计算发病率。
神经功能评分:免疫后每日上午10时由同一人对小鼠进行神经功能评分。Kono’s 5分法评分标准[14]:0分,不发病;1分,尾部张力降低或轻度步态笨拙;2分,轻度后肢力弱;3分,后肢明显力弱;4分,四肢瘫痪;5分,濒死状态。
发病小鼠于发病高峰期处死,无发病者于观察50 d后处死。发病高峰期一般表现为四肢瘫痪、濒死状态,或连续3 d症状无加重。
发病率的计算方法:发病率=(各组发病只数/各组总存活只数)×100%。
1.2.2组织病理学检查:各组小鼠给予10%水合氯醛0.2 mL腹腔注射麻醉,冰上快速取出小鼠脊髓,分离腰膨大部分在4%多聚甲醛中固定(同时将脊髓其他部分组织,-80℃冷冻,行实时荧光定量PCR及RT-PCR检测),标本石蜡包埋,组织连续切片,厚度4 μm厚。每组脊髓切片进行常规苏木素-伊红(HE)染色、Luxol fast blue染色、快速银染。
(1)HE染色:每只小鼠随机选5张切片进行常规苏木素-伊红(HE)染色,每张切片随机选取5个400倍视野,采用Image Pro Plus 5.0图像分析系统对各组单个视野炎性细胞进行计数。(2)Luxol fast blue染色、快速银染:均每只小鼠随机选5张切片,每张切片随机选5个100倍视野,观察髓鞘及轴索结构及着色情况。(3)免疫组化染色:常规脱蜡,抗原修复,山羊血清37℃封闭,加入相应的一抗〔兔抗CD3抗体(1︰50)、兔抗Fig抗体(1︰100)、鼠抗GFAP抗体(1︰50)、山羊抗MBP抗体(1︰100)、山羊抗MMP-9抗体(1︰100)〕4℃过夜,加入二抗(生物素标记的山羊抗兔或山羊抗鼠IgG),37℃孵育20 min,辣根酶标记链霉卵白素工作液,37℃ 20 min,DAB显色,苏木素复染细胞核1 min,脱水,透明,中性树脂封片,每只小鼠随机选5张切片,采用CMOS(日本OLYMPUS公司,美国Imaging技术公司专用软件)多功能真彩色病理图象分析系统对进行定量分析。每张切片随机选取5个400倍视野,观察染色后各指标阳性表达情况,依据阳性免疫反应的图象灰度选择合适的灰度分割阈值,测定阳性免疫染色强度及面积,获得免疫组化评分值。免疫组化评分(IHS)方法:结合阳性细胞百分比及阳性细胞染色强弱两个方面联合评分:A为阳性细胞数分级(0~1%=0、1%~10%=1、10%~50%=2、50%~80%=3、80%~100%=4),B为阳性细胞显色强度分级(0=阴性、1=弱阳性、2=阳性、3=强阳性),A、B两项乘积即为该组织的IHS值。
1.2.3实时荧光定量PCR检测MBP mRNA表达水平:取各组小鼠剩余的脊髓组织,按Trizolz说明书提取组织总RNA,次黄嘌呤鸟嘌呤磷酸核糖基转移酶(hypoxanthine-guanine phosphoribosyl transferase,hprt)作为内参对照。并紫外分光光度计进行RNA纯度鉴定及定量;用RT-PCR试剂盒将RNA逆转录呈cDNA,以cDNA为模板进行PCR。采用SYBR Green法进行实时荧光定量PCR,选用20 μL为扩增体系,反应条件:95℃,2 min,95℃ 2 s,60℃ 3 s,72℃ 11 s,循环45次。MBP引物序列:上游引物:5′-ACACTAACCTCGGTGGAAA-3′;下游引物:5′-GCAGTATTGGGCTACATCA-3′。按照2-△△CT计算MBP mRNA的相对表达量。
1.2.4RT-PCR法检测MMP-9 mRNA表达水平:总RNA提取及逆转录方法同前。MMP-9上游引物:5′-CCACCCTACAAAGTTGTCTTCT-3′;下游引物:5′-CTACGTGACCTACGACCT-3′。反应体系25 μL,反应条件:94℃ 5 min,94℃ 3 min,60℃ 30 s,72℃ 10 min,38个循环,72℃ 10 min。扩增的产物经1.5%琼脂糖凝胶中进行电泳,采用ChampGel TM 2000凝胶成像系统对凝胶电泳条带进行扫描分析,获得各条带光密度,以MMP-9条带光密度/hprt条带光密度的比值作为MMP-9 mRNA相对表达量。
1.3 统计学处理采用SPSS 13.0软件进行分析。计量资料数据均以均数±标准差表示,多组间样本均数比较进行单因素完全随机方差分析(one-way ANOVA),组间两两比较采用LSD检验。小鼠发病率比较采用R×C卡方检验,组间两两比较采用卡方分割法。以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠发病情况正常对照组无发病,其余3组均有小鼠发病,其中EAE模型组发病率〔12(80.0%)〕最高,各组小鼠发病率差异有统计学意义(χ2=10.7,P=0.005),治疗组〔7(50.0%)〕及预防组〔2(16.7%)〕发病率均低于EAE模型组(均P<0.05)。
EAE小鼠在在免疫后13 d左右陆续出现发病症状,尾部张力减低、消失,双后肢无力、瘫痪,可伴有大小便失禁。症状严重者,前肢也逐渐出现无力、瘫痪,以致不能爬动、翻身。与EAE模型组比较,巴曲酶预防组和治疗组发病及达峰时间均延迟(P<0.05),神经功能评分降低(P<0.05,预防组与治疗组比较差异无统计学意义(表2)。
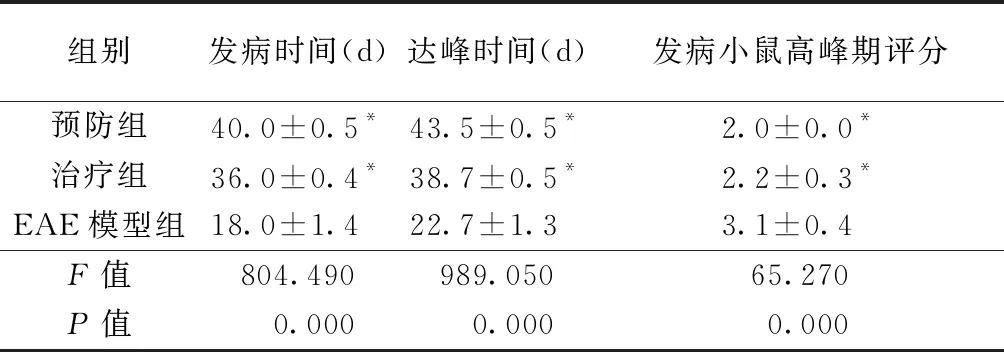
表2 各组EAE小鼠发病、达峰时间及评分比较
2.2 各组小鼠脊髓中炎性反应、髓鞘脱失和轴索损害比较HE染色显示免疫后小鼠脊髓内不同程度出现炎性细胞浸润,小血管明显扩张,炎性细胞聚集在血管周围形成袖套样改变,以白质为著。EAE各组小鼠的脊髓中炎性细胞浸润的数量均较对照组明显增多(P<0.01),预防组及治疗组脊髓中炎性细胞浸润的数量与EAE模型组相比明显减少(P<0.05),预防组与治疗组差异无统计学意义(P>0.05)。具体见表3。
Luxol fast blue染色显示正常对照组髓鞘连续,结构完整,未见明显的脱失;EAE模型组小鼠脊髓白质疏松呈泡沫状,髓鞘不连续,部分白质区髓鞘呈片状脱失,预防组及治疗组脊髓内髓鞘脱失明显轻于EAE模型组,且预防组髓鞘脱失较治疗组轻微(图1)。
快速银染结果显示对照组小鼠轴索染色可见银染色结构完整、着色均匀,EAE模型组、治疗组及预防组均可见脊髓内纤维结构松散,银染着色浅,轴索广泛缺失,其中以EAE模型组轴索损害最为严重(图2)。
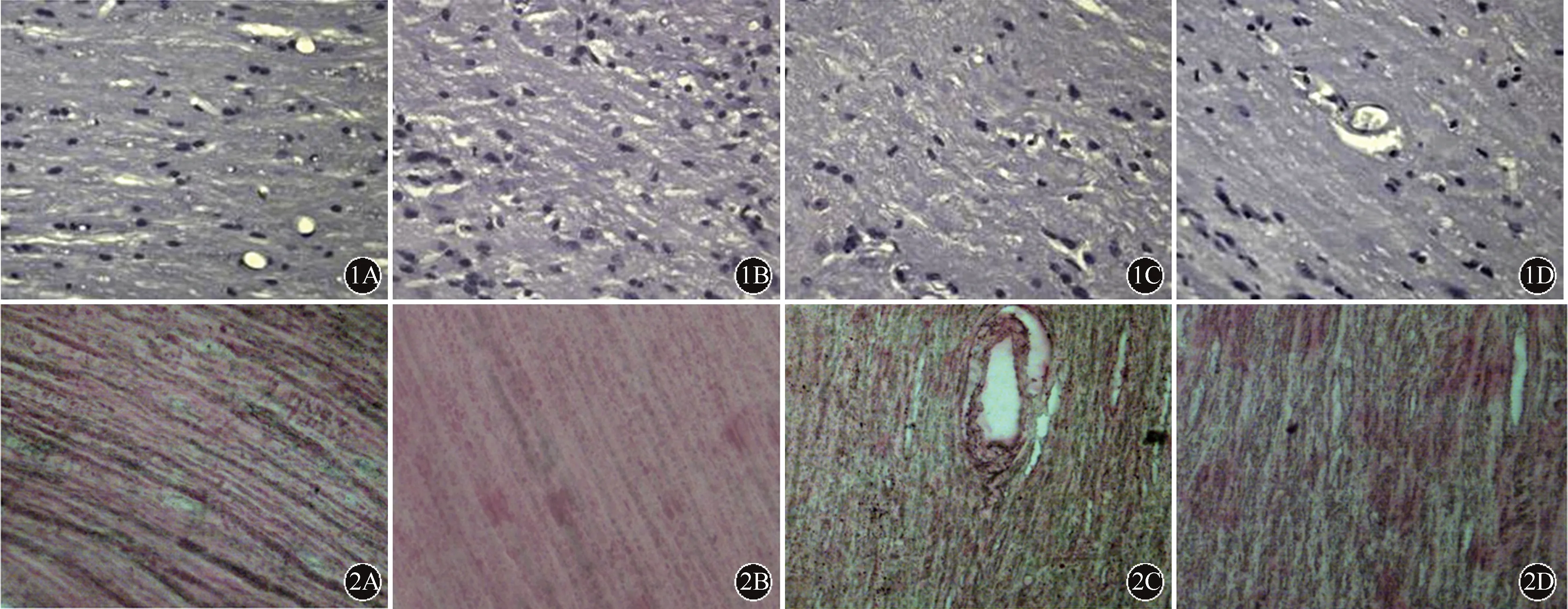
图1 各组小鼠脊髓中髓鞘脱失比较(Luxol fast blue染色×100):正常对照组(A)髓鞘连续,未见脱失;EAE模型组(B)白质疏松呈泡沫状,髓鞘不连续,可见片状脱失;治疗组(C)部分泡沫状白质疏松,髓鞘不连续;预防组(D)部分髓鞘不连续 图2 各组小鼠脊髓中轴索损害比较(快银染色×100):正常对照组(A)轴索结构完整,着色均匀;EAE模型组(B)结构松散,着色浅,轴索广泛缺失;治疗组(C)及预防组(D)结构较松散,着色不均匀
2.3各组小鼠脊髓中T细胞浸润、纤维蛋白沉积及GFAP、MBP及MMP-9蛋白表达比较

2.3.2各组小鼠脊髓中纤维蛋白沉积比较:在正常对照组小鼠脊髓切片中未见到纤维蛋白沉积,而EAE模型组,发病小鼠脊髓白质的大、小血管周围、内皮细胞、神经胶质细胞胞浆中,均可见到明显的Fig阳性物质沉积,其沉积的范围远远大于炎性细胞浸润的范围;免疫组化评分各组之间差异有统计学意义(P<0.01),与较EAE模型组比较,预防组及治疗组小鼠Fig阳性物质沉积明显减少(均P< 0.01)(表3、图4)。
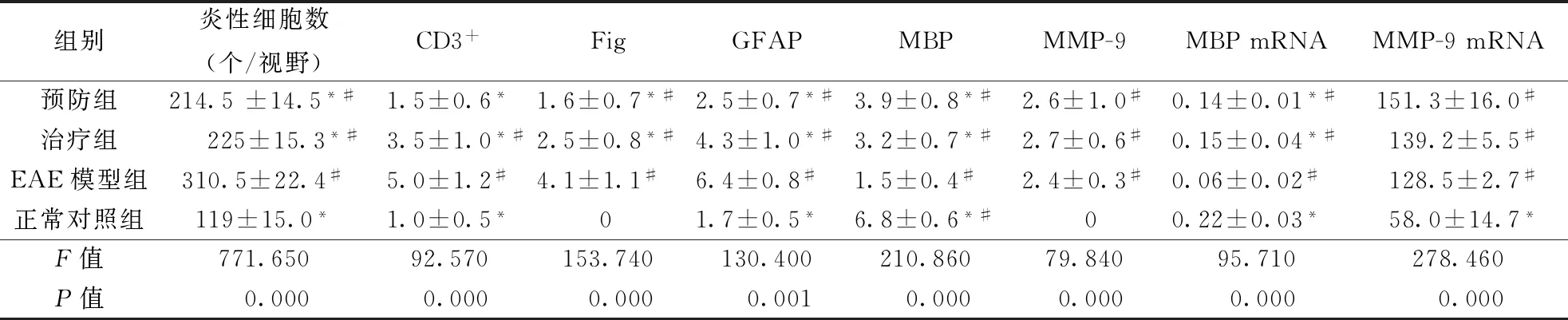
表3 各组检测指标比较
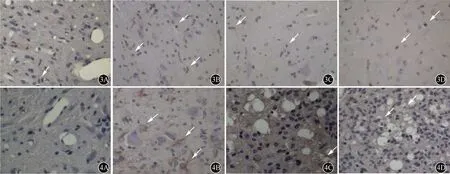
图3 各组小鼠脊髓中T细胞浸润比较(免疫组化×400):正常对照组(A)、治疗组(C)及预防组(D)均可见散在少量阳性细胞,EAE模型组(B)可见较多的阳性细胞(图中箭头所示) 图4 各组小鼠脊髓中纤维蛋白沉积比较(免疫组化×400):正常对照组(A)未见纤维蛋白沉积;EAE模型组(B)可见大量的纤维蛋白沉积,治疗组(C)与预防组(D)少量纤维蛋白沉积(图中箭头所示)
2.3.3各组小鼠脊髓中GFAP及MBP蛋白表达比较:正常对照组可见GFAP表达,突起正常,未见免疫活性增强,MBP表达均匀,髓鞘结构正常,EAE模型组可见丰富的GFAP表达,免疫活动增强,突起增多,呈弥漫性分布,而MBP表达减少,治疗组和预防组较EAE模型组GFAP表达减少,MBP表达增多(P<0.05)(表3、图5)。
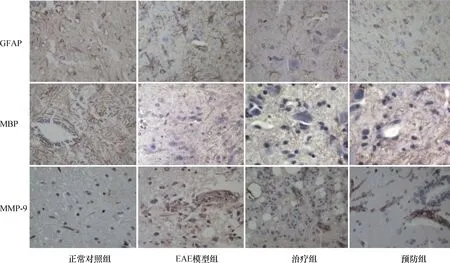
图5 各组小鼠脊髓中GFAP、MBP、MMP-9蛋白表达比较(免疫组化×400):正常对照组可见GFAP表达,细胞突起正常;MBP表达均匀,髓鞘结构正常;未见MMP-9阳性表达。EAE模型组GFAP表达丰富,突起增多,部分胞体肿胀;MBP少量表达,分布不均匀,结构紊乱;MMP-9阳性表达明显。治疗组与预防组GFAP表达稍多,部分突起增多;MBP少量表达,但较图EAE模型组增多,分布欠均匀;MMP-9阳性表达明显
2.3.4各组小鼠脊髓中MMP-9蛋白表达比较:正常对照组脊髓内未见MMP-9的阳性表达。EAE组中,MMPs-9在脊髓膜、白质血管内皮细胞、血管周围单个核细胞、部分胶质细胞、细胞外间质内表达均明显增加,治疗组和预防组小鼠脊髓中MMP-9表达与EAE模型组无明显差异(P>0.05)(表3、图5)。
2.4 各组小鼠脊髓中MBP mRNA、MMP-9 mRNA相对表达水平比较实时荧光定量RT-PCR检测结果显示各组间MBP mRNA表达比较有统计学意义(F=95.71,P<0.01)。EAE模型组、预防组和治疗组MBP mRNA表达较对照组均明显下调(P<0.05),预防组及治疗组MBP mRNA的表达均较EAE模型组上调(P<0.05),但两组比较差异无统计学意义(P=0.97)。具体见表3。
普通RT-PCR结果显示对照组小鼠脊髓中可检测到MMP-9 mRNA的表达,三组EAE小鼠脊髓中MMP-9 mRNA表达较对照组明显增加(P< 0.05),但三组EAE小鼠间MMP-9的表达差异无统计学意义(P>0.05)。具体见表3、图6 。
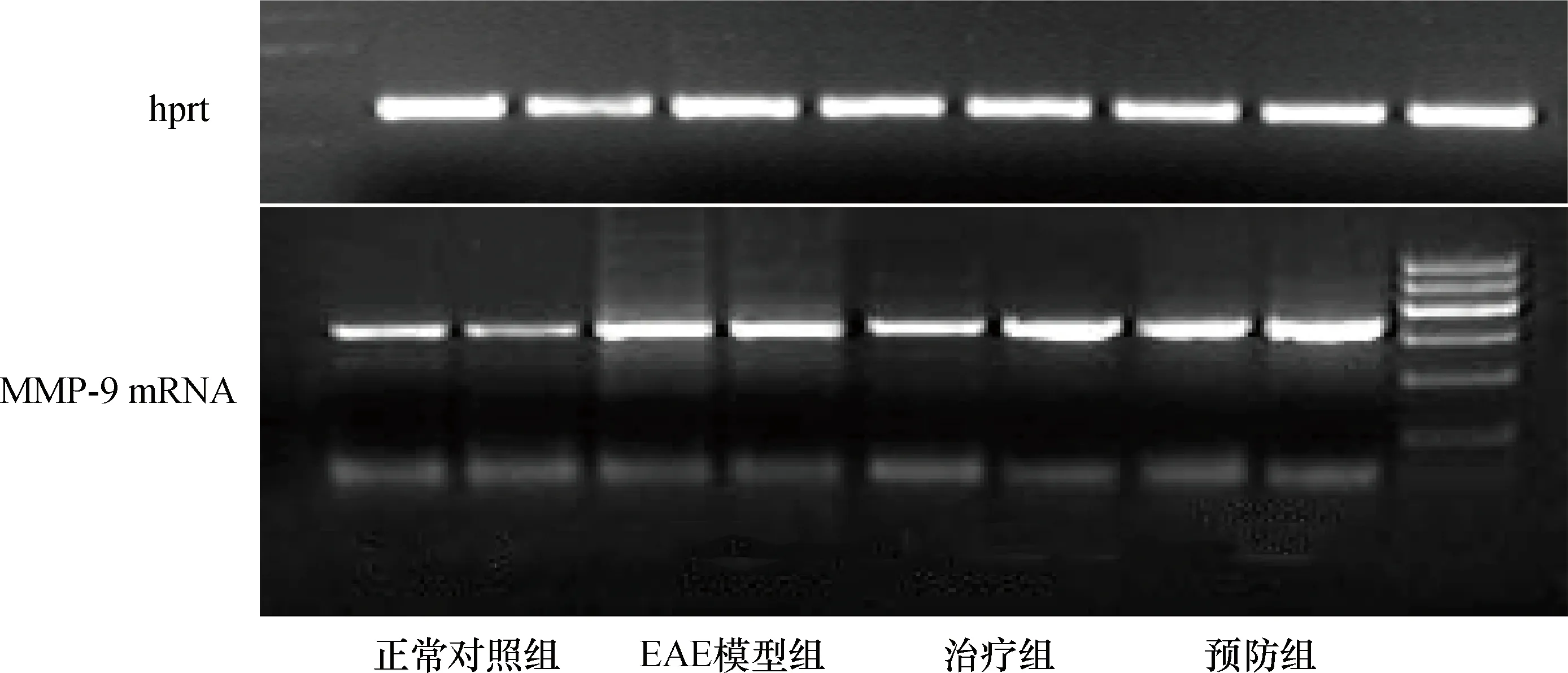
图6 各组小鼠脊髓中MMP-9 mRNA表达情况(RT-PCR法)
3 讨论
现有病理生理学研究证实,炎性反应和凝血过程也是相互关联互为整体的,很多炎性反应以凝血激活和纤维蛋白沉积为特征[15]。在炎性反应的短时间内凝血酶能引起血管通透性的增加,从而导致急剧、短暂的BBB通透性增高与凝血酶活性增加、纤维蛋白形成并沉积在中枢神经系统(central nervous system,CNS)血管周围,BBB的开放,进一步促进了纤维蛋白的沉积[16],定量研究显示纤维蛋白原沉积与炎性细胞(包括小胶质细胞/巨噬细胞和T细胞)的积累呈正相关,且纤维蛋白原沉积的高峰与脱髓鞘和轴索丢失的发生一致。另外在纤维蛋白原缺乏的EAE小鼠模型中也发现其发病时间明显推迟,疾病严重程度也有所降低,也支持纤维蛋白原在炎性脱髓鞘病变的早期发病机制和持续炎性反应中起关键作用[17-18]。目前已知巴曲酶具有降解纤维蛋白原、诱发t-PA释放、增强t-PA的作用、减少纤维蛋白溶酶原激活剂抑制物(plasminogen activator inhibitor,PAI)生成等广泛的生物学效应[19]。而清除EAE动物体内的纤维蛋白原,可延迟脱髓鞘的发生,减轻临床症状,改善预后[9-10]。本研究也表明应用巴曲酶降纤治疗可使EAE小鼠发病率下降,发病时间延迟,临床症状减轻,病理学提示巴曲酶预防组和治疗组病灶内炎性浸润减轻,纤维蛋白沉积减少。其中值得关注的是,本实验中预防组免疫前使用巴曲酶进行系统降纤,其发病率与发病时间均明显低于免疫后3 d开始使用巴曲酶的治疗组,但两组在EAE达峰时间、最大神经功能评分以及病理学炎性反应方面均无明显差别,提示纤维蛋白原可能是EAE发病的一个先决条件,一旦发病后,对临床表现及炎性改变可能无明显影响,这也支持了纤维蛋白原主要在病灶形成和临床症状出现前起作用,即作用在EAE诱导阶段的观点。故可以推测,对于复发缓解型MS患者,在病程缓解期,给予巴曲酶降低血浆中纤维蛋白含量可以有效预防复发,其预防效果可能要大于其治疗效果。
一直以来免疫介导的CNS髓鞘破坏和少突胶质细胞丢失被认为是MS的主要病理表现,但是MS导致永久的神经功能障碍主要与轴索丢失有关[20-21]。多项有关MRI、MRS、fMRI的影像学研究均证明进行性轴索丢失是导致MS患者发生不可逆神经功能障碍的主要原因[22-25]。在本实验中,MOG诱发的EAE小鼠脊髓中可见到明显的轴索丢失、破坏,而使用巴曲酶干预的小鼠轴索损害明显减轻,其与临床症状、炎性浸润和髓鞘脱失程度一致,表明巴曲酶可能有效减轻轴索的损害进而改善预后,但巴曲酶对轴索的保护作用是直接作用还是间接通过改善炎性反应、髓鞘保护等起作用,尚需进一步行体外细胞培养等研究进行证实。
Akassoglou等[26]通过建立动物坐骨神经损伤模型观察到给予巴曲酶处理可减少纤维蛋白在神经细胞外基质中的沉积,促进施万细胞分化,增加髓鞘化轴突的数量,即神经轴突的再髓鞘化而促进损伤后坐骨神经的再生。虽然中枢神经系统神经再生能力与周围神经不同,但本研究中发现,应用巴曲酶清除纤维蛋白原后MBP阳性细胞数明显增加,MBP mRNA表达上调,提示在CNS中,调控纤维蛋白原的沉积/清除可能是神经损伤后修复的一个关键因素。Petzold等[27]研究发现GFAP水平高低与患者临床残疾评分呈正相关,故可以将其作为不可逆损害的标志。本实验中EAE模型组小鼠脊髓中有大量纤维蛋白沉积,星形胶质细胞细胞增生明显,引起的临床症状严重,造成了神经功能的不可逆损害,而巴曲酶干预后星形胶质细胞增生减少,临床症状轻且预后好,降低了造成神经功能不可逆损害的机率,这也与本文作者团队之前的研究结果相一致,提示降纤治疗可能改善临床患者的预后。
EAE早期BBB的破坏除与凝血-纤溶系统有关外,还需特别关注另一种蛋白酶——MMPs。MMPs是一组降解细胞外基质的蛋白酶,参与了脑缺血、MS和帕金森病等多种神经疾病的发生和发展。其中,MMP-9在MS和EAE相关研究中涉及最多。在MS发病过程中,MMP-9主要参与了BBB破坏、炎细胞浸润及髓鞘脱失等多个环节[28]。本研究发现,在EAE组小鼠发病急性期,病灶区、血管周围单个核细胞、血管内皮细胞及胶质细胞内均可见到MMP-9表达,并且EAE组小鼠MMP-9 mRNA表达均有明显增加,这些结果与以往文献结果一致。既往多项研究已证实,EAE动物脊髓中MMP-9 mRNA表达升高程度与临床症状严重程度相关,临床表现越重者则MMP-9 mRNA表达越高[29]。基于此,本研究进行实验设计与预期,但实验结果显示,预防组和治疗组小鼠脊髓中MMP-9 mRNA表达与EAE模型组无明显差异,其原因尚不清楚。但有研究发现纤溶酶系统在MMPs激活过程中起决定性的作用,t-PA和尿激酶型纤溶酶原激活剂(urokinase-tyoe plasminogen activator,u-PA)将纤溶酶原激活为纤溶酶,纤溶酶进而激活MMP-3和MMP-1,二者可使MMP-9前体裂解转变为有活性的MMP-9,另外,tPA还能以纤溶酶非依赖的方式作用于MMP-9,间接调节MMP-9基因的转录,并在EAE发病中与MMPs协同诱导,参与炎性反应和轴索损伤[30]。由上推测本实验结果可能与使用巴曲酶后机体内tPA活性增高有关。
综上,本次研究表明长期、间断给予巴曲酶可以减缓EAE小鼠炎性反应发生及髓鞘的损伤,EAE造模时在免疫前使用效果最佳,并且未发现持续给予巴曲酶的小鼠有出血倾向及其他毒副作用。纤维蛋白沉积是促进MS发生、进展的重要因素之一,它可能涉及到炎性反应、BBB通透性增高、神经胶质增生、轴索损害等多个方面。巴曲酶对于MS患者是否有效,用药时机、剂量及疗程长短均需进一步研究,但以纤维蛋白为治疗靶点的抗凝治疗对炎性脱髓鞘疾病可能有潜在的治疗益处,值得进一步研究探讨。

