投喂模式对大菱鲆幼鱼生长及形态特征的影响
赵海涛 胡智鑫 万玉美 孙桂清 吴彦 郭敏莉 邓鹏春
摘 要:为优化大菱鲆养殖管理、科学投喂,研究分析了禁食再投喂和循环禁食再投喂两种投喂模式对大菱鲆幼鱼(Scophthalmus maximus)生长及形态特征的影响。结果表明:循环禁食再投喂模式下,除肝体比外,循环禁食1 d投喂6 d(NS1F6)和循环禁食2 d投喂5 d(NS2F5)模式的生长指标与对照组(NS0组)无显著性差异(P>0.05),呈完全补偿生长。形态特征中NS2F5组体表增加面积和形态指标与NS0组无显著性差异(P>0.05),呈现完全补偿生长。NS1F6组大菱鲆幼鱼肝体比为(4.44±0.74)%,显著高于NS0组(P<0.05)。禁食再投喂模式下,禁食3 d投喂32 d(RS3F32)模式生长指标与对照组(RS0组)无显著性差异(P>0.05)呈现完全补偿生长。禁食9 d投喂26 d (RS9F26)模式的生长指标除肝体比外,均高于RS0組且无显著性差异(P>0.05),其肝体比为(3.41±0.22)%,显著高于对照组(P<0.05),呈完全补偿生长。形态学指标中RS9F26组体表增加面积和形体指标和对照组无显著性差异(P>0.05),呈现完全补偿生长。
关键词:大菱鲆(Scophthalmus maximus);禁食;再投喂;生长;形态特征
大菱鲆(Scophthalmus maximus)作为世界公认的优质食用鱼之一,其肉质鲜美,深受消费者的喜爱,现已成为我国北方主要海水养殖品种之一[1-2]。近年来,大菱鲆成鱼的价格持续降低,成本却因饲料价格不断上涨而升高,养殖利润受到压缩[3],因此,科学地优化养殖管理,有效控制成本成为面对这种养殖状况的需求。
补偿生长是动物在前期营养不良或人为禁食而营养水平恢复正常后,机体表现出较快速生长速率的现象[4-5]。国内外大量补偿生长在水产养殖上的应用研究,表明补偿生长效应主要通过提高食物转化率、提高摄食率或二者共同作用来实现[6]。杨其彬等研究表明,斑节对虾(Penaeus monodon)在饥饿2 d和饥饿4 d后恢复正常投喂后,因提高了食物转化率而具有部分补偿生长效应 [7]。对于鱼类而言,补偿生长的深层次的生理机制仍不明确[8]。秦志清等[9]研究表明随着饥饿时间的延长,吉富罗非鱼(Oreochromis niloticus)鱼体的灰分和水分的质量分数逐步提高,粗脂肪的质量分数在饥饿的前期下降较迅速,但随着饥饿时间的增加,下降速率逐渐减慢。牙鲆(Paralichthys olivaceus)饥饿一周再投喂三周仅出现部分补偿生长[10]。不同的投喂模式以及试验鱼的初始体质量都可能影响大菱鲆幼鱼的补偿生长[11],张涛等[12]研究表明,大菱鲆在饥饿1 d投喂6 d,饥饿2 d投喂5 d时体重、全长的增加和对照组均无显著差异,具有完全补偿生长的特性。吴立新等[13]研究表明,饥饿再投喂的大菱鲆幼鱼比一直投喂的对照组的生长能较高,代谢能较低。对于较长养殖周期和形态学指标还未有较为详细的研究。本研究以大菱鲆幼鱼为对象,拟在较长养殖周期的循环饥饿再投喂和饥饿再投喂的条件下,在生长及形态学方面直观地探讨不同喂养模式对大菱鲆补偿生长的情况,以期为大菱鲆养殖者优化大菱鲆养殖管理,科学投喂并有效控制成本提供理论参考。
1 材料与方法
1.1 实验动物
实验对象大菱鲆幼鱼来自于河北省半滑舌鳎良种场,体形完好,鱼体健壮,规格均匀,体重(6.71±0.94)g、体长(5.99±0.12)cm。实验前暂养7 d,实验期间水温保持在(16±1)℃,水体溶氧量在6.0 mg/L以上。按鱼体体重的1.78%喂食[14],实验前1 d停止喂食。实验饲料为“福滋”鲆鱼配合饲料,规格3 mm,主要成分为:粗蛋白质50%、粗脂肪10%、粗纤维5%、粗灰分14%、水分12%、赖氨酸2.6%、总磷0.9%。
1.2 实验设计
实验分为禁食再投喂和循环禁食再投喂两种处理。禁食再投喂模式实验:实验周期35 d,设禁食0 d投喂35 d(RS0)、禁食3 d投喂32 d(RS3F32),禁食6 d投喂29 d(RS6F29),禁食9 d投喂26 d(RS9F26),禁食12 d投喂23 d(RS12F23)等5个处理组,每个处理组40尾鱼,设3个平行。循环禁食再投喂模式实验:实验时间35 d,设置禁食0 d投喂7 d(NS0)、禁食1 d投喂6 d(NS1F6)、禁食2 d喂食5 d(NS2F5)、禁食3 d喂食4 d(NS3F4)等4个处理组,循环5个周期,每个处理组50尾鱼,设3个平行组。
1.3 生长指标测定
实验始末,测量大菱鲆幼鱼体长、体重,每个处理组测量30尾。在实验结束后,对待测样本解剖,将肝胰脏分离出,称重,记录肝胰脏重量。计算各项生长指标,包括增重率、体重增加比重、特定生长率、基于体长的特定生长率、肝体比、摄食率,具体测定方法参照杨志强等[15]。
1.4 体型指标测定
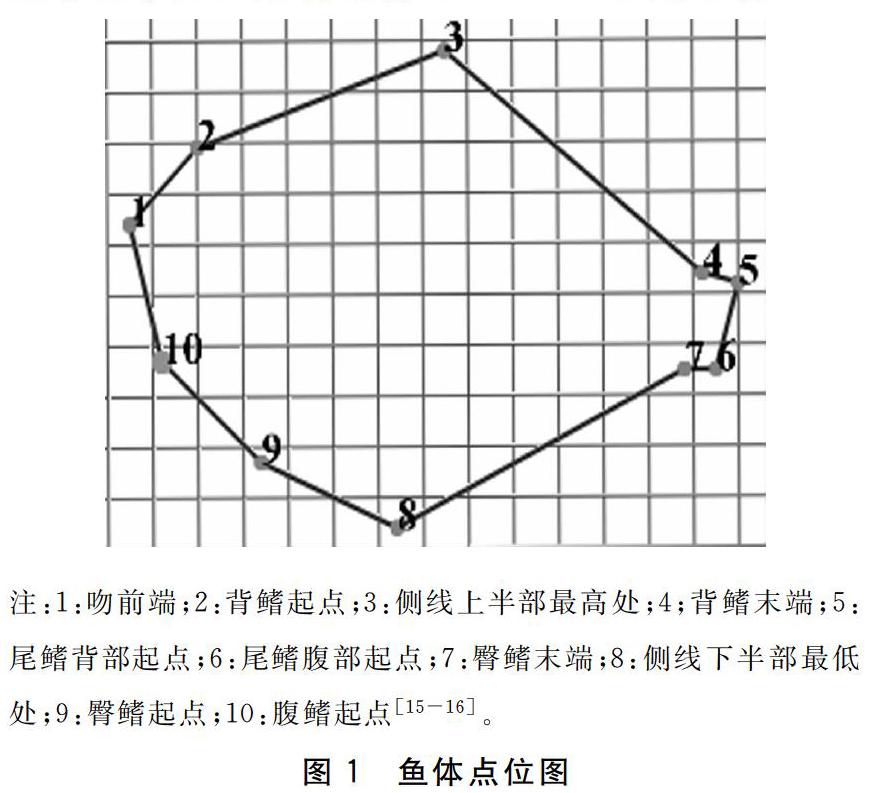
不同禁食时间处理后,将实验鱼麻醉,放在白色解剖盘上,板上放一直尺作为刻度标准, 鱼体上方拍照。利用软件Motic Images Plus2.0对大菱鲆幼鱼10个特征点位进行标记,测定其体型特征指标。10个特征点位如图1所示,分别为吻前端、背鳍起点、侧线上半部最高处、背鳍末端、尾鳍背部起点、尾鳍腹部起点、臀鳍末端、侧线下半部最低处、臀鳍起点、腹鳍起点。将图片上鱼体对应的数据点进行标点,测量出鱼体相对面积[16-17]。
1.5 数据整理与处理
利用软件EXCEL和SPSS19.0进行数据的整理和分析,实验数据均表示为平均数±标准差(Mean±SD)。实验处理间比较利用SPSS19.0的单因素方差分析进行,P<0.05,差异显著。
2 结果
2.1 不同投喂模式对大菱鲆幼鱼生长的影响
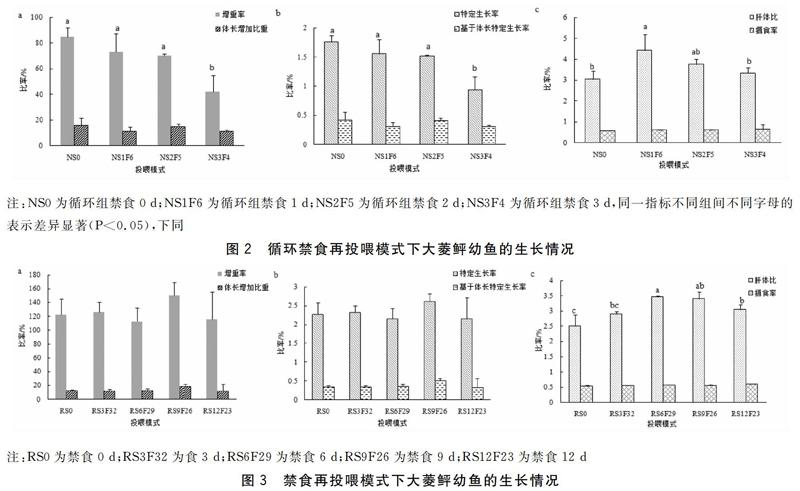
循环禁食再投喂模式下,大菱鲆存活率均为100%,具体生长指标见图2。NS0组的大菱鲆幼鱼增重率为(85.01±6.95)%,与NS1F6、NS2F5组无显著差异(P>0.05),与NS3F4组有显著性差异(P<0.05)。各组体长增加比重无显著性差异(P>0.05)。特定生长率NS0、NS1F6、NS2F5组之间无显著性差异(P>0.05),分别为(1.76±0.11)%、(1.56±0.24)%、(1.52±0.02)%,三者与NS3F4组的待定生长率存在显著性差异(P<0.05)。基于体长的特定生长率NS0组最高为(0.42±0.13)%,与其他三组均无显著性差异(P>0.05)。肝体比NS1F6组为(4.44±0.74)%,显著高于NS0组,而NS0、NS2F5、NS3F4三组之间不存在显著差异(P>0.05)。摄食率随着饥饿时间的增加而略微提高,但各组不存在显著性。
禁食再投喂模式下大菱鲆幼鱼存活率为100%,生长情况见图3。各组间增重率、体长增加量占初始体长的比重、特定生长率、基于体长的特定生长率均随着饥饿时间增加而波动,RS9F26组最大,但各组无显著性差异(P>0.05)。RS6F29组肝体比为(3.46±0.04)%,与RS6F29组不存在显著性差异(P>0.05),显著高于RS0组、RS3F32组、RS12F23组(P<0.05)。RS12F23组摄食率略高于其他组,但差异不显著性(P>0.05)
2.2 不同投喂模式对大菱鲆幼鱼形态特征的影响
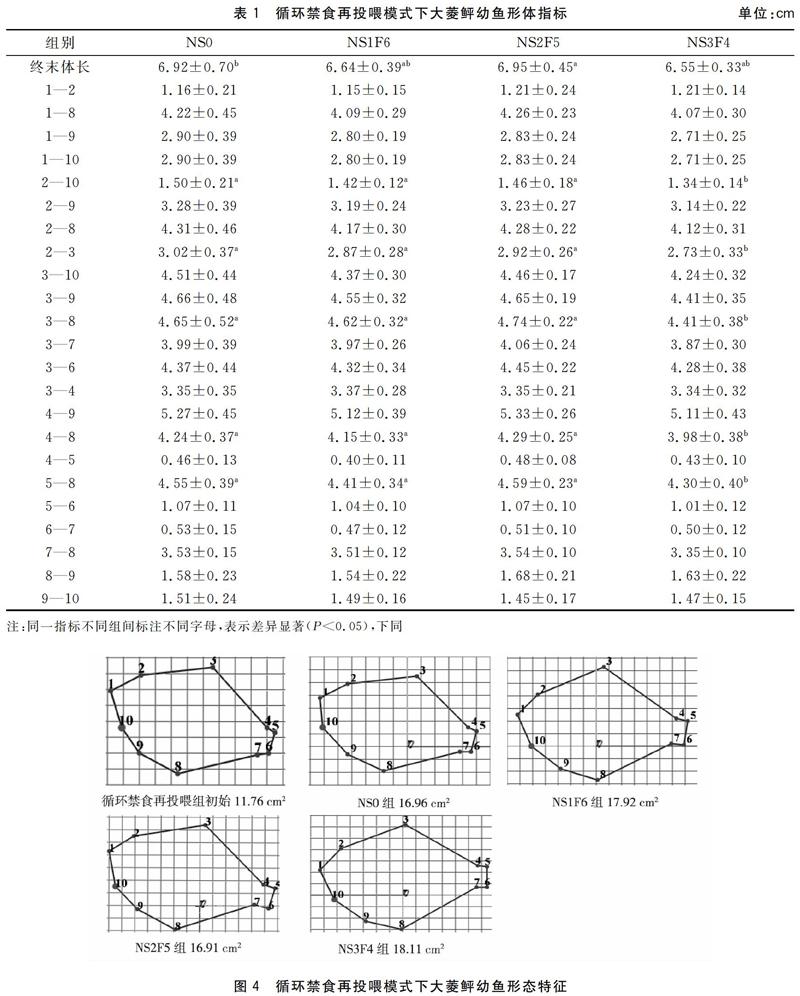
循环禁食再投喂模式下,NS2F5组大菱鲆幼鱼终末体长为(6.95±0.45)cm,显著高于NS0组(P<0.05)。NS0、NS1F6、NS2F5组的2—10、2—3、3—8、4—8、5—8指标无显著差异(P>0.05),它们均显著高于NS3F4组(P<0.05)。各组的1—2、1—8、1—9、1—10、2—9、2—8、3—9、3—10、3—7、3—6、3—4、4—9、4—5、5—6、6—7、7—8、8—9、9—10指标均无显著性差异(P>0.05)(表1)。循环禁食再投喂组中平均体表面积NS0组16.96 cm2,增加了5.20 cm2,NS1F6组 17.92 cm2,增加了6.16 cm2,NS2F5组 16.91 cm2,增加了5.15 cm2,NS3F4组18.11 cm2,增加了6.35 cm2,三个试验组随着饥饿时间增加鱼体表面积增加量先减后增,在NS2F5组达到低谷(图4)。
禁食再投喂模式下,RS0组大菱鲆幼鱼1—10指标为(1.49±0.18)cm,与RS3F32、RS6F29、RS9F26组无显著差异(P>0.05),但显著高于RS12F23组(P<0.05)。除1—10指标外,五组投喂模式的其余指标间均无显著性差异(P>0.05)(表2)。禁食再投喂模式中RS0组的相对面积为16.81 cm2,增加了9.12 cm2,RS3F32组 为19.88 cm2,增加了12.19 cm2,RS6F29組为19.31 cm2,增加了11.62 cm2,RS9F26组为17.85 cm2,增加了10.16 cm2,RS12F23组为17.31 cm2,增加了9.62 cm2,鱼体表面积增加量随饥饿天数加长呈减少趋势,但试验组均高于RS0组(对照组),其中RS3F32组增加的最多(图5)。
3 讨论
补偿生长效应是鱼类对其生活史中不同阶段环境条件变化的一种综合反应,其能否出现取决于鱼类生物学特性和外界环境因素的变化[18]。大多数鱼类在遭受饥饿胁迫后,在恢复摄食后机体会存在一定的补偿生长。根据恢复投喂的增重率和生长率其生长通常存在超补偿、完全补偿、部分补偿及不补偿情况,当鱼体继饥饿胁迫恢复投喂后,体重明显高于正常鱼则出现了超补偿生长;体重与正常鱼相近为完全补偿生长;生长率与正常鱼差异不明显,但最终体重仍明显低于正常鱼则为部分补偿生长;生长率明显低于正常鱼,对鱼体的生理机能造成了一定损害,为不能补偿生长[15]。实际生产中,可以利用补偿生长提高鱼的生长速度,且代谢水平低、食物残渣和排泄物少等优点来实现节约养殖成本,提高鱼类养殖经济效益[19]。
对于饥饿胁迫产生的补偿生长,饥饿时间是影响因素之一,有研究表明禁食时间越长,再摄食阶段的生长率和摄食率升高的幅度就越大。饥饿5 d组吉富罗非鱼具有完全补偿生长能力,饥饿10 d、15 d 幼鱼仅有部分补偿生长能力[20]。鱼类在不同的饥饿处理周期之下,补偿生长的程度差异较大,周期性循环限食与一次性限食补偿生长的效果是不同的[17]。本研究循环禁食再投喂各组的增重率NS1F6组、NS2F5组与NS0组无显著差异(P>0.05);特定生长率NS1F6组、NS2F5组与NS0组无显著性差异(P>0.05);体长增加比重NS2F5组和NS0组无显著差异(P>0.05)。基于体长的特定生长率NS2F5组和NS0组无显著差异(P>0.05)。肝体比NS1F6组最大,为(4.44±0.74)%,高于NS0组。摄食率RS3F4组最大,为(0.65±0.21)%,3个试验组均略高于NS0组。综合来看NS1F6组和NS2F5组最接近RS0组,呈完全补偿生长。23个形体指标中,有21个指标显示随着饥饿时间增加指标增加并在NS2F5组达到峰值,有18个指标和对照组无显著性差异(P>0.05),呈完全补偿生长。这一结果和张涛、吴立新的研究结果一致,张涛[12]的研究结果显示在42 d的养殖试验中,连续投喂组与禁食1 d再投喂6 d,禁食2 d再投喂5 d处理组的全长、体重增加均无显著差异,但饵料系数,处理组显著小于连续投喂组。吴立新[13]的研究结果显示禁食1 d投喂6 d,禁食2 d投喂5 d的摄食率均大于对照组,为完全补偿生长。因此可以说明大菱鲆幼鱼在循环禁食再投喂模式下,禁食1 d、禁食2 d再投喂,鱼体提高了饲料利用率和摄食率以达到补偿生长的效果。
禁食再投喂组生长指标显示,RS9F26组的增重率为(150.01±18.95)%,大于对照组,但无显著性差异(P>0.05);其体长增加比重为(19.37±2.64)%,高于对照组,无显著性差异(P>0.05);其特定生长率为(2.61±0.22)%,高于对照组,无显著性差异(P>0.05);基于体长的特定生长率为(0.51±0.06)%,高于对照组,但无显著性差异(P>0.05);肝体比为(3.41±0.22)%,高于对照组,无显著性差异(P>0.05);各实验处理组的摄食率指标均高于RS0组;形体指标数据显示对照组与RS9F26组无显著性差异(P>0.05);RS9F26组的各项指标显示为补偿生长。这和吴玉波的研究结果有差异,饥饿5 d投喂25 d组主要通过提高食物转化率来实现补偿生长,呈现完全补偿生长[21]。其原因可能是不同的处理模式(限食和饥饿)以及试验鱼的初始体质量都可能影响大菱鲆幼鱼的补偿生长程度[10],也有可能出现超补偿生长[22]。但本实验饥饿9 d再投喂26 d数值只是超过对照组并且无显著性差异(P>0.05),没有达到超补偿生长程度,RS9F26模式为完全补偿生长,且RS9F26组的各项指标超过RS3F32组的指标。
4 结论
根据生长与形态学研究,循环禁食再投喂模式下NS1F6和NS2F5组的大菱鲆幼鱼表现出完全补偿生长,禁食再投喂模式下RS9F26组大菱鲆幼鱼出现完全补偿生长,其较传统的日投喂模式可将实际投喂天数缩短14%~29%。实际生产中可以利用大菱鲆幼鱼补偿生长,科学投喂,从而有效地节约饲料成本、提高养殖效益。
参考文献:
[1] 雷霁霖,刘新富,关长涛.中国大菱鲆养殖20年成就和展望—庆祝大菱鲆引进中国20周年[J].渔业科学进展,2012,33(04):123-130.
[2] 袁广运.大菱鲆鱼苗培育养殖技术研究[J].北京农业,2014(21):147.
[3] 黄书培,杨正勇.不同养殖规模下大菱鲆工厂化养殖经济效益分析[J].广东农业科学,2011,38(16):113-116.
[4] ISHIDA A,KYOYA T,NAKASHIMA K,et al.Nitrogen balance during compensatory growth when changing the levels of dietary lysine from deficiency to sufficiency in growing pigs[J].Animal Science Journal,2012,83(11):743-749.
[5] MITCHELL A D.Impact of research with cattle,pigs,and sheep on nutritional concepts: body composition and growth[J].The Journal of Nutrition,2007,137(3):711-714.
[6] 盤文静.不同饥饿方式对鱼类补偿生长影响的研究进展[J].安徽农业科学,2014,42(29): 10162-10164.
[7] 杨其彬,姜松,黄建华,等.斑节对虾的饥饿试验和补偿生长[J].南方水产科学,2013,9(05):25-31.
[8] 陈建春,叶继丹,王和伟.鱼类补偿生长的研究进展[J].水产学杂志,2013,26(3):56-63.
[9] 秦志清,林建斌,樊海平,等.饥饿和补偿生长对吉富罗非鱼摄食、生长及体成分的影响[J].集美大学学报(自然科学版),2011,16(4):252-257.
[10] CHO Y J,CHO S H .Compensatory growth of olive flounder,Paralichthys olivaceus,fed the extruded pellet with different feeding regimes[J].Journal of the World Aquaculture Society,2009,40(4):505-512.
[11] BLANQUET I,OLIVA-TELES A.Effect of feed restriction on the growth performance of turbot (Scophthalmus maximus L.) juveniles under commercial rearing conditions[J].Aquaculture Research,2010,41(8):1255-1260
[12] 张涛.饥饿和再投喂对大菱鲆摄食和生长的影响[J].安徽农学通报,2017,23(13):130-131.
[13] 阿荣,吴立新,姜志强,等.周期性饥饿再投喂对大菱鲆幼鱼生长、生化组成和能量收支的影响[J].大连海洋大学学报,2013,28(5):462-467.
[14] 中国水产科学研究院大菱鲆专家组.大菱鲆健康养殖技术指南[N].中国渔业报,2007-01-15(005).
[15] 杨志强,李潇轩,许政超.锦鲤幼鱼循环饥饿后的补偿生长和体成分变化[J].渔业研究,2017,39(6):463-468.
[16] 李秀明,韦艳洋,付世建,等.饥饿对鲤幼鱼体型特征的影响[J].重庆师范大学学报(自然科学版),2016,33(05):24-28.
[17] 陈新军,方舟,苏杭,等.几何形态测量学在水生动物中的应用及其进展[J].水产学报,2013,37(12):1873-1885.
[18] HAYWARDRS,WANGN,NOLTIEDB.Group holding impedes compensatory growth of hybrid sunfish[J].Aquaculture,2000,183(3-4):299-305.
[19] 阮国良,罗鸣钟,靳恒,等.非营养性胁迫后鱼类补偿生长效应的研究进展[J] .南方农业学报,2016,47(2),319-324
[20] INNESSCL W,METCALFENB.The impact of dietary restriction,intermittent feeding and compensatory growth on reproductive investment and lifespan in a short-lived fish[J].Proceedings of the Royal Society of London Series B: Biological Sciences,2008,275(1644):1703-1708.
[21] 吴玉波,吴立新,陈晶,等.饥饿对牙鲆幼鱼补偿生长、生化组成及能量收支的影响[J]生态学杂志,2011,30(8):1691-1695
[22] ALIM,NICIEZA A,WOOTTON R J.Compensatory growth in fishes :a response to growth depression[J].Fish and Fisheries,2003,4(2):147-190.
(收稿日期:2020-10-20)

