谷氨酸(钠)对人体肠道菌群影响的体外发酵研究
刘淑君 陈苗 王凤忠 包郁明 辛凤姣 温博婷
(中国农业科学院农产品加工研究所,北京 100193)
肠道微生物是人体生态系统的一个重要组成部分,占人类共生微生物的90%以上[1]。肠道微生物通过多种代谢途径利用肠道中的营养物质,在人体生长发育、能量代谢、免疫和神经系统调控中发挥重要作用[2]。肠道微生物可以通过免疫、代谢等系统在内的多种途径调节大脑信号,进而触发微生物-肠道-脑轴的双向应答机制[3]。
谷氨酸在谷氨酸脱羧酶(GAD,EC 4.1.15)的催化作用下可生成γ-氨基丁酸(GABA)[4]。谷氨酸和GABA是哺乳动物体内中枢神经系统的主要神经递质,分别对神经系统具有兴奋和抑制的作用[5-6]。GABA在人体中具有降血压、抗氧化、抗抑郁以及调节肝肾机能等重要的生理功能,受到了人们的广泛关注[7]。Barrett等[8]发现人体肠道来源的乳酸菌和双歧杆菌在体外能够产生GAD将谷氨酸钠完全转化生成GABA。但目前还没有关于人体肠道微生物转化谷氨酸的研究。
谷氨酸是组成蛋白质或肽的结构氨基酸之一,约占膳食蛋白的10%,是维持肠道完整性和功能的主要能量来源[9]。Janeczko等[10]发现在摄入谷氨酸后,血清中谷氨酸的含量有所增加。Liu等[11]通过研究肥胖人群血清中谷氨酸含量及肠道微生物的关系,发现肠道微生物的组成与血清中谷氨酸的含量存在密切联系,且肠道微生物中谷氨酸脱羧酶基因gad的丰度与血清中谷氨酸含量呈负相关。然而,饮食摄入的谷氨酸对人体肠道微生物组成及功能的影响及其在肠道中的转化机制尚不明确。
谷氨酸在天然食品中通常以谷氨酸钠的形式存在,本研究以人肠道微生物为菌源、谷氨酸钠为底物进行体外发酵,测定发酵过程中产气量、pH及SCFA的变化、GAD活力及产物GABA含量,研究肠道微生物体外发酵对谷氨酸钠的转化能力,并进一步通过16S微生物多样性分析研究谷氨酸钠的添加对肠道微生物群落结构的影响,以期获得转化谷氨酸的特定菌群,为阐明肠道微生物转化谷氨酸的机制提供理论基础。
1 材料与方法
1.1 材料
试剂:L-谷氨酸钠,购自西格玛奥德里齐公司;乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、巴豆酸标准品,购自阿拉丁生化科技股份有限公司;偏磷酸、磷酸氢二钾、蛋白胨等试剂,购于国药集团化学试剂有限公司。
粪便菌源:粪便样本取自10名健康成人粪便(Human fecal,HF)(5名女性和5名男性,年龄22-36岁,身体健康且在试验前3个月内无抗生素治疗),将粪便样品重悬于含有1.0% L-抗坏血酸的磷酸盐缓冲液(pH 6.5,0.2 mol/L NaH2PO4和0.1 mol/L Na2HPO4)中,制备成质量体积分数为10%的粪便悬浮液。
培养基:YCFA基础培养基参照Schwab等[12],实验培养基加入0.8% L-谷氨酸钠为底物,空白培养基中不加底物。在厌氧条件下,以5 mL为单位分别加入到10 mL发酵瓶中,121℃高压蒸汽灭菌20 min,配制成实验培养基及空白培养基备用。
1.2 方法
1.2.1 体外发酵 分别接种0.5 mL 10%的粪便悬浮液于添加谷氨酸钠培养基(Fermentation with monosodium glutamate,FS)及空白培养基(Control,CK),37℃恒温培养箱中培养24 h。
1.2.2 产气及pH的测定 发酵24 h后,使用BMPTest System压 力 表(WAL Messund Regelsysteme GmbH,奥尔登堡,德国)测量每瓶发酵液的气压值(kPa);使用紧凑型pH计(型号B-212,Horiba,日本)测定发酵0 h及发酵24 h发酵液的pH值。
1.2.3 SCFAs的测定 分别取空白培养基和添加谷氨酸钠培养基发酵24 h后的发酵液0.5 mL加入0.1 mL巴豆酸-偏磷酸溶液于1.5 mL离心管中,涡旋振荡2 min,充分混合均匀后,放置-20℃冰箱24 h,解冻后在14 000 r/min的条件下离心5 min,离心后取上清,经0.22 μm水相滤膜过滤,用于SCFAs的测定。
采用GC-9720气相色谱仪测定SCFAs含量。气相色谱条件:色谱柱为毛细管柱HP-FFAP(30.0 m×0.25 mm×0.25 μm);载气为高纯氮气,流量3.0 mL/min;辅助气为氢气和空气;检测器为FID氢火焰离子化检测器,检测温度250℃;程序温度:初始温度75℃,以20℃/min升温至180℃,平衡1 min,再以40℃/min升温至220℃,平衡1 min;进样量1.0 μL;采用外标法,测定乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸的含量。
1.2.4 GABA的测定 参考许建军[13]的方法,利用比色法快速测定发酵液中GABA的含量。分别取空白培养基和添加谷氨酸钠培养基发酵24 h后的发酵液100 μL,加入100 μL 6%苯酚和100 μL 5.2%次氯酸钠,混合均匀后沸水浴加热10 min,迅速冷却20 min,加入200 μL 60%乙醇,室温静置40 min,在640 nm测定吸光值,反应产物GABA的定量以标准曲线确定。
1.2.5 GAD活力的测定 利用比色法快速测定谷氨酸脱羧酶的活力。100 μL经超声破菌后的发酵液,1 mL 0.2 mol/L醋酸钠缓冲液(pH 4.4),1 mL 50 mmol/L L-谷氨酸钠溶液,20 μL 10 mmol/L PLP(5’-磷酸吡哆醛),37℃ 反应1 h。加入0.5 mL 1 mol/L碳酸钠溶液和2.5 mL 0.2 mol/L 硼酸缓冲液(pH 9.0)终止反应。反应样本中GABA含量测定同1.2.4。一个酶活力单位(IU):每分钟产生1 μmol GABA所需要的酶量。
1.2.6 16 S高通量测序分析 取3 mL谷氨酸钠添加组体外发酵24 h的发酵液在12 000 r/min的条件下离心5 min,将获得的沉淀和原始粪便样本送上海美吉生物医药科技有限公司进行总细菌DNA的提取和高通量测序分析。
细菌群落结构在美吉云平台(www.majorbio.com)进行分析。引物选用细菌16S V3-V4 区引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTW TCTAAT-3')进 行 扩 增。通过聚类分析,将一致性为97%的序列进行可操作分类单元(OTU)划分;通过绘制Shannon多样性指数,分析微生物Alpha多样性,反映微生物群落的丰富度和多样性;通过主坐标分析(PCoA),使用Bray-Curtis算法对样本分组进行分析;基于样本中群落丰度数据,运用student’st-检验法检测不同组(样本)微生物群落中表现出的丰度差异的物种,对分组样品的物种组成和群落结果进行差异显著性检验。
1.2.7 统计方法 采用Graphpad 7.0软件对实验数据进行统计学分析,结果以“平均数±标准差”表示。以组别为变量,利用t-检验的方法进行差异显著性分析。以P<0.05表示差异显著。
2 结果
2.1 谷氨酸钠体外发酵过程中产气量的变化
由图1可知,谷氨酸钠添加组(FS)的发酵气压为27.22 MPa,是空白对照组(CK)发酵气压8.45 MPa的3.22倍。说明以谷氨酸钠为底物体外发酵24 h后产生的气体显著增加,肠道微生物对谷氨酸钠具有较高的代谢能力。
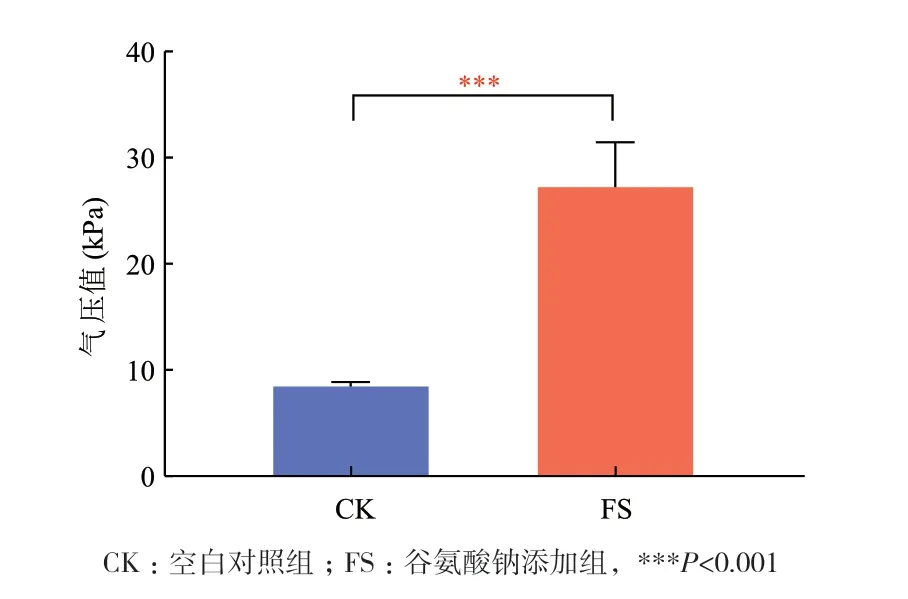
图1 谷氨酸钠体外发酵24 h发酵液产气气压值
2.2 谷氨酸钠体外发酵过程中SCFAs产量的变化
肠道微生物在利用底物产生气体的同时还会产生SCFAs,SCFAs主要由乙酸、丙酸、丁酸等组成。由表1可知,在CK组和FS组体外发酵24 h发酵液中,乙酸产量最大。与CK组相比,FS组中的乙酸、丙酸和丁酸的产量显著增加(P<0.01),异丁酸、戊酸和异戊酸的产量无显著差异。其中,FS组乙酸的产量是CK组的4.5倍,丁酸的产量是CK组的26倍,丙酸的产量是CK组的3.42倍。且在FS组中,除乙酸外产量最大的为丁酸,占总酸的10.08%。
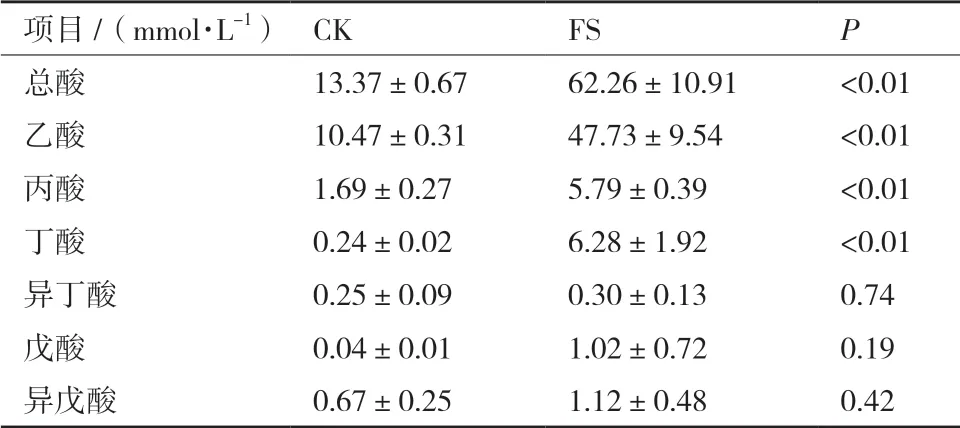
表1 谷氨酸钠体外发酵24 h SCFAs产量(N=10)
2.3 谷氨酸钠体外发酵过程中pH的变化
由图2可知,本实验发酵前后pH介于6-7之间,基本处于中性的环境中。且在0 h和24 h时,FS组发酵液的pH均高于CK组。说明添加谷氨酸钠后,会影响发酵液的pH。但与CK组相比,FS组发酵液pH 的变化差异不显著。
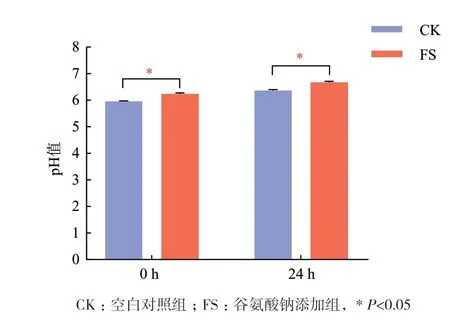
图2 谷氨酸钠体外发酵24 h发酵液的pH值
2.4 谷氨酸钠体外发酵过程中GABA产量的变化
为了研究谷氨酸钠体外发酵过程中谷氨酸钠的转化效率,测定了谷氨酸钠体外发酵液的GABA的含量。由图3可知,与CK组相比,在添加了谷氨酸钠的体外发酵过程中,GABA的含量显著增加,谷氨酸钠的转化率达72.36%。

图3 谷氨酸钠体外发酵24 h发酵液的GABA含量
2.5 谷氨酸钠体外发酵过程中GAD酶活力的变化
为了研究体外发酵过程中肠道微生物转化谷氨酸生成GABA的机制,测定了FS组体外发酵液中的GAD活力。由图4可知,10组添加了谷氨酸钠的发酵液中均能检测到具有GAD活力,且不同发酵液中的GAD活力不同。其中不同个体之间酶活力的差异较大,3号样本发酵液中检测到的酶活力最高,为0.57 IU/mL,10号样本发酵液中酶活力最低,为0.18 IU/mL。

图4 谷氨酸钠体外发酵24 h发酵液中GAD的活力
2.6 谷氨酸钠体外发酵对人体肠道菌群结构的影响
通过对原始粪便组(HF)及谷氨酸钠添加组(FS)体外发酵24 h发酵液样本的16S微生物多样性分析,20个样本共获得原始测序序列7 193 466个,经质控后,共获得优化序列948 227个。对优化序列进行OTU聚类分析,总计获得具有97%相似性的OTU 343个。其中,HF组特有的OTU有47个,占总OTU数量的13.70%;FS组特有的OTU有14个,占总OTU数量的4.08%。
2.6.1 谷氨酸钠体外发酵对人体肠道菌群多样性的影响 由图5-A可知,FS组的Shannon指数显著低于HF组(P<0.01),即添加谷氨酸钠降低了肠道菌群的Alpha多样性。基于Bray-Curtis距离算法,使用主坐标分析(PCoA)分析OTU水平下两组样本的Beta多样性,比较两组样本的组间差异性。由图5-B可知,两组发酵液中的微生物群落空间分离和聚类显著(Anosim,R=0.735 1,P<0.01),说明添加谷氨酸钠显著影响样本间的群落分布。
2.6.2 谷氨酸钠体外发酵对人体肠道菌群丰度的影响 为了探究谷氨酸钠发酵对人体肠道菌群丰度的影响,对HF组及FS组体外发酵液样本的物种组成成分及差异显著性进行分析。由图6-A可知,在门水平上,与HF组相比,FS组优势物种的相对丰度明显不同。在HF组中,厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobateria)为主要菌门(分别为74.3%、11.8%和11.6%)。以谷氨酸钠为底物发酵24 h后,发酵液中的厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)的相对丰度显著降低(分别为36.6%和3.6%,P<0.01),变形菌门(Proteobateria)的相对丰度升高(34.8%,P<0.05),同时拟杆菌门(Bacteroidete)的相对丰度也显著升高(12.7%,P<0.001)。

图5 谷氨酸钠体外发酵前后群落Alpha多样性(A)和主坐标分析(PCoA)(B)
进一步选取相对丰度前30的细菌,进行属水平相对丰度的比较(图6-B)。由图6-B可知,在HF组中,埃希氏菌属(Escherichia-Shigella)、拟杆菌属(Bacteroides)和拉克诺氏菌属(Lachnoclostridium)的相对丰度分别为8.8%、0.8%和0.2%。以谷氨酸钠为底物发酵24 h后,这3种菌属的相对丰度显著升高(分别为30.3%、9.7%和4.0%,P<0.05),梭杆菌属(Fusobacterium)和毛螺菌属(Lachnospiraceae)的相对丰度也有所升高。同时,谷氨酸钠的添加可显著降低布劳特氏菌属(Blautia)、粪杆菌属(Faecalibacterium)、双歧杆菌属(Bifidobacterium)和罕见小球菌属(Subdoligranulum)的相对丰度(P<0.05)。
2.6.3 谷氨酸钠体外发酵中代谢通路分析 通过PICRUSt对两组发酵液中的微生物群落进行COG功能预测,发现两组样本的COG功能组成较为相似。对两组菌群KEGG 功能(enzyme)丰度进行分析,发现gad的丰度有所升高,该酶对应的KEGG通路为丙氨酸、天冬氨酸和谷氨酸的代谢通路图(KO00250)中的谷氨酸代谢通路(图7)。
3 讨论
饮食中的营养物质可被肠道菌群发酵产生短链脂肪酸(SCFAs),能够提供能量、调节炎症、扩张血管以及促进肠道伤口愈合,对肠道健康有深远的影响[14]。本研究发现,谷氨酸钠体外发酵后,发酵液中的乙酸、丙酸和丁酸的含量显著增加。其中乙酸产量虽最高,但丁酸的增长倍数最大,有研究结果表明谷氨酸发酵是丁酸的主要来源之一[15],与本文的结论相一致。
产气量和pH值是肠道菌群评价产品发酵能力的指标[16]。发酵产生的SCFAs可以降低肠道环境pH值,提供酸性环境从而减少有害菌的生长[17-18]。然而,本研究中谷氨酸钠体外发酵过程中虽产生了大量的SCFAs,但是发酵液pH值的变化并不明显。谷氨酸代谢的途径之一是在GAD的作用下,将谷氨酸脱羧生成GABA,GAD通过脱羧反应消耗质子来维持细菌环境的pH值[19]。同时,本研究在发酵液中检测到GAD的活力以及产物GABA,说明在谷氨酸钠体外发酵过程中,谷氨酸钠在GAD的作用下脱羧产生了GABA。因此推测本研究中pH值不变,主要是由于谷氨酸钠体外发酵过程中,发酵产生的SCFAs和谷氨酸脱羧反应共同调节了发酵液的pH值。
16S微生物多样性测定结果显示谷氨酸钠的添加降低了肠道微生物的多样性。Wang等[20]研究发现,在体外发酵过程中,由于营养物质单一、微生物代谢产物不丰富,导致了体外发酵肠道微生物的多样性降低。然而,尽管体外发酵具有一定的局限性,但是其仍具有一定的研究意义及可信度。且体外发酵的方法不构成伦理约束,并允许动态取样研究微生物的活性。同时,Sasaki等[21]发现体内研究的结果与体外发酵的结果基本一致。因此,体外发酵是研究肠道微生物功能的有效方法之一。
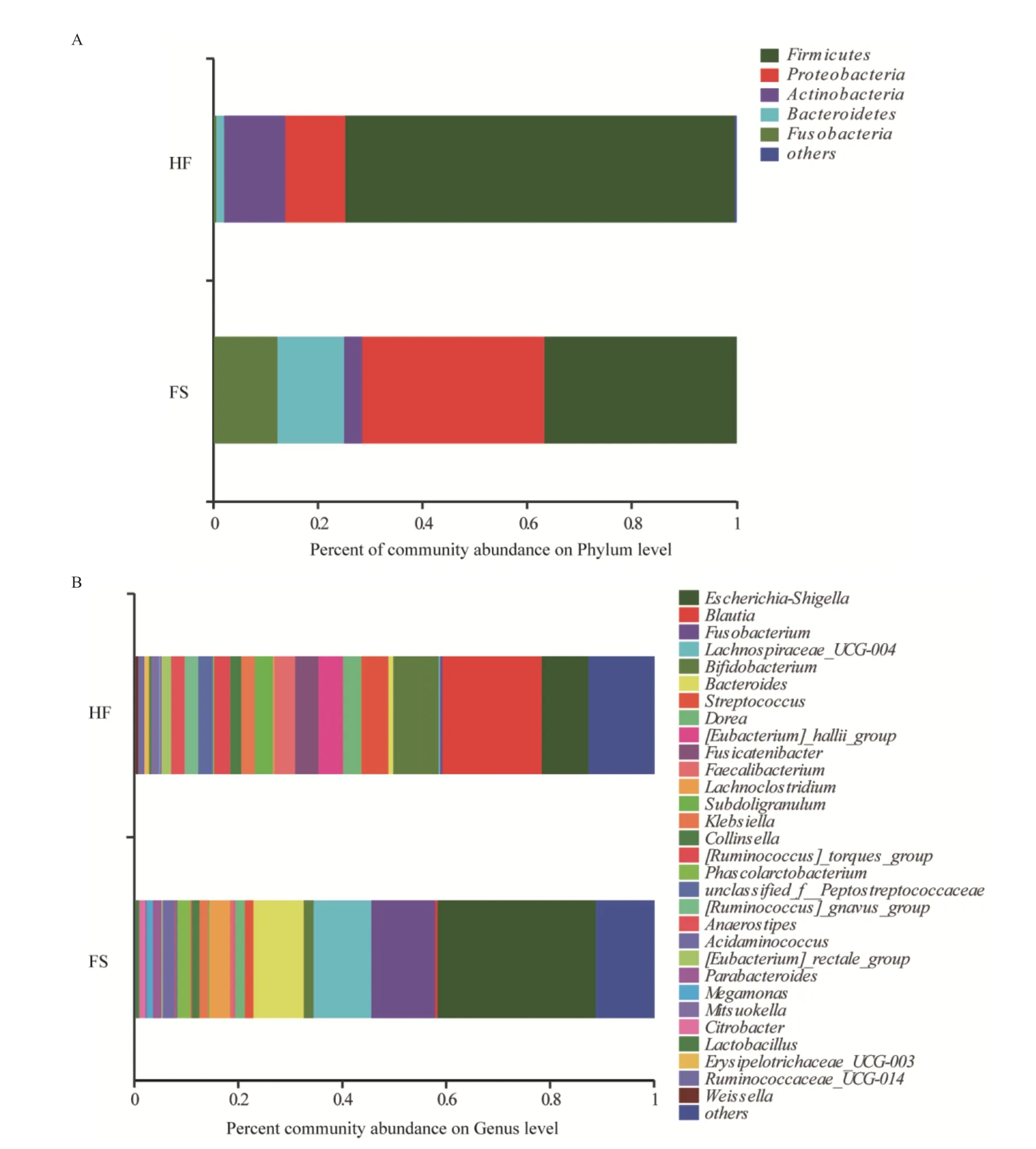
图6 谷氨酸钠体外发酵过程中肠道微生物群落组成变化门水平(A)和属水平(B)
通过PCoA及群落组成成分及差异分析发现,谷氨酸钠体外发酵对肠道菌群组成及丰度影响显著。其中,添加谷氨酸钠的发酵组的菌门结构及丰度发生了显著的改变,厚壁菌门和放线菌门的相对丰度降低,拟杆菌门和变形菌门的相对丰度升高。厚壁菌门主要分解纤维类物质,拟杆菌门主要分解非纤维类碳水化合物和蛋白质[22],这与本研究结果一致。谷氨酸钠体外发酵后,属水平微生物组成也发生了显著变化,布劳特氏菌属(Blautia)和双歧杆菌属(Bifidobacterium)的相对丰度显著降低,双歧杆菌被认为是人体有益菌,能够促进人体对多糖的降解及利用[23]。埃希氏菌属、拟杆菌属和拉克诺氏菌属的相对丰度显著升高。其中,GABA产生通路活跃表达在拟杆菌属和埃希氏菌属中,且拟杆菌属能产生大量的GABA[24]。梭杆菌属和毛螺菌属的相对丰度升高,梭杆菌属可以产生丁酸,而毛螺菌属缺乏产生丁酸途径,只有在产生丁酸的共生体时才会释放一部分丙酮酸来产生丁酸[25]。丁酸是肠道菌群发酵碳水化合物后产生的重要短链脂肪酸之一,具有抗炎症、保护肠道黏膜屏障等有益功能,并可能缓解肥胖,在细胞能量代谢和肠道稳态方面发挥重要作用[26]。因此,谷氨酸钠的体外发酵可影响肠道微生物的组成及相对丰度,并促使产生丁酸及GABA。

图7 谷氨酸钠体外发酵氨基酸代谢通路图
Liu等[11]研究发现,肠道微生物拟杆菌属中的多形拟杆菌作为一株谷氨酸发酵共生菌,其与血清中谷氨酸的浓度呈负相关,该菌中的gad基因的丰度与谷氨酸的浓度呈负相关。本研究中,拟杆菌属的相对丰度显著增加且检测到GAD活力以及GABA。因此推测谷氨酸钠的摄入使拟杆菌属的相对丰度升高,同时拟杆菌属通过分泌GAD代谢谷氨酸产生GABA。通过PICRUSt对发酵液微生物进行KEGG 功能(enzyme)丰度分析,gad的丰度升高。后续可以利用宏基因组检测,挖掘代谢谷氨酸的潜在基因,进一步阐明谷氨酸在肠道中的代谢机制。
4 结论
本研究利用体外发酵系统,初步探究了谷氨酸钠发酵对肠道微生物的影响以及肠道微生物转化谷氨酸的机制。与原始粪便样本相比,谷氨酸钠发酵提高了乙酸、丁酸和丙酸的产量,其中丁酸的产量增加了26倍;体外发酵后,底物谷氨酸钠的转化率达到72.36%。同时,埃希氏菌属和拟杆菌属的相对丰度显著升高,推测在肠道微生物中埃希氏菌属和拟杆菌属对谷氨酸的转化具有潜在作用。
致谢
感谢浙江省农业科学院微生物研究所王欣研究员对本实验的指导和帮助。

