土壤微生物对异噁草酮连续施用的响应
张盈 吴小虎 李晓刚 段婷婷 徐军 董丰收 刘新刚 郑永权
(1. 贵州省农业科学院植物保护研究所,贵阳 550006;2. 中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室 农业农村部农产品质量安全生物性危害因子(植物源)控制重点实验室,北京 100193;3. 湖南农业大学植物保护学院,长沙 410128)
异噁草酮、异恶唑啉酮类为选择性苗前除草剂,因其具有除草谱广、持效期长、适应性强等特点而被广泛应用于防除大豆、水稻、甘蔗、油菜等田中的一年生杂草[1-2]。目前,我国已登记的异噁草酮产品50个,登记在大豆上的产品45个,是我国大豆田中除草剂使用较多的除草剂之一。然而,异噁草酮通常是土壤喷雾直接作用于土壤。而且,土壤中的异噁草酮降解缓慢,半衰期达10-137 d,残存的异噁草酮刺激东北黑土中细菌和真菌的生长,抑制了多酚氧化酶活性[3],对土壤微生物活性存在潜在风险。
土壤微生物是非常敏感的组分,在土壤中发挥着重要的生态系统功能。土壤中微生物群落是评价土壤生态系统稳定的重要指标[4],能够通过改变群落结构和功能等方式对环境变化作出响应。目前,异噁草酮对于土壤微生物的影响大多数集中室内培养条件下微生物种类、数量以及群落组成的影响[3,5-6],如刘亚光等[3]研究结果表明异噁草酮(200 μg/kg、500 μg/kg和700 μg/kg)刺激东北黑土中细菌和真菌的生长,Tomco等[5]发现厌氧条件下异噁草酮降低了土壤中总PLFA含量,好氧条件下改变了放线菌的生长动态,Du等[6]研究发现80 mg/kg异噁草酮显著降低粉砂质壤土和黑土中细菌α多样性,改变群落结构以及影响了NO3--N浓度、固氮菌(nifH)及氨氧化细菌(AOB)基因拷贝数。
随着生物信息技术的不断发展,土壤微生物的相关研究由群落组成向微生物间的相互作用和功能转变。微生物间的相互作用不仅决定微生物群落的复杂结构,而且深入影响群落功能执行[7-8]。马垒发现砂姜黑土区长期施用磷肥提高了真菌网络的复杂度,增强群落稳定性,增加对外界环境变化的“抵抗力”[9]。Mendes等[10]网络分析发现抗性菜豆增强根际土壤微生物种群间关联程度,降低病原菌对根部的侵染成功率。Gu等[11]利用FAPROTAX(Functional Annotation of Prokaryotic Taxa)预测了施用有机肥和化学肥料的茶园土壤细菌元素循环功能差异。因此,本文研究了异噁草酮对土壤细菌和真菌的影响,在此基础上,构建土壤中的微生物群落分子生态网络以及对细菌群落进行功能预测,解析异噁草酮胁迫下微生物网络结构中的微生物间的互作关系以及N循环功能菌群的响应,为评价其对土壤生态环境效应提供参考依据。
1 材料与方法
1.1 材料
药剂:异噁草酮原药(96%),山东潍坊先达化工有限公司生产;作物:大豆(中黄13号);土壤:河北省廊坊市安次区炊庄中国农业科学院廊坊科研中试验基地(N39°30'55",E116°36'52")2年未进行任何农事操作和施药的0-15 cm表层土壤,去除植物残体和石块等杂质、混匀,2 mm过筛备用;供试土壤特性:粉砂质壤土,pH为8.3,有机质含量13.7 g/kg,速效钾含量134 mg/kg,有效磷含量41.5 mg/kg,和分别为3.61 mg/kg和60 mg/kg。
1.2 方法
1.2.1 实验设计 试验于2017-2018年在中国农业科学院植物保护研究所的设施日光温室内(N 40°2’2”,E106°17’33”)进行。试验共设置2个处理:T1:1 200 g a.i./hm2,田间推荐剂量以及CK:空白对照,每个处理5个重复。在长575 mm×宽390 mm×高250 mm的塑料箱中装入35 kg 供试土壤后均匀播种15粒大豆,于苗后1-2片复叶期喷施异噁草酮。2017年和2018年各喷施1次。第2次喷药后第7、15、30、60、90天采集土样,一份用于测定异噁草酮残留量,一份用于提取DNA后进行细菌、真菌扩增子测序和qPCR绝对定量测定土壤细菌、真菌以及氮循环相关的功能菌群(固氮菌nifH、氨氧化细菌AOB和氨氧化古菌AOA)的拷贝数。
1.2.2 土壤中异噁草酮残留量检测 参照Du等[6]报 道 的QuEChERS提 取、UPLC-MS/MS(TQD,Waters)检测土壤中异噁草酮浓度。土壤样品经0.2%甲酸乙腈提取,离心后取上层清液过0.22 μm滤膜,超高效液相色谱分离,电喷雾电离、正离子扫描、三重四级杆串联质谱以多反应监测模式下进行检测,基质匹配标准品外标法定量分析。异噁草酮定量离子对为240.2>125.1m/z。添加回收浓度为:0.1 mg/kg、0.5 mg/kg和5 mg/kg,每个浓度重复5次。
1.2.3 DNA的提取和qPCR检测 土壤总DNA采用FastDNA® SPIN Kit for Soil试剂盒(mp biomedicals,Santa Ana,CA,USA)提取。每个样本称取0.5 g干重的鲜土,按照说明书操作提取DNA。以1.5%琼脂凝胶电泳检测DNA完整性,Nanodrop 2000测量其浓度和纯度。
参照Du等[6]的方法中引物和扩增程序进行实时荧光定量PCR(Real-Time PCR,RT-PCR)测定细菌、真菌、氮循环功能菌群(nifH、AOA和AOB)拷贝数。标准曲线用10倍稀释质粒制作,20 μL反应体系由10 μL iTaq Universal SYBR Green Supermix(Bio-Rad,Hercules,CA,USA),7 μL水,1 μL 10 μmol/L正反向引物和1 μL土壤DNA样本。扩增效率为83.2-104.5,R2≥0.992 8。
1.2.4 细菌和真菌群落的扩增子测序 用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')引物对细菌16S rRNA V3-V4区进行PCR扩增[12],特异性引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')[13]对真菌ITS1区进行PCR扩增,将纯化后的扩增片段使用Illumina HiSeq 4000基因文库在PE250的读取长度下测序。相关测序工作由上海美吉生物医药科技有限公司完成。
原始测序序列使用Trimmomatic 软件质控,FLASH软件进行拼接,UPARSE软件(version 7.1 http://drive5.com/uparse/)去除单序列和嵌合体后按照97%的相似度对序列进行OTU(Operational Taxonomic Units)聚类。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,16S比对Silva138/16S_bacteria数据库,ITS对比unite8.0/its_fungi数据库,设置比对阈值为70%。
1.2.5 数据分析 双指数动力学模型Y=A×e(-k1×t)+B×e(-k2×t)(KinGUIIv2.1 巴斯夫作物有限公司)分析异噁草酮在土壤中的降解情况。处理组与对照组间细菌、真菌以及氮循环相关的功能菌群拷贝数采用SPSS 22.0进行t检验分析(P<0.05,P<0.01)。
细菌和真菌扩增子测序结果去除线粒体和叶绿素序列后按最小样本序列数抽平,使用mothur(version v.1.30.1)分析计算样品的Alpha多样性值(Shannon指数和heip指数)。基于abund_jaccard算法、Canberra算法分别进行细菌和真菌群落进行主坐标分析(PCoA)分析,ANOSIM分析计算R值和P值。
为评估CK和T1土壤中微生物的互做情况,基于16S 和ITS扩增子测序数据进行分子生态学网络分析(http://ieg4.rccc.ou.edu/mena/login.cgi),构建分子生态网络并计算特征参数。网络拓扑结构由模块内连通度(Zi)、模块间连通度(Pi)来进行表述。通过外围节点(Zi≤2.5,Pi≤0.62),模块枢纽(Zi>2.5,Pi≤0.62),联络者(Zi≤2.5,Pi>0.62)、网络枢纽(Zi>2.5,Pi>0.62)确定关键物种[14]。网络图用Cytoscape 3.7.1绘制。
FAPROTAX http://www.ehbio.com/ImageGP/index.php/Home/Index/PiCrust.html注释细菌OTU的N循环功能[15]。
2 结果
2.1 异噁草酮在土壤中的消解动态
由表1可知,异噁草酮在土壤中平均回收率为88%-102%,相对标准偏差(RSD)为1.9%-5.5%,方法的准确性和精密性均满足农药残留检测的要求[16]。根据SANTE/12628/2019以添加回收最低水平作为分析方法的定量限(LOQ),异噁草酮在土壤中的LOQ为0.1 mg/kg。
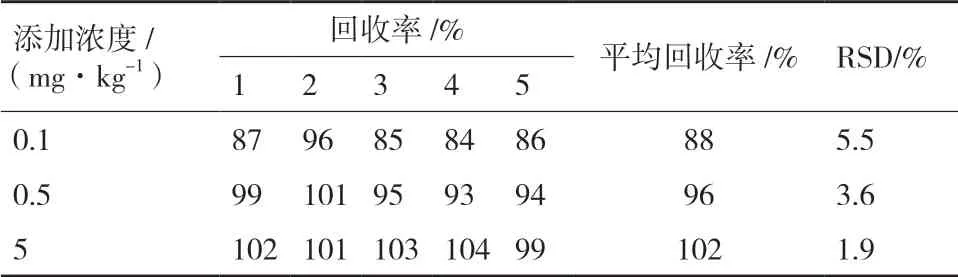
表1 异噁草酮在土壤中的回收率及相对标准偏差(n=5)
异噁草酮喷施2次后在土壤中残留消解动态如表2所示。2次施药后第1天平均残留量为5.0 mg/kg,第30天消解率达到72.1%,第90天消解率达到90.7%。降解曲线符合双指数动力学模型:Y=4.7843×e-0.04721t+0.5989×e-0.0014t,半衰期为17.4 d。
2.2 异噁草酮对土壤中总细菌含量和Alpha多样性的影响
施用异噁草酮对土壤总细菌16S rDNA拷贝数、shannon、heip指数的影响见图1。第2次施药后第15天,T1中细菌拷贝数(5.04×109/g干土)比CK细菌拷贝数(6.67×109/g干土)降低了24.4%(P<0.05);30-90 d,T1与CK差异不显著(P>0.05)(图1-A)。

表2 异噁草酮在粉砂质壤土中的残留量测定
16S扩增子测序结果经过质量控制后得到3 693 084 条高质量有效序列(每个样品47 553-97 541条),去除线粒体和叶绿素序列、按最小样本序列数抽平后,每个样本中获得30 866条有效序列,测序结果覆盖度≥96.03%,稀释曲线呈现平滑状态,表明测序结果良好。图1-B-C所示,施药后第15天,T1中细菌shannon指数和heip指数高于对照组(P<0.05),第7、30、60、90天,T1和CK的细菌shannon指数和heip指数差异不显著(P>0.05)。
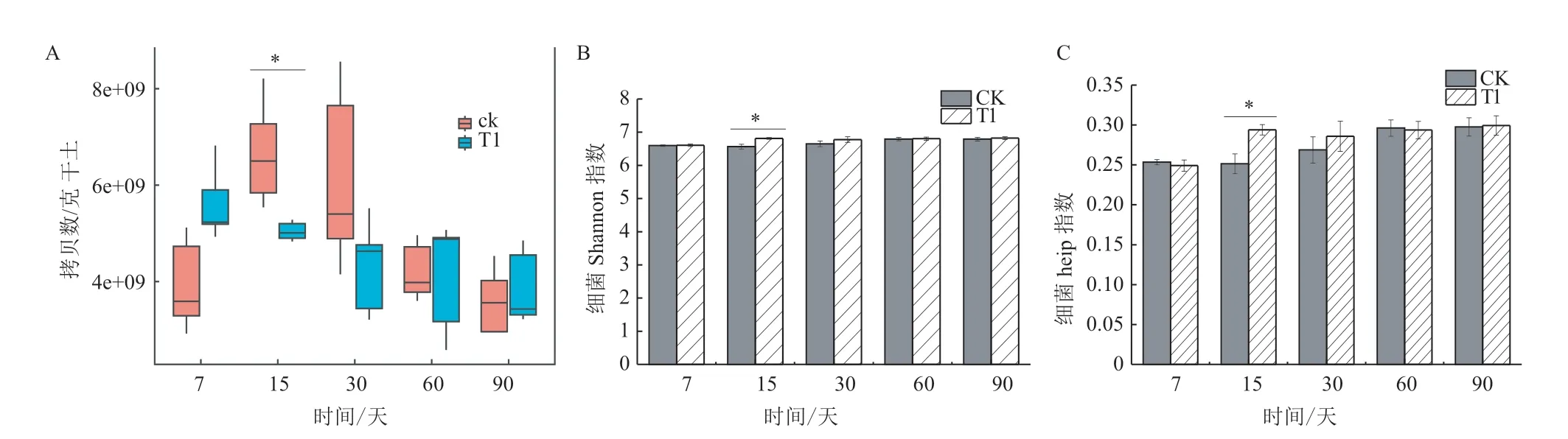
图1 异噁草酮对土壤总细菌含量和shannon、heip指数的影响
2.3 异噁草酮对土壤中总真菌含量和Alpha多样性的影响
图2-A所示,施药后第15天和60天,与CK的真菌拷贝数(2.66×108/g干土和3.34×108/g干土)相比,T1中真菌拷贝数(1.49×108/g干土和1.31×108/g干土)分别降低了43.9%和60.8%(P<0.05)。然而,第7、30、90天,T1和CK无明显差异(P>0.05)。

图2 异噁草酮对土壤总真菌含量和shannon、heip指数的影响
ITS扩增子测序结果经过质量控制后得到4 113 350条高质量有效序列(每个样品42 830-114 867条),按最小样本序列数抽平后有41 531条有效序列,测序结果覆盖度≥99.64%,稀释曲线呈现平滑状态。图2-B-C所示,施药后第15天和第90天,T1中真菌shannon指数和heip指数明显低于对照组(P<0.05),其它采样时间无显著差异(P>0.05)。
2.4 异噁草酮对细菌和真菌群落组成及Beta多样性的影响
CK和T1组土壤细菌主要由变形菌门(Proteobacteria),酸杆菌门(Acidobacteria),放线菌门(Actinobacteria),绿弯菌门(Chloroflexi),芽单胞菌门(Gemmatimonadetes)组成,在各个样本中5种菌门的相对丰度之和是72.67%-82.64%。其余相对丰度大于1%的门有拟杆菌门(Bacteroidetes),Patescibacteria门,粘球菌门(Myxococcota),浮霉菌门(Planctomycetes),厚壁菌门(Firmicutes)(图 3-A)。从门的水平上对不同处理土壤样品中细菌群落的组成进行相似性聚类分析,T1和CK之间存在一定的差异(图 3-A)。进一步运用abund_jaccard算法基于OTU水平对细菌群落进行PCoA分析,结果显示T1和CK的群落组成在整个实验期间都存在明显差异(P= 0.004-0.008,R=0.6160-0.9600)(图3-B-F)。
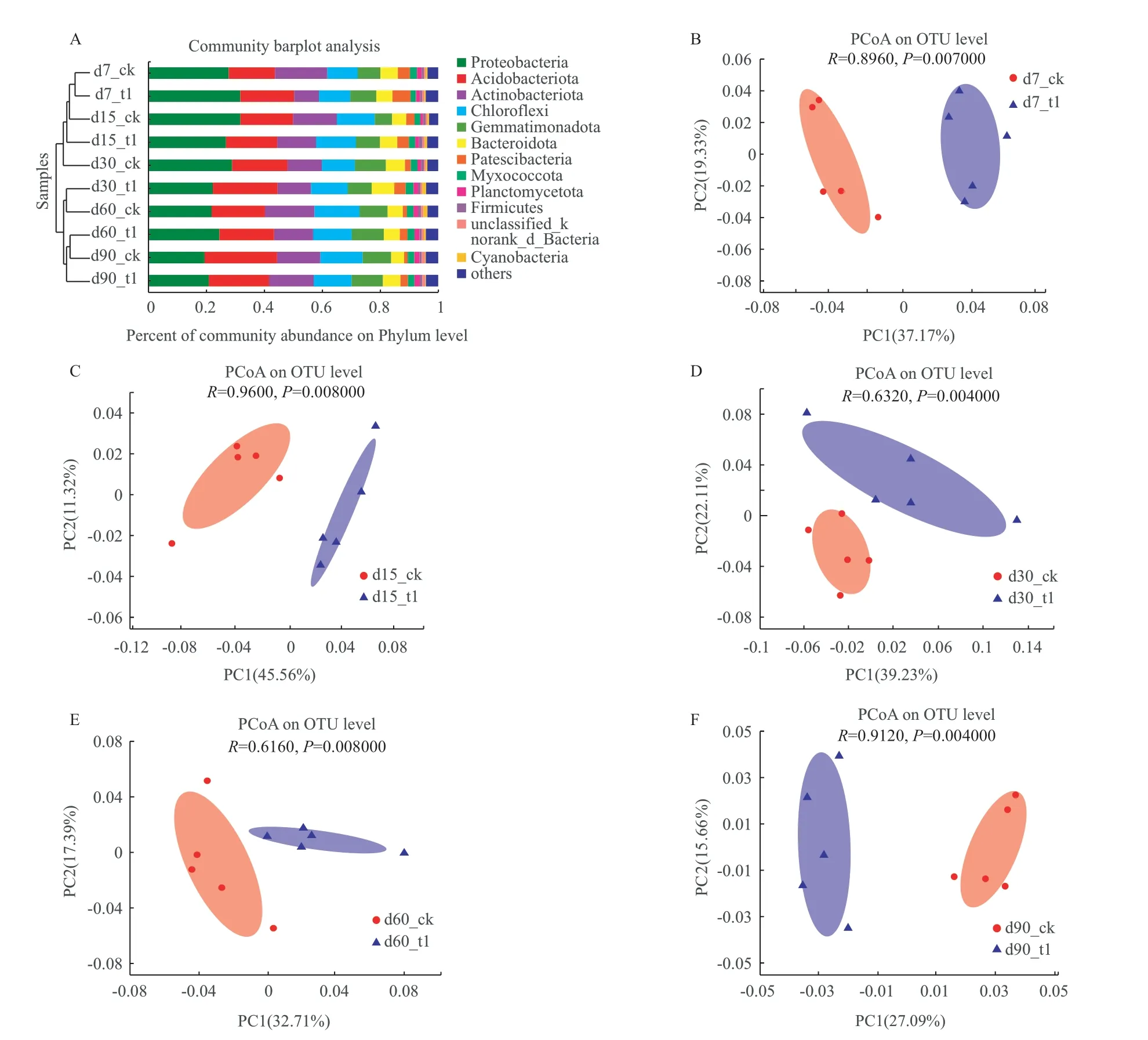
图3 不同样本中细菌门的相对丰度和基于OTU水平细菌群落PCoA图
子囊菌门(Ascomycota)是真菌群落中的优势菌门(图4-A),在CK和T1处理组中的平均相对丰度分别72.24%-93.63%。其余大于1%的门是担子菌门(Basidiomycota)、被孢菌门(Mortierellomycota)。子囊菌门、担子菌门和被孢菌门的序列数之和占真菌总序列数的86.82%-99.66%。从门的水平上对样本中真菌群落的组成进行相似性聚类分析,除第7天外,第15-90天T1和CK之间存在差异。运用Canberra算法基于OTU水平对细菌真菌群落进行PCoA分析,发现T1和CK的群落组成在整个实验期间都有明显的差异(P= 0.004-0.0110,R=0.416-0.720)(图4-B-F)。
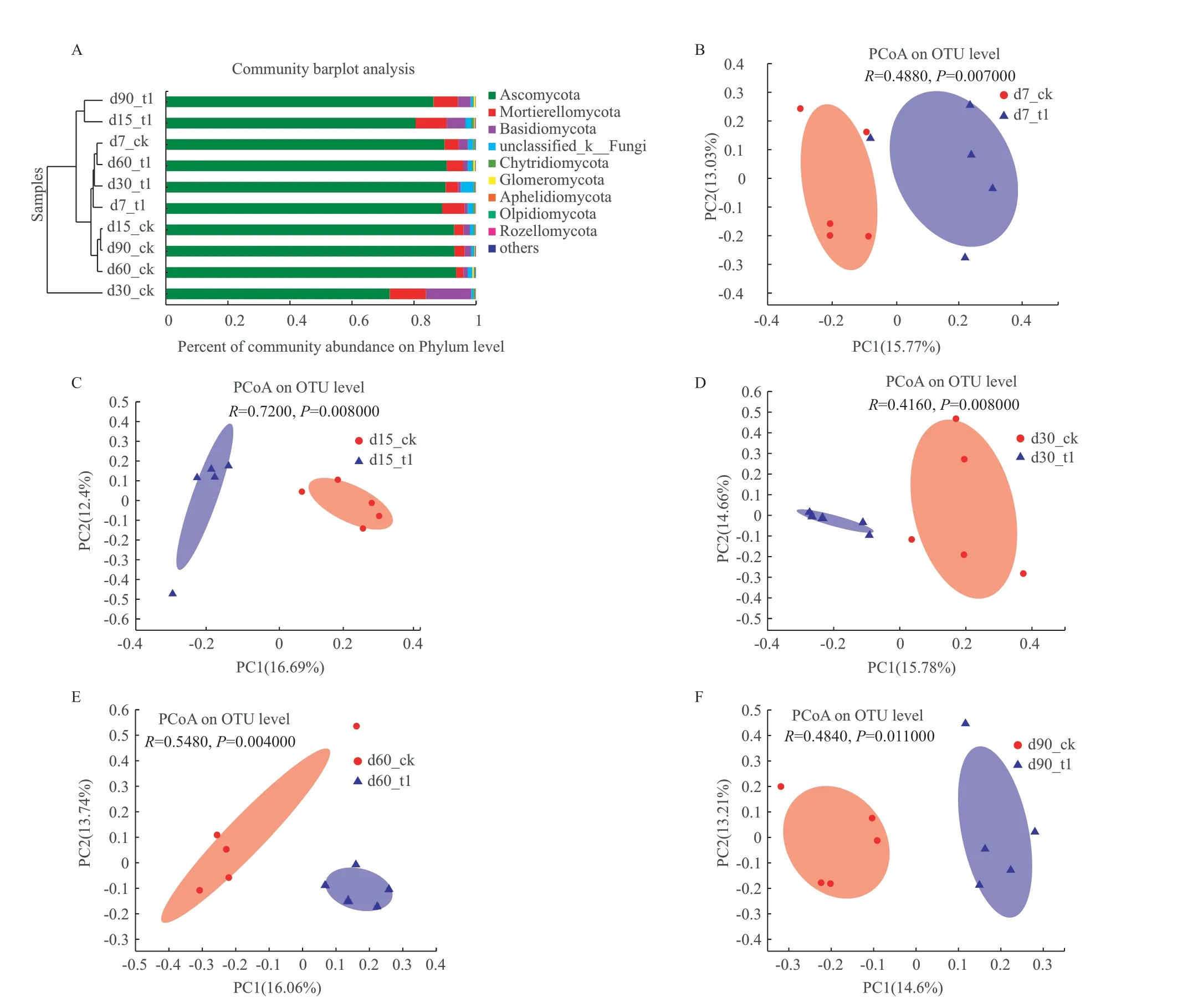
图4 不同样本中真菌门的相对丰度和基于OTU水平真菌群落PCoA图
2.5 异噁草酮处理下土壤微生物群落的分子生态网络分析
通过筛选并保留80%样本中同时出现的OUT构建系统发育分子生态网络,具体见图5-A和表3。表3可得,经验网络的平均聚类系数和模块性指数明显高于相应的随机网络,说明本研究构建的网络为小世界网络[17]和模块网络[14]。T1中节点数、连接数、平均度以及平均路径长度高于CK,这些指标的差异在一定程度暗示了喷施异噁草酮使土壤微生物网络结构更复杂。
系统发育分子生态网络按模块团体归因布局,去除网络中小于5个节点的模块。如图5-A 所示,CK有12个模块,T1有13个模块,且T1中真菌OUT节点消失。图5-B显示,大部分节点(>97%)属于外围节点;CK和T1中均无网络枢纽。CK和T1中模块枢纽和联络者显著改变。网络中有12个模块枢纽,其中CK中有5个(OTU4502、OTU3456、OTU3739、OTU3639和OTU3738);T1中7个(OTU3540、OTU3423、OTU3461、OTU3717、OTU2896、OTU 3725和OTU3507)。OTU3372、OTU3422和OTU3456属于CK网络中的联络者,OTU3350、OTU3604、OTU3672和OTU3720属 于T1网络中联络者。2种网络中的模块枢纽属于真菌被孢霉门和细菌芽单胞菌门、酸杆菌门、放线菌门、变形菌门、绿弯菌门,联络者中是酸杆菌门、Patescibacteria门和变形菌门(表4)。
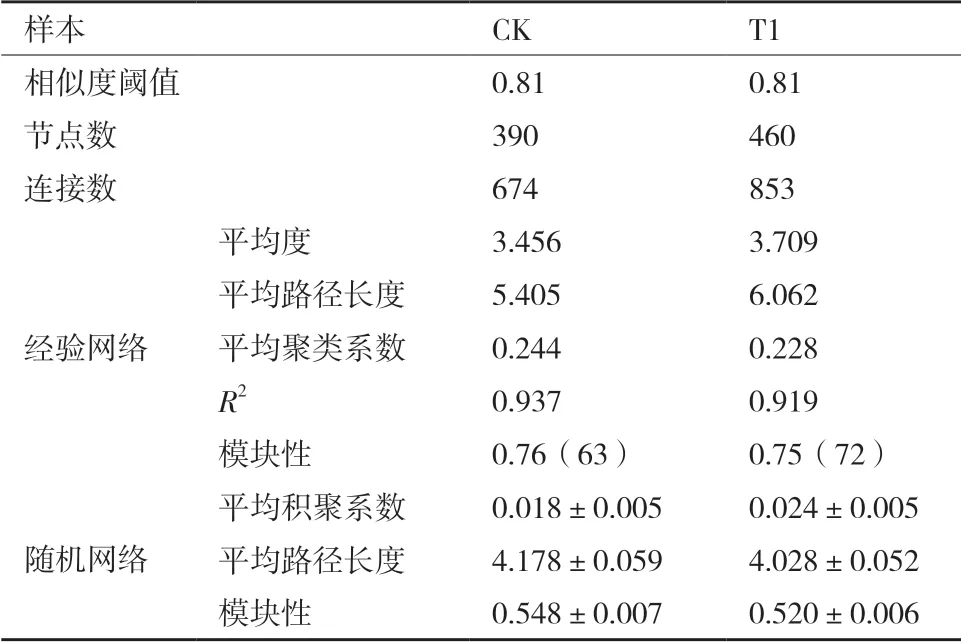
表3 T1和CK的网络拓扑特性
2.6 异噁草酮对土壤N转化功能微生物的影响
异噁草酮处理对固氮菌nifH、AOA、AOB基因拷贝数的影响见图6。nifH、AOA、AOB基因拷贝数为3.96×107-3.19×108、7.05×106-2.53×108和2.15×106-1.78×107/g干土。对于nifH,施药后第15天,nifH基因拷贝数增加了20.3%(P<0.05);其它采样时间,T1和CK无明显差异(P>0.05)。对于AOB,施药后第60天,AOB基因拷贝数降低了45.2%,第90天增加了72.4%(P<0.05);7-30天无显著差异(P>0.05)。对于AOA,施药后7-90天,T1与CK 间无显著差异(P>0.05)。
FAPROTAX功能预测发现,第7天增加了固氮族群微生物,第15天降低了硝酸盐反硝化、亚硝酸盐反硝化、氧化亚氮反硝化、反硝化、亚硝酸盐呼吸,第30天降低了反硝化作用,第60天降低了硝酸盐氨化、亚硝酸盐氨化、氧化亚氮反硝化、反硝化、亚硝酸盐呼吸,第90天降低了反硝化,增加了固氮、硝酸盐呼吸、氮呼吸(图7)。
3 讨论
本研究发现温室条件下,土壤中异噁草酮降解呈现先快后慢的趋势,前30 d降解率高达72.1%,后期降解18.6%。前期降解速率快可能是由于异噁草酮添加土壤后,有一部分处于自由溶解态或被弱吸附状态,作为微生物生长的碳源;随后的缓慢降解阶段可能是由于不同的吸附位点或随着时间的推移吸附量增加所致[18]。其它研究,如氟磺胺草醚、氟乐灵等除草剂在土壤中的降解动态也呈现同样的趋势[19-20]。
连续两次施用异噁草酮后,第15天显著抑制细菌含量,却显著增加其群落多样性和均匀度,这表明不同的细菌种群对异噁草酮响应不同。而且,CK组存在4 413种OTU,施药后OTU增长至4706种,进一步证明异噁草酮的处理,增加了某些细菌物种。其它培养时间,处理间细菌含量无显著性变化。Du等[6]研究发现,室内培养条件下,0.8 mg/kg异噁草酮(推荐剂量)处理对土壤中细菌拷贝数和多样性没有显著影响。这些结果表明异噁草酮推荐剂量下使用,对土壤总细菌仅存在短期影响。此外,施药后第7天,真菌群落多样性和均匀度显著降低;第15-60天真菌含量呈现降低的趋势;第90天,群落多样性和均匀度再次降低。异噁草酮处理后,网络中真菌OTU节点以及模块枢纽消失,暗示了真菌对于异噁草酮更加敏感。其它研究也发现,其它化学农药如氟磺胺草醚和氯氰菊酯也导致真菌生物量减少,表明真菌对于某些农药的胁迫更敏感、更容易在胁迫下中毒[19,21]。
模块枢纽和联络者被认为是生态网络中的关键节点。分子生态网络分析发现,CK与T1网络中关键节点完全不同,这表明异噁草酮胁迫下,土壤中形成了新的关键微生物种群,以维护微生物群落与功能的稳定。异噁草酮胁迫下,酸杆菌门Blastocatellia纲菌群、新鞘氨醇杆菌Novosphingobium和Vicinamibacteraceae菌群,变形菌门根瘤菌目菌群成为新的模块枢纽;变形菌门根瘤菌目Rhizobiales菌群、交替赤杆菌属(Altererythrobacter)科菌群成为新的联络者。Blastocatellia纲菌群能适应不同pH环境,具有降解复杂的碳化合物的能力[22]。新鞘氨醇杆菌是代谢上的多功能种群,一些文献报道具有一定的生物修复能力,可降解克百威和萘[23-24]。Vicinamibacteraceae科的一些成员能降解复杂的有机化合物,还可能有几丁质的降解基因[25]。交替赤杆菌属中一些种群能还原硝酸盐[26];根瘤菌目的一部分微生物能参与生物固氮。因此,这些新增的关键菌群可能在抵抗异噁草酮的压力以及维持土壤固有的生态功能中起着重要的作用。
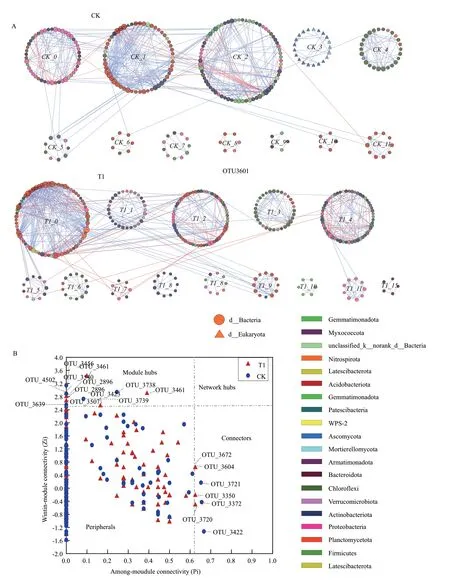
图5 基于OTU和随机矩阵理论分析的大豆土壤微生物系统发育分子生态网络

表4 不同处理中的关键OTUs
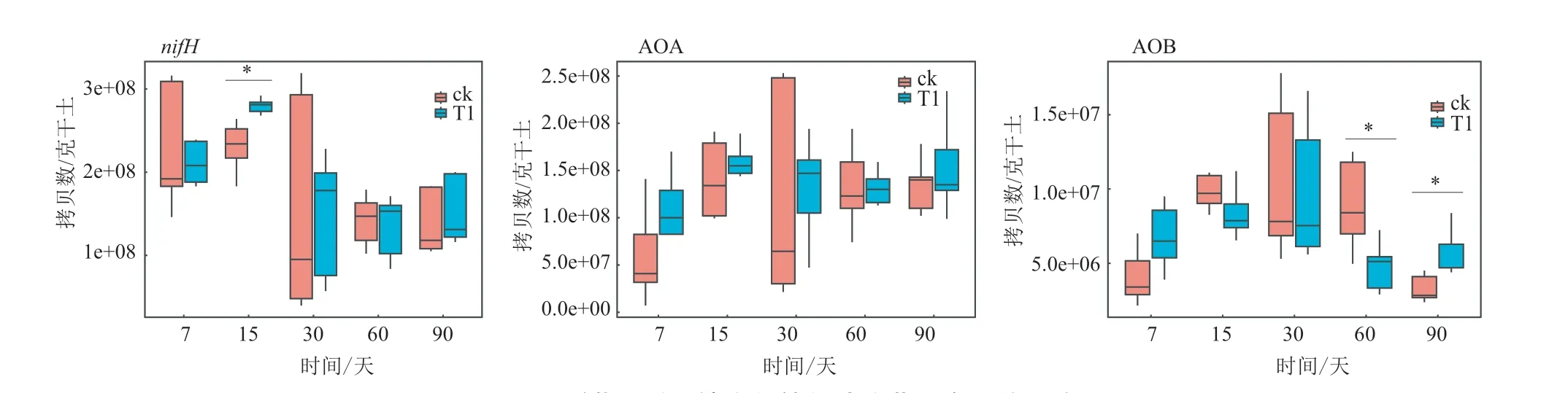
图6 异噁草酮对土壤中氮转化功能菌群含量的影响
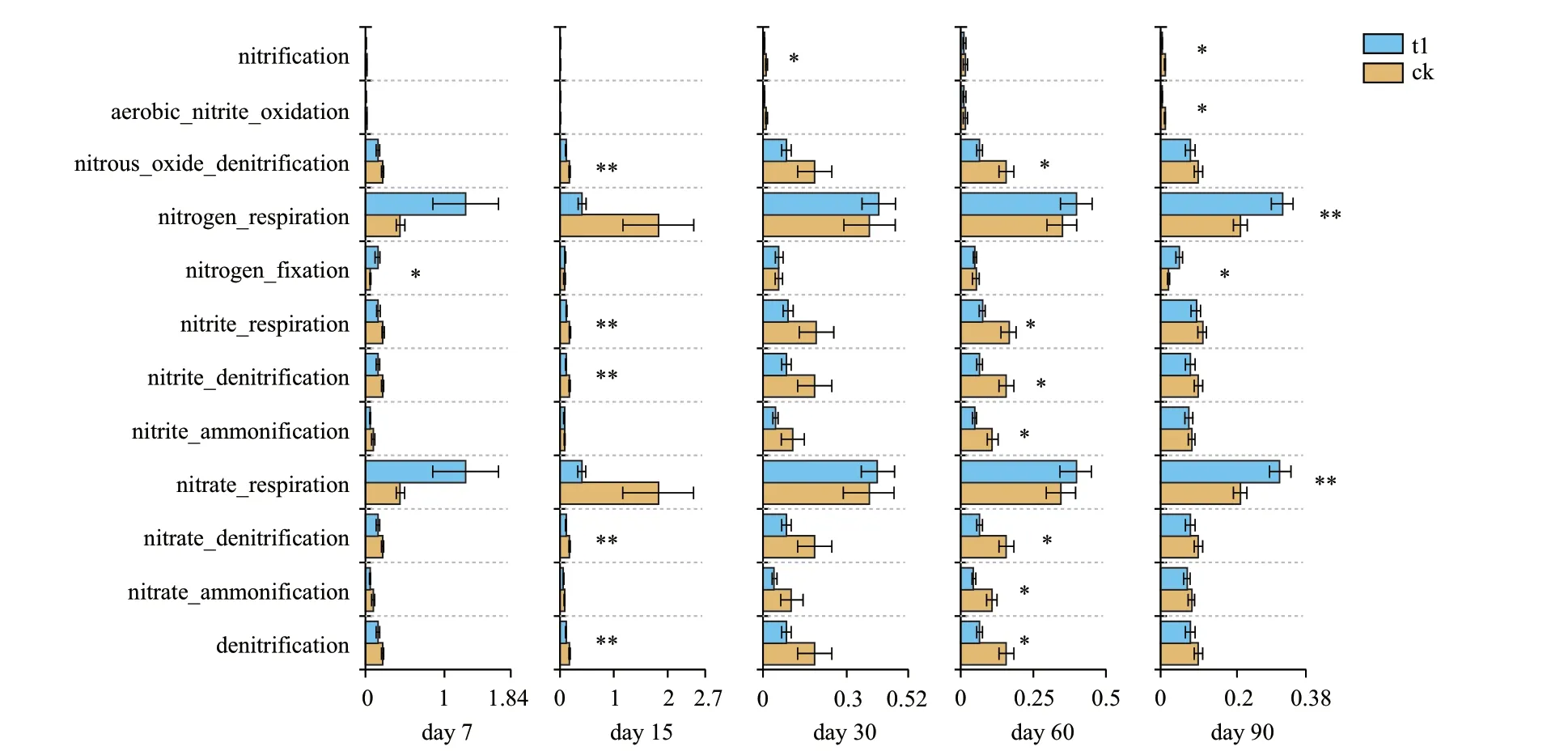
图7 FAPROTAX对空白组和异噁草酮处理组大豆土壤细菌群落功能的预测(P<0.05*,P<0.01**)
此外,异噁草酮处理后,第15天增加了固氮菌基因含量,第60天降低了AOB基因含量,与功能预测的结果一致。异噁草酮还显著降低了硝酸盐反硝化、亚硝酸盐反硝化、氧化亚氮反硝化等,表明异噁草酮可能抑制了反硝化过程。一些文献报道外源物质的加入能抑制土壤的反硝化,如硅肥使用使水稻土壤的反硝化速率下降[27],棉隆的使用降低了土壤中反硝化基因(napA、narG、nirK、nirS、qnorB)的拷贝数[28]。预测的这些细菌的潜在功能有助于明确异噁草酮对大豆土壤微生物生态系统功能的影响。异噁草酮的使用影响了土壤N循环功能,从而干扰了土壤生态的稳定性。
4 结论
研究显示田间推荐剂量连续2次施用后,短暂降低了土壤细菌含量,且真菌敏感性高于细菌,微生物群落结构显著改变,微生物间网络结构趋向复杂,关键物种发生改变,土壤N循环中反硝化过程受到显著影响。

